小鼠睾丸细胞染色体标本的制备及观察
- 格式:docx
- 大小:219.44 KB
- 文档页数:4

小鼠染色体实验报告实验目的:本实验旨在通过染色体观察和分析小鼠基因组的结构和功能,以进一步了解小鼠的遗传特征。
实验材料:1. 小鼠样本(小鼠尸体或小鼠细胞)2. 血细胞裂解液3. 显微镜4. 醋酸酒精定影液实验步骤:1. 取得小鼠样本并进行准备。
尸体样本直接取用,细胞样本需要分离提取。
2. 将小鼠样本悬浮于血细胞裂解液中,进行细胞裂解。
3. 用匀浆棒轻轻研磨,使细胞完全裂解。
4. 将细胞溶液滴于清洁平凹玻片上,并用平玻片将其铺平。
5. 将玻片加热至70℃,使细胞DNA捕获在玻片上。
6. 用醋酸酒精定影液浸泡玻片,使细胞核卷曲收缩。
7. 用显微镜观察染色体的形态和数量。
8. 根据染色体的形态、长度和着色特点进行鉴定和分析。
实验结果与讨论:通过对小鼠样本的染色体观察,我们发现小鼠染色体具有一定的结构和着色特征。
根据染色体的长度和形状,我们可以初步判断出小鼠的染色体是否正常。
特定的染色体畸变或缺失可能表明小鼠有某些遗传疾病或突变。
在本实验中,我们可以观察到小鼠的染色体数量一般为40个。
这与小鼠常见的染色体数目相符,进一步证实了样本的正常性。
我们还可以观察到染色体的长度不一致,这是由于染色体上的基因片段的数量和排列不同所致。
通过进一步的染色体分析,我们可以了解小鼠的遗传特征,如基因突变、遗传疾病等。
这对于进一步研究小鼠的遗传学、发育生物学以及相关疾病模型的建立具有重要意义。
结论:通过对小鼠染色体的观察和分析,我们可以初步了解小鼠的遗传特征。
染色体的形态和数量可以为我们提供重要的基因信息,有助于后续的研究和分析。
本实验为进一步研究小鼠的遗传学提供了基础数据。

姓名:XX 系年级:20XX级齐鲁医学班学号:20130023XXXX科目: 细胞生物学实验实验题目:动物染色体标本的制备与观察染色体标本的制备及组型观察【实验目的】1.掌握染色体标本制作的基本方法;2.认识不同生物的染色体的状态,学会做染色体组型图。
【制作染色体标本的意义】了解染色体的特征(形态、大小、数目)——绘制染色体组型图【染色体组型图的应用】①生物学方面:根据染色体特征鉴别生物及种类:兔44条;小鼠40条;大鼠42条;鸡78条;猫38条;狗78条;人46条;马64条②临床医学方面:主要用于遗传性疾病的诊断和研究:21三体综合症:是21对常染色体多一条,此种人“先天愚型”,或称“伸舌样白痴”卵巢退化症:45 XO,外貌表现为女性,卵巢发育不全或无,1.5米以下,不能生育。
睾丸退化症:47 XXY ,外貌为男性,比一般男性高,睾丸发育不全,有女性样乳房,智力低下或超常,不能生育,发声尖高。
因此,染色组型实验广泛应用于胎儿遗传性疾病早期诊断中(抽羊水做组型)【染色体标本制作的原理】选择活跃的组织:胸腺,骨髓,睾丸,小肠施加药物使细胞分裂:PHA设法得到大量的分裂中期细胞:秋水仙素1.PHA:促进细胞分裂,使淋巴细胞返幼,变成淋巴母细胞。
2.秋水仙素:破坏微管装配,使纺锤体不能形成,使大量细胞停在分裂中期。
3.空气干燥:使细胞与染色体展开。
4.低渗作用:水进入细胞内,细胞内容空间变大,染色体间的距离变大,易于染色体分散开。
5.固定:用Camoy’s solution,作用使蛋白变性,对染色体内的组蛋白讲,变形后硬度增加,保持了染色体的“即时形态”对细胞膜蛋白讲,变性使细胞膜硬度增强,形成屏障作用,防止了细胞内物质外溢和丢失。
姓名:XX 系年级:20XX级齐鲁医学班学号:20130023XXXX科目: 细胞生物学实验实验题目:动物染色体标本的制备与观察【实验用品】1.实验器材:显微镜、载玻片、盖玻片、镊子、手术剪、解剖盘、胶头滴管、离心管、离心机、小烧杯、冰箱、酒精灯、小烧杯2.实验药品:蒸馏水、0.9% NaCl溶液、0.3% KCl溶液,固定液(甲醇:冰醋酸=3:1)、秋水仙素3.实验材料:小鼠【实验步骤】1.取雄性小鼠,以每克体重4微克注射秋水仙素(约1mL),14-16h后,用断头法处死小鼠,取出睾丸用生理盐水(0.9% NaCl溶液)洗去血污,置于解剖盘中。

Isolation and staining of mouse meiotic metaphasechromosomes小鼠睾丸生殖细胞标本制作及减数分裂期染色体观察xx 2011级生科四班201100140120 同组者:xx【实验目的】1、learn to isolate mouse testes cells and stain with Giemsa.学会分离小鼠睾丸细胞并用Giemsa染液染色2、Observe the number and morphology of mouse chromosomes观察小鼠染色体的数目及形态特征【实验材料】【Reagents】秋水仙素colchicine solution吉姆萨染液Giemsa stains solution生理盐水physiological saline氯化钾溶液KCl solution固定液fixation solution【Tools and equipments】Dissecting tray,beaker,centrifuge tube,microscope,glass slide,pipette,scissors,forceps,copper mesh.解剖盘,烧杯,离心管,显微镜,载玻片,吸管,剪刀,镊子,铜网【实验原理】meiosis is a process of reductional division in which the number ofchromosomes per cell is cut in half. In animals, meiosis always results in the formation of gametes, while in other organisms it can give rise to spores. 减数分裂是细胞分裂染色体数减半的过程,在动物中,减数分裂的结果总是在形成配子,而在其他生物可以产生孢子。

简述小鼠染色体制备的流程小鼠染色体制备。
选只小鼠,得挑健康的,不能是病怏怏的那种。
然后,得给它打麻药,让它舒舒服服地睡一觉。
这样咱们就能轻松取得细胞了。
取细胞这活儿,得迅速。
从骨髓或者脾脏里取,这得看实验需求。
取出来后,咱们得让细胞在低渗环境里待会儿,这样染色体就能胀大,看得更清楚。
然后,用固定液固定一下,这样细胞形态就稳定了。
接下来,就是染色和观察了。
用专门的染料给染色体上色,让它们变得五彩斑斓的。
然后,在显微镜下瞅瞅,看看这些染色体长啥样,数数有多少个。
这可得细心点,不能漏看了。
说起来,小鼠染色体制备这事儿,看着简单,其实挺考验技术的。
得选对小鼠,还得会取细胞、染色、观察。
不过,只要技术到位,就能得到清晰的染色体,为后面的研究打好基础。

小鼠细胞分裂标本的制备与观察一、实验目的a)掌握小鼠精巢染色体标本制作法。
b)观察减数分裂过程中不同时期的染色体。
c)观察腹水瘤细胞有丝分裂中不同时期的染色体形态。
二、实验原理a)减数分裂(Meiosis)是发生于生殖细胞的一种特殊的细胞分裂方式,DNA复制一次,而细胞连续分裂两次,形成单倍体的精子和卵子。
减数分裂远比有丝分裂复杂,经两次细胞分裂,分别称减数分裂Ⅰ、减数分裂Ⅱ,两次分裂间又一个较短的间期,这个间期DNA不复制。
b)雄性动物精子发生于睾丸曲精细管的生精上皮细胞,由其中的精原细胞经多次有丝分裂和生长,形成初级精母细胞,初级精母细胞经减数分裂形成次级精母细胞,次级精母细胞有丝分裂成精细胞,再经一系列变化成精子。
c)因此,通过分离曲细精管、剪碎并加入液体吹打,可使官腔各种细胞游离出来,然后经过低渗、固定、染色等过程就可制成包含减数分裂各期的标本。
三、实验试剂及仪器a)材料:成年雄性小白鼠b)用品:注射器、平皿、尖头镊子、剪刀(普通剪刀、眼科小剪刀)、吸管、离心管、离心机、玻片等。
c)试剂:1、100μg/ml秋水仙素。
2 、2%柠檬酸钠溶液3、 0.075M的KCI4、3:1甲醇:冰醋酸及1:1甲醇:冰醋酸(应现配)5、PH6.8,0.01M的PBS缓冲液6、Gimesa原液7、Gimesa工作液:1份Gimesa原液加9份PH6.8,0.01M的PBS缓冲液,混匀。
工作液应现用现稀释。
四、实验步骤a)细胞收集i.小鼠精巢细胞收集1.注射秋水仙素,增加中期分裂相。
(试验前4-5小时,小鼠腹腔注射秋水仙素0.5ml(100μg/ml)。
2.取睾丸并清洗。
断颈处死小鼠,剖开腹部,取出肾形睾丸,放入盛有4-5 ml2%柠檬酸钠溶液的平皿中,洗去污血,去掉胞外脂肪等物。
3.挑出曲细精管并剪碎。
弃污液,另加柠檬酸钠溶液1 ml,用尖头镊尖将曲细精管拉出,并用眼科剪尽量将其剪碎。
4.游离并收集细胞。

姓名系年级组别同组者科目细胞生物学实验题目小鼠睾丸细胞染色体标本的制备及观察学号小鼠睾丸细胞染色体标本的制备及观察一.实验目的1.了解快速制备动物染色体标本的方法,掌握小鼠睾丸细胞染色体标本的制备方法。
2.观察小鼠睾丸染色体的数目及其形态特征。
3.掌握小鼠睾丸染色体标本制备基本过程,了解操作步骤的原理。
二.实验原理(一)染色体染色体是基因的载体。
真核细胞染色体的数目和结构是重要的遗传指标之一。
制备染色体标本无疑是细胞学最基本的技术之一,优良的染色体制片是进行染色体显带、组型分析、原位杂交等的先决条件。
染色体的制备在原则上可以从所有发生有丝分裂的组织和细胞悬浮液中得到。
最常用的途径是从骨髓细胞、血淋巴细胞和组织培养的细胞中制备染色体。
本实验采用的方法是从小鼠的睾丸细胞中获取。
染色体的形态结构在细胞增殖周期中是不断地运动变化的,一般在有丝分裂中期,染色体的形态最典型、最易辨认和区分。
因此,制备染色体标本获取的是中期细胞。
染色体特征:1.数目(2n=?)2.长度(绝对长度、相对长度)3.着丝粒位置(M/SM/ST/T)4.随体与次溢痕的数目、大小和位置5.带型分析(二)操作方法小型动物的染色体制片最好最有效的材料就是骨髓组织(由于分裂活动旺盛,睾丸也可以)。
利用睾丸细胞的制片技术虽然需要离心以及细致的操作,但其基本程序是简便的。
在小鼠睾丸中,细胞有丝分裂和减数分裂比较旺盛,因此不需要体外培养就可以直接得到分裂中期细胞。
通过小鼠睾丸得到染色体比较简便,一般不需要无菌操作。
用秋水仙素作为有丝分裂的抑制剂。
由于小鼠睾丸细胞分裂活动旺盛,具有高度的分裂能力,本实验采用这一材料,通过前处理、低渗、固定、制片、染色等步骤制得染色体标本,可观察到许多处于分裂中期的染色体,可以进行染色体组型分析。
减数分裂是细胞分裂染色体数目减半时发生在性细胞的形成过程中。
哺乳动物在性成熟以后,精巢内的性细胞总是在分批分期不断的成熟,因此,对哺乳动物的精巢进行一定的技术处理,随时都可以获得减数分裂过程中各个时期染色体的标本。

染⾊体核型分析姓名程开源系年级2010级临床医学⼋年制同组者孙琳、孙晶鑫、窦云德科⽬分⼦细胞⽣物学题⽬染⾊体核型分析学号201000232012【实验⽬的】1.了解⼩⽩⿏睾丸细胞染⾊体的形态及数⽬。
2.初步掌握⼩⽩⿏睾丸细胞染⾊体的玻⽚标本制作⽅法。
3.观察动物细胞染⾊体的数⽬和形态。
【实验原理】染⾊体的制备在原则上可以从所有发⽣有丝分裂的组织和细胞悬浮液中得到。
最常⽤的途径是从⾻髓细胞、⾎淋巴细胞和组织培养的细胞中制备染⾊体。
⼩型动物的染⾊体制⽚最好最有效的材料就是⾻髓组织。
⾻髓细胞中,有丝分裂指数相当⾼,因此可以直接得到中期细胞⽽不必象淋巴细胞或其它组织那样要经过体外培养;对⼤型动物通常采⽤对⾻骼、脊或胸⾻穿刺术吸取红⾻髓,⼩型动物多采⽤剥离术取股⾻以获得⾻髓细胞。
制作染⾊体标本的先决条件1. 细胞具有旺盛的分裂能⼒选择活跃的组织:胸腺,⾻髓,睾丸,⼩肠施加药物使细胞分裂:PHA2. 设法得到⼤量的中期细胞:秋⽔仙素(1) PHA:粗细胞分裂,使淋巴细胞返幼,变为淋巴母细胞(2) 秋⽔仙素:破坏微管装配,使纺锤体不能形成,使⼤量细胞停⽌在分裂中期。
(3) 低渗作⽤:⽔进⼊细胞内,细胞内容空间变⼤,染⾊体间的距离拉⼤,易于染⾊体展开(4) 空⽓⼲燥:使细胞和染⾊体展开(5) 固定:⽤甲醇:冰醋酸=3:1作⽤使蛋⽩质变性,对染⾊体内的组蛋⽩讲,变性后硬度增加,保持了染⾊体的“及时形态”,对细胞膜蛋⽩讲,变性使细胞膜硬度增强,形成屏障作⽤,防⽌了细胞内物质外溢和丢失。
对于⼩⿏精巢染⾊体标本的制作,⼀般包括以下⼏个要点: 1. ⽤⼀定剂量的秋⽔仙素破坏纺锤丝的形成,使细胞分裂停滞在中期, 使中期染⾊体停留在⾚道⾯处; 2. ⽤低渗法使将细胞膨胀, 以⾄于在滴⽚时细胞被胀破, 使细胞的染⾊体铺展到载玻⽚上; 3.空⽓⼲燥法可使使细胞的染⾊体在载⽚上展平, 经Giemsa染⾊后便可观察到染⾊体的显微图象。


课程教学C ur r i cul um T e ac hi ng 爝煎逦尉动物遗传学教学实验‘q、鼠睾丸细胞减数分裂染色体标本制作,方法改进的研究张燕军赖双英苏蕊张文广(内蒙古农业大学动物科学学院内蒙古呼和浩特010018)摘要“减数分裂期染色体制备实置F’是动物遗传学实验课程重要内容。
本文介绍了小鼠睾丸细胞减数分裂染色体标本制作的改进方法,通过本方法可制备和观察到大量分散良好、背景清晰、染色体结构紧凑的睾丸细胞减数分裂各期分裂相,得到较好的实验效果。
关键词动物遗传学睾丸细胞减数分裂染色体改进中图分类号:G424文献标识码:AA ni m al G enet i cs T eachi ng Exper i m ent’’M ous e Tes t i s M ei ot i cC hr om os om e Speci m en’’M et hods I m pr ovem entZ H A N G Y anj un,L灿Shuangyi ng,SU R ui,Z H A N G W enguang(C ol l ege of A ni m al Sci e nce,I n ner M ongol i a A gr i cul t ur al U ni ve r s i t y,H ohhot,I nne r M ongol i a010018)A bs t r ac t’’P r epa ra t i on of m ei ot i c cl l r om os om es e xper i m e nt”i s al l i m port a nt pa r t of ani m al ge net i c s experi m ent cour se.Thi sar t i cl e des cr i bes t he m ous e t est i s m ei ot i c chr om os om e s peci m en of t he i m pr o ved m et hod,can be prepar ed by t hi s m e t hod and obs erved a l ar ge num be r of w el l—di sper s ed,cl ea r backgr ound,com pact t es t i cul ar m ei ot i c cl l r om os om e st r uct ur e of e ach phas e of t he di vi s i on,ge t be t t e r ex per i m ent al r es ult s.K ey w or ds ani m al gen et i cs;t est i cul a r cel l s;m ei osi s;cl l r om os om e;i m pr ovem ent遗传学既是一门历史悠久的学科,又是一门发展迅速、实践性很强的学科,研究范围正在不断拓宽和深化,新技术、新方法不断涌现。

及观察小鼠染色体计数的意义
意义:
通过获取小鼠睾丸细胞(分裂能力强),本实验采用这一材料,通过前处理,低渗,固定,制片,染色等步骤制得染色体标本,可观察到许多处于分裂中期的染色体,可以进行染色体组型分析。
一般观察有丝分裂中期,染色体的形态最典型、最易辨认和区分。
因此,制备染色体标本获取的是中期细胞。
利用睾丸细胞的制片技术虽然需要离心以及细致的操作,但其基本程序是简便的。
在小鼠睾丸中,细胞有丝分裂和减数分裂比较旺盛,因此不需要体外培养就可以直接得到分裂中期细胞。
通过小鼠睾丸得到染色体比较简便,一般不需要无菌操作。
用秋水仙素作为有丝分裂的抑制剂。
由于小鼠睾丸细胞分裂活动旺盛,具有高度的分裂能力,本实验采用这一材料,通过前处理,低渗,固定,制片,染色等步骤制得染色体标本,可观察到许多处于分裂中期的染色体,可以进行染色体组型分析。
实验四小鼠生殖细胞染色体有带核型标本制备及带型分析【实验原理及目的】真核体生殖细胞的形成是采取一种特殊方式的细胞分裂,即减数分裂。
在这一过程中,染色体只复制一次而核连续分裂两次,从而使细胞染色体数目减半。
本实验以小鼠精巢为实验材料,掌握小鼠精巢染色体及其有带核型标本的制作方法,了解不同带型的特点,观察减数分裂过程中不同时期染色体及细胞类型。
【实验材料及器具】性成熟的雄性小鼠、0.04%秋水仙素、2%柠檬酸钠、0.075mol/LKCl、冰醋酸、甲醇、pH6.8 磷酸缓冲液、pH6.8Giemsa 稀释液、0.1%胰酶溶液、0.1mol/LHCl、5%氢氧化钡溶液、2×SSC 溶液、天平、解剖器材、注射器、平皿、吸管、10ml 离心管、离心机、载玻片、染缸、水浴锅、恒温箱、恒温烤片仪、显微镜、显微照相设备、图片放大器材、胶卷、像纸及显定影器材等。
【实验方法及步骤】1.秋水仙素处理:取小鼠睾丸前3~4h,于小鼠腹腔内注入0.04%秋水仙素、每10g 体重注射0.1ml。
2.取细精小管:用断脊髓法处死动物,解剖取其睾丸置于2%柠檬酸钠溶液的平皿中。
然后用小剪刀剪开其外层白膜,用眼科镊子从睾丸中挑出细精小管,在平皿中用2%柠檬酸钠洗涤后置于5ml 2%柠檬酸钠溶液的离心管中。
3. 制备细胞悬液:待细精小管沉于离心管底后,用滴管头将细精小管研碎,经反复研磨和吹打,使处于减数分裂过程中的各期细胞游离于溶液中,弃大块膜状物制成细胞悬液。
4. 收集细胞:1500r/min 离心10min,弃上清,其沉淀物即是处于减数分裂过程中的各期细胞。
5. 低渗;.加0.075mol/LKCl 于离心管中,立即将沉淀物吹散打匀使细胞悬浮于离心管溶液中后,置37℃水浴低渗处理20min。
6. 固定:低渗处理后的细胞以1500r/min 离心10min,弃上清后,沿管壁加入新配甲醇-冰醋酸固定液(3:14ml。
立即将细胞团吹散打匀,置室温固定20min,即第一次固定。
体的制备观察GE GROUP system office room [GEIHUA16H-GEIHUA GEIHUA8Q8-Life Science College实验报告姓名:柳伟雄学号:201300140062 班级:2013级生科一班 同组者:曾玮皤山东大学实验报告 2015年6月1日姓名:柳伟雄 系年级:生科一班2013级 同组者:曾玮墙 科目:细胞生物学实验 题目:小鼠染色体的制备、染色、观察 一、目的和要求1. 初步掌握小鼠睾丸细胞染色体标本的基本制作过程和Giemsa 染色法,了解各操作步骤 的原理。
2. 了解常用实验动物染色体的数目及特点。
3. 认识不同生物染色体的特征,学会做染色体组形图。
二、原理凡处于活跃増殖状态的细胞,或者经过各种处理后,任何动物组织的细胞就可进入分裂, 均可用于染色体分析。
在正常动物体内,精巢和骨髓均为是活跃分裂的组织。
给动物注射 —定剂量的秋水仙素,即可使许多处于分裂的细胞停滞于中期,然后采用常规空气干燥法 制备染色体,细胞生物学即可得到大量可分析的染色体标本。
本方法简便、可靠,不需要经体外培养和无菌操作,易于推广。
骨髓细胞是用于动物细胞遗传学研究很好的材料。
但在取材方面,精巢又比骨髓要简易一些,故本实验选用小鼠的精巢为实验材料。
对于小鼠精巢染色体标本的制作,一般包括以下几个要点:1.用一定剂量的秋水仙素破坏纺锤丝的形成,使细胞分裂停滞在中期,使中期染色体停留在赤道面处;2.用低渗法使细胞膨胀,以至于在滴片时细胞被胀破,使细胞的染色体铺展到载玻片上;3.空气干燥法可使细胞的染色体在载片上展平,经Giemsa染色后便可观察到染色体的显微图象。
Giemsa染色是最常用的染色方法之一,适用于多种细胞和染色体染色。
主要用Giemsa染液可以将细胞核染成紫红色或蓝紫色,胞浆染成粉红色,在光镜下呈现出清晰的细胞及染色体图像。
三、试剂和器材1•试剂:秋水仙素、生理盐水(0.9%的立C1溶液)、0.3WKC1低渗溶液、固定液(甲醇:冰醋酸二3 : 1)、Giemsa染液Giemsa染液的配制:吉姆萨粉(Giemsa stain)甘油(AR)甲醇(AR)将Giemsa粉放入研钵中,先加入少量甘油,研磨至无颗粒为止,然后再分批加入甘油,放56/温箱中2h后,分批加入甲醇,将配制好的染液密封保存棕色瓶内(最好于0~4C。
简述小鼠染色体制备的流程《简述小鼠染色体制备的流程嘿,小伙伴们,今天咱们就来唠一唠小鼠染色体制备这个有趣(嗯,有点复杂但又很奇妙)的流程。
首先呢,咱得逮住那只小老鼠。
这就像是一场小小的“抓捕行动”。
小鼠到处乱窜,仿佛知道自己即将面对一场特殊的“体检”。
把它抓住后,就要温柔又坚定地把它固定好,可不能让这个小机灵鬼捣乱哦。
然后,就是取骨髓的环节啦。
这一步感觉像是在小鼠的身体里挖掘宝藏般。
用合适的工具(比如注射器)小心地抽取骨髓细胞,就像采矿工人悄悄地开采珍贵的矿石一样。
这过程可得全神贯注,一点点偏差都不行,不然就会前功尽弃。
接着是细胞的低渗处理。
这时候我就想象成是给细胞做一个“温泉浴”,把细胞放到低渗溶液里,让细胞开始“飘飘然”起来,把它们的常态打乱,使得染色体能够更好地分散开来。
这“温泉浴”的时间可是相当关键,太短没效果,太长细胞可能就“泡坏”了。
再来就是固定环节啦。
就好像给染色体请了个严格的“保安”,用固定液让染色体保持现有的状态,乖乖地等待被观察。
这一步反复操作几次,确保染色体在这个过程中稳稳当当的。
随后呢,开始制作玻片。
把这些含有细胞的液体小心翼翼地滴到玻片上,轻轻吹动(这个场景就像是在给玻片上的细胞吹一阵微风,让它们分布得更均匀呢),让细胞完美地铺展在玻片上,这个过程充满了小心谨慎,每张玻片都是我们精心打造的“细胞小世界”的载体。
最后一步,当然就是染色啦。
选择喜欢的染色剂(就像给染色体挑选漂亮的衣服),一旦染上颜色,那一堆堆缠绕在一起的染色体就像是一条条色彩斑斓的彩带清晰地出现在我们眼前啦。
这样,小鼠的染色体就成功制备出来了,就像我们完成了一件超级微观世界的艺术品一样,有满满的成就感呢。
整个过程中,就像是在微观的世界里冒险,每一步都有惊喜或者是惊吓。
从抓小鼠的刺激,到最后成功看到染色体的欣慰,充满了各种奇妙的感受。
每一个步骤都得严谨对待,就像一场精细的魔法仪式,只要稍微出点小差错,那最后的结果可能就大打折扣啦。
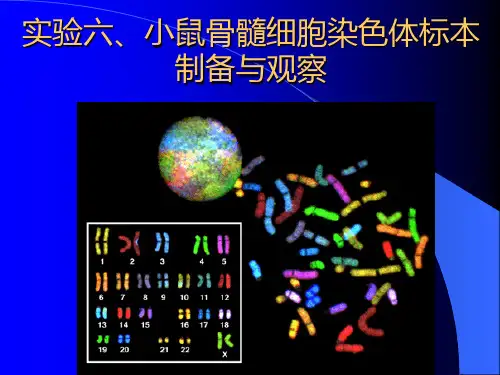
实验二小鼠骨髓细胞染色体标本制备实验目的:通过制备小鼠骨髓细胞染色体标本,了解染色体结构、形态和变异等方面的知识,为后续核型分析、染色体异常检测等实验打下基础。
实验原理:小鼠骨髓细胞染色体标本制备是指将小鼠骨髓组织中的细胞进行处理后制备成适合观察的染色体标本。
该标本制备方法包括细胞处理,染色体制备和染色体观察等环节。
1.小鼠骨髓细胞处理将小鼠放入固定夹,使用无菌注射器向小鼠腹腔注入适量的钾盐缓冲液(KCl,0.074mol/L)。
钾盐缓冲液的功能是使细胞发生肿胀,探头区别正常细胞和异常细胞。
此外,钾盐缓冲液也有不利的作用,可以导致一些染色体脱落或断裂。
接下来,在小鼠固定夹上进行剖腹,取出骨髓。
骨髓组织放置在一滴含有10%甘露醇的氯仿中进行易位。
在显微镜下观察细胞的形态结构,进行可行性检测。
2.染色体制备取干净的药片,滴入细胞悬液,热外片变性塔。
药片的材料使用高价值玻璃药片,这样可以保证药片平整和染色体不能和药片表面黏附。
加入甘醇一定要多加就能快速促进水分的蒸发,避免液体反应产生气泡而影响结果。
不需要太用力,在药片的表面轻轻涂抹,使液体均匀分布。
接下来,将药片吸入液、95%甲醇,以及3%乙酸中每个5分钟,直到药片完全干燥。
3.染色体观察将药片上的细胞标本置于显微镜上,根据染色体数目和形态等信息进行染色体分析。
在显微镜下观察染色体的特征,包括染色体数量、形态、大小、位置以及异常情况等。
对观察到的染色体进行记录和描述。
实验结果:通过对小鼠骨髓细胞进行染色体制备和检测,我们可以观察到染色体的结构、形态等方面的特征。
此外,通过对染色体的数量和形态进行观察,还可以发现染色体的变异情况,进一步了解染色体的异常情况。
在实际操作过程中,需要注意细胞处理和染色体制备的每一个环节,以保证实验的准确性和可靠性。
实验7小鼠骨髓细胞染色体标本的制备和观察一、实验目的了解利用动物骨髓进行细胞染色体制片的一般方法,掌握细胞收集、低渗、滴片等技术手段。
观察和了解小鼠染色体的数目及形态特征。
利用显微照相技术对所得切片进行照相。
二、实验原理染色体上的基因决定了一个物种生长发育的全部信息。
因此通过染色体分析,可以了解某一物种最基本的遗传指标。
进行染色体标本的制备一般取自细胞分裂旺盛的组织,如骨髓、淋巴细胞以及通过人工培养的悬浮液。
如将秋水仙素注射到动物的腹腔内,经肠系膜吸收并可转运到骨髓,结果使正在分裂的细胞不能形成纺锤体,使得染色体停在中期状态,经过处理和制片后就可以清楚地观察到染色体。
这种制片方法是属于侵害性的,因此这种方法适用于动物来源丰富、动物个体较小的材料。
对于大型动物可以采取骨髓穿刺术获得红骨髓,在临床上用于一些血液疾病的研究分析。
对于一些珍稀的鸟类可采用羽髓来制片,方法基本一样。
人类的染色体分析可采用外周血培养的方法来获得大量的细胞材料。
三、实验用具及材料实验材料:体重20克左右的小鼠一只实验试剂:0.075mKCl低渗液、固定液(甲醇:醋酸=3:1)、0.4%秋水仙素、改良苯酚品红溶液、二甲苯实验材料:恒温水浴槽、纱布、烧杯、离心管2支、刀片、镊子、解剖盘、解剖剪、镊子、注射器、离心机、镜头纸光学显微镜、带数码相机的光学显微镜四、实验步骤1腹腔注射秋水仙素溶液:在做实验前2~3小时,对实验用小鼠按0.1ml/20g小鼠的量对其进行0.4%的秋水仙素注射。
2取材:实验时,用断颈法迅速将小鼠处死,通过解剖取出股骨,用注射器吸取在37℃下保温的低渗液2毫升,将针头插入骨髓腔中冲洗骨髓,使冲洗液从股骨的另一端流出。
收集冲洗液到5ml刻度的离心管中。
3低渗:用吸管将冲洗液吹打几次,然后把离心管放在37℃恒温水浴槽内低渗20分钟。
4固定:之后取出并加1ml的固定液,吹打之后放入37℃恒温水浴槽内固定10分钟。
5离心:然后将1000rpm离心10分钟,弃去上清。
姓名系年级组别同组者
科目细胞生物学实验题目小鼠睾丸细胞染色体标本的制备及观察学号
小鼠睾丸细胞染色体标本的制备及观察
一.实验目的
1.了解快速制备动物染色体标本的方法,掌握小鼠睾丸细胞染色体标本的制备方法。
2.观察小鼠睾丸染色体的数目及其形态特征。
3.掌握小鼠睾丸染色体标本制备基本过程,了解操作步骤的原理。
二.实验原理
(一)染色体
染色体是基因的载体。
真核细胞染色体的数目和结构是重要的遗传指标之一。
制备染色体标本无疑是细胞学最基本的技术之一,优良的染色体制片是进行染色体显带、组型分析、原位杂交等的先决条件。
染色体的制备在原则上可以从所有发生有丝分裂的组织和细胞悬浮液中得到。
最常用的途径是从骨髓细胞、血淋巴细胞和组织培养的细胞中制备染色体。
本实验采用的方法是从小鼠的睾丸细胞中获取。
染色体的形态结构在细胞增殖周期中是不断地运动变化的,一般在有丝分裂中期,染色体的形态最典型、最易辨认和区分。
因此,制备染色体标本获取的是中期细胞。
染色体特征:
1.数目(2n=?)
2.长度(绝对长度、相对长度)
3.着丝粒位置(M/SM/ST/T)
4.随体与次溢痕的数目、大小和位置
5.带型分析
(二)操作方法
小型动物的染色体制片最好最有效的材料就是骨髓组织(由于分裂活动旺盛,睾丸也可以)。
利用睾丸细胞的制片技术虽然需要离心以及细致的操作,但其基本程序是简便的。
在小鼠睾丸中,细胞有丝分裂和减数分裂比较旺盛,因此不需要体外培养就可以直接得到分裂中期细胞。
通过小鼠睾丸得到染色体比较简便,一般不需要无菌操作。
用秋水仙素作为有丝分裂的抑制剂。
由于小鼠睾丸细胞分裂活动旺盛,具有高度的分裂能力,本实验采用这一材料,通过前处理、低渗、固定、制片、染色等步骤制得染色体标本,可观察到许多处于分裂中期的染色体,可以进行染色体组型分析。
减数分裂是细胞分裂染色体数目减半时发生在性细胞的形成过程中。
哺乳动物在性成熟以后,精巢内的性细胞总是在分批分期不断的成熟,因此,对哺乳动物的精巢进行一定的技术处理,随时都可以获得减数分裂过程中各个时期染色体的标本。
用适量的秋水仙素溶液注入动物腹腔内,可以阻止分裂细胞纺锤丝的形成,
姓名系年级组别同组者
科目细胞生物学实验题目小鼠睾丸细胞染色体标本的制备及观察学号
从而积累大量处于分裂中期的细胞。
利用上述原理,通过常规的制片方法,观察小鼠睾丸细胞的染色体。
(三)Giemsa染色法
MGG由May-Grunwald染料和Giemsa染料组成。
前者化学名为曙红亚甲基蓝Ⅱ,对胞质着色较好;后者对胞核着色较好。
因此MGG染色,可兼两者的优点,常用于细胞涂片染色。
染色结果:染色将细胞核染成紫红色,细胞质和核仁染成蓝紫色。
其优点:染色方法简单,且兼有瑞氏、姬氏两种染色的优点,并且涂片可保存十多年而不退色。
MGG染色对胞质胞核染色效果均较好,结构清晰,所染细胞亦比HE染色的细胞大;同时对细菌、霉菌及胆固醇结晶的显示也很清楚。
因此适用于淋巴造血系统的细胞标本、胸腹水、穿刺标本等。
尤其对鉴别恶性淋巴瘤的类型,MGG染色更有帮助。
三.实验材料
1.材料
小白鼠。
2.试剂
秋水仙素、0.3% KCl、固定液(甲醇:冰醋酸=3:1)、0.9%的NaCl 、Giemsa 染液等。
3.器材
注射器、针头、解剖盘、解剖剪、镊子、玻璃吸管、10ml刻度的离心管、离心机、载玻片(冰片)、显微镜、铜网、擦镜纸、小烧杯、吸水纸、天平等。
四.实验步骤
实验步骤:预处理→取睾丸→剪碎→离心→低渗→离心→固定→离心→固定→滴片→染色→观察
1.取雄性小鼠以每克体重4μg注射秋水仙素,经14~16小时后,断头法杀死小鼠,取出睾丸用生理盐水(0.9%的NaCl)洗去血污。
2.放入装有1ml 0.3%KCl液的小烧杯中剪碎(呈乳白色)。
3.用铜网过滤到刻度离心管中,再加0.3%KCl液至4ml。
4.37℃静置30min,进行低渗处理。
5.离心:800-1000r/min 离心8 min ,弃上清。
6.加入2ml甲醇冰醋酸固定液(3:1),并用吸管吹气,轻轻打散细胞,固定8min。
7.再以800-1000r/min离心8 min。
8.弃去上清液,加1ml固定液,制成细胞悬液固定5min。
9.取洁净的低温预冷载片,距载片10~15cm高度滴下2~3滴细胞悬液,从载片一边向另一边轻轻吹气,并同时轻轻敲打载片,以使细胞均匀分布和促使染色体展开。
10.用滤纸擦去载片上多余液体,在背面做上标记,空气干燥。
11.用 Giemsa染色20-30min(采用倒置染色法,目的在于可使载玻片充分接触
姓名系年级组别同组者
科目细胞生物学实验题目小鼠睾丸细胞染色体标本的制备及观察学号
染液,若有杂质也可沉降至底部,不会和玻片直接接触),细水冲洗玻片背面,去多余染液,气干。
11.镜检:低倍镜下寻找分散良好、染色适中的分裂相,高倍镜下观察染色体形态并计数。
五.实验结果
1.实验结果如下图所示
图1 小鼠睾丸细胞中期染色体观察图(10×40)
图2 小鼠睾丸细胞中期染色体观察图放大图(10×40)
由图2,能看到清晰的分裂中期的染色体,清楚地看到着丝点。
可以大致数出染色体的数目为32条。
视野中还有许多细胞的染色体没有完全展开,或者没有破裂,可能原因有:滴片时的高度过低,导致细胞没有破裂,或者是低渗处理没处理好,染色体没充分展开。
六.思考与讨论
1.注意事项
⑴用一定剂量的秋水仙素破坏纺锤丝的形成,使细胞分裂停滞在中期,使中期染色体停留在赤道面处。
姓名系年级组别同组者
科目细胞生物学实验题目小鼠睾丸细胞染色体标本的制备及观察学号
⑵用低渗法使将细胞膨胀,以至于在滴片时细胞被胀破,使细胞的染色体铺展到载玻片上,低渗与离心等步骤的操作要轻。
⑶空气干燥法可使使细胞的染色体在载片上展平, 经Giemsa染色后便可观察到染色体的显微图象。
⑷细胞完整,轮廓清晰,染色体分布在同一水平面上。
⑸染色体形态和分布良好,最好无重叠,即使有个别重叠,也要能明确辩认,以免差错。
⑹所观察的细胞处于同一有丝分裂阶段(分裂中期),即染色体螺旋化程度或染色体长短大致一样,在所观察的细胞周围,没有离散的单个或多个染色体存在,以免影响观察和计数。
⑺固定液和Giemsa染液须现配现用。
⑻低渗时间应掌握准确。
⑼低渗后的细胞吹打时动作要轻,离心速度不能高于1000 r/min。
2.实验结果分析
本实验可能至少有以下几点导致实验失败或影响实验观察:
⑴取睾丸时用生理盐水冲洗睾丸时未冲洗干净,导致血污仍然存在,影响实验结果观察。
⑵剪碎时组织块仍比较大,分离出的单个细胞仍较少。
⑶低渗时因时间过长或试剂浓度过低导致细胞吸水涨破。
⑷离心时因时间过长或转速过快导致细胞破裂,或因时间不够、转速过低而未达到预期目的。
⑸固定时加液的量不合适或时间过长。
⑹滴片时未将细胞震碎,吹气和敲打时未使细胞均匀散开,影响实验观察。
⑺染色不充分或不均匀。
3.实验小结
通过本次实验,进一步练习掌握了处死小鼠及小鼠内脏器官的观察。
同时,通过小鼠睾丸细胞染色体标本的制作及观察,认识了小鼠睾丸细胞染色体的基本特征。
虽然观察染色体时间较长,但是通过耐心的观察,找到了比较理想的分裂中期染色体。
本次实验,锻炼了我们的动手操作能力以及科学严谨耐心的实验精神,收获很大。