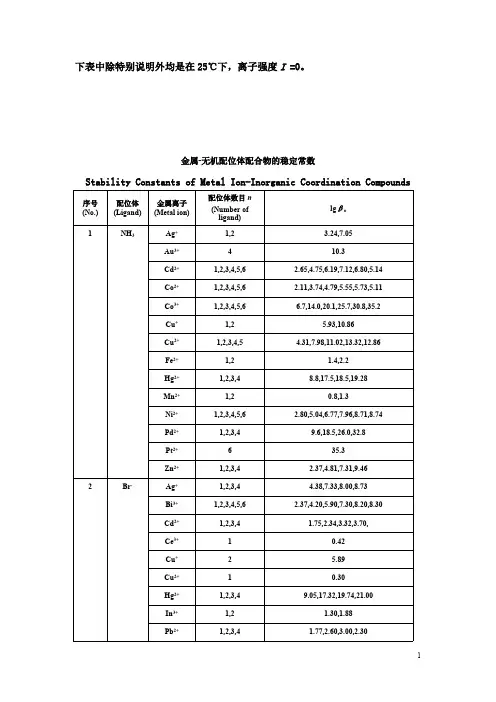
金属-无机配位体配合物的稳定常数
- 格式:docx
- 大小:37.57 KB
- 文档页数:6



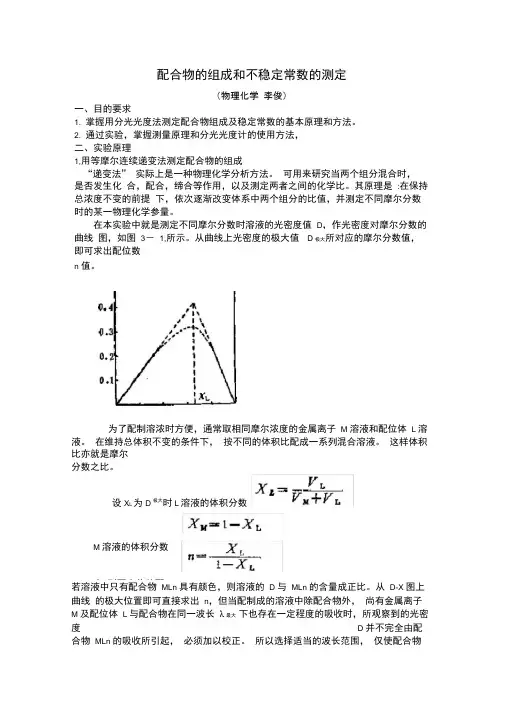
配合物的组成和不稳定常数的测定(物理化学 李俊)一、目的要求1. 掌握用分光光度法测定配合物组成及稳定常数的基本原理和方法。
2. 通过实验,掌握测量原理和分光光度计的使用方法, 二、实验原理1,用等摩尔连续递变法测定配合物的组成“递变法” 实际上是一种物理化学分析方法。
可用来研究当两个组分混合时, 是否发生化 合,配合,缔合等作用,以及测定两者之间的化学比。
其原理是 :在保持总浓度不变的前提 下,依次逐渐改变体系中两个组分的比值,并测定不同摩尔分数时的某一物理化学参量。
在本实验中就是测定不同摩尔分数时溶液的光密度值 D ,作光密度对摩尔分数的曲线 图,如图 3- 1,所示。
从曲线上光密度的极大值 D 极大所对应的摩尔分数值,即可求出配位数n 值。
为了配制溶浓时方便,通常取相同摩尔浓度的金属离子 M 溶液和配位体 L 溶液。
在维持总体积不变的条件下, 按不同的体积比配成一系列混合溶液。
这样体积比亦就是摩尔 分数之比。
若溶液中只有配合物 MLn 具有颜色,则溶液的 D 与 MLn 的含量成正比。
从 D-X 图上曲线 的极大位置即可直接求出 n ,但当配制成的溶液中除配合物外, 尚有金属离子 M 及配位体 L 与配合物在同一波长 λ最大 下也存在一定程度的吸收时,所观察到的光密度 D 并不完全由配 合物 MLn 的吸收所引起, 必须加以校正。
所以选择适当的波长范围, 仅使配合物设X L 为D极大时L 溶液的体积分数M 溶液的体积分数为 则配合物的配MLn 有吸收,M 和L 都不吸收或极少吸收。
2.配合物平衡常数的测定假定配合物中心离子浓度不变,而渐增加配位体浓度,随着配位体浓度的改变,中心离子被配成MLn ,溶液的光密度值 D 不断升高。
当中心离子被完全配合后,如继续增加配位体的浓度,则溶液的光密度值 D 趋于恒定,如图3-2。
设配合物在稀溶液中有如下解离平衡存在:最初浓度平衡浓度式中,n-配位数,已由实验确定;a-解离度:C-配合物未解离时的浓度(在本实验中亦为M 完全配合时的配合物浓度)。



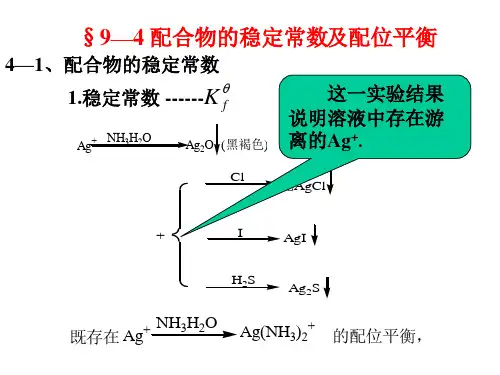
1.表示配合物稳定性的常数是什么?答:稳定常数指络合平衡的平衡常数。
通常指络合物的累积稳定常数,用K 稳表示。
例如:对具有相同配位体数目的同类型络合物来说,K稳值愈大,络合物愈稳定。
配合物的稳定性,可以用生成配合物的平衡常数来表示。
K稳值越大,表示形成配离子的倾向越大,此配合物越稳定。
所以配离子的生成常数又称为稳定常数。
稳定常数配合物在溶液中的生成与离解,与多元酸、碱相似,也是分级进行的,而且各级离解或生成常数也不一样。
例如,Cu2+与NH3逐步配合过程中的分步稳定常数(30℃)分别为:K1,K2,K3,K4称为逐级稳定常数。
由上可见,配合物的逐级稳定常数随着配位数的增加而下降。
一般认为,随着配位体数目增多,配位体之间的排斥作用加大,故其稳定性下降。
配合物的逐级稳定常数和稳定常数间有下述关系:K= K1·K2·K3·K4…Kh对[Cu(NH3)4]2+来说,其稳定性k 为:K= K1·K2·K3·K4K=(1.41×104)(3.17×103)(7.76×102)(1.39×102)=4.8×1012不稳定常数在水溶液中,[Ag(NH.3)2]+是稳定的,不过像其他弱电解质一样也有少数[Ag(NH.3)2]+发生离解,可用下式表示:则平衡常数表达式为:K不稳值愈大,表示配离子离解愈多,故称K不稳为配离子的不稳定常数。
K稳和K不稳互成倒数:金属离子Mn+和配位体A-生成配离子MA(n-x)+x,在水溶液中存在如下平衡:根据平衡移动原理,改变Mn+或A-的浓度,会使上述平衡发生移动。
若在上述溶液中加入某种试剂使Mn+生成难溶化合物,或者改变Mn+的氧化状态,都会使平衡向左移动。
若改变溶液的酸度使A-生成难离解的弱酸,也可使平衡向左移动。
配合平衡同样是一种相对的平衡状态,它同溶液的PH值、沉淀反应、氧化还原反应等都有密切的关系。


edta配位化合物的稳定常数EDTA(乙二胺四乙酸)是一种重要的配位化合物,其配位能力强,可以与金属离子形成稳定的络合物。
本文将介绍EDTA配位化合物的稳定常数,并探讨其在实际应用中的重要性。
稳定常数是评价配位化合物稳定性的指标之一,它反映了配位化合物形成的平衡常数。
对于EDTA配位化合物而言,其稳定常数是衡量其稳定性的重要参数。
稳定常数越大,表示络合物形成的平衡常数越大,这意味着络合物在溶液中的稳定性更高。
EDTA的配位能力主要来自其分子中的四个乙酸根(-COO-)基团,这些基团可以与金属离子形成配位键。
乙酸根基团通过共振效应使得配位键更为稳定,从而增强了络合物的稳定性。
EDTA与金属离子形成的络合物通常具有六配位的八面体结构,其中金属离子与EDTA 分子中的两个氧原子形成配位键。
EDTA配位化合物的稳定常数与配位离子的选择和环境条件有关。
不同金属离子与EDTA形成的络合物稳定常数不同,这是由于金属离子的电荷和半径等因素的影响。
一般来说,过渡金属离子与EDTA形成的络合物稳定常数较高,这是因为过渡金属离子的电荷较大,与EDTA形成的配位键更为紧密。
EDTA配位化合物的稳定常数在实际应用中具有重要意义。
首先,稳定常数可以作为评价化学分析方法的指标。
在分析化学中,常常使用EDTA等配体来测定金属离子的含量。
通过测定络合物的稳定常数,可以选择适合的配体和条件,提高分析方法的准确性和灵敏度。
稳定常数还与金属离子的溶解度有关。
一些金属离子在水中的溶解度较低,难以直接测定其含量。
通过与EDTA等络合剂形成络合物,可以提高金属离子的溶解度,从而方便测定其含量。
EDTA配位化合物的稳定常数还在环境科学和生物医学领域中发挥着重要作用。
在环境科学中,EDTA可以作为螯合剂用于处理废水和土壤中的金属离子污染物。
通过与金属离子形成络合物,可以提高污染物的稳定性,减少其对环境的危害。
在生物医学领域,EDTA可以作为抗凝剂用于血液采样和体外诊断。
配合物稳定常数
Stability Constants of Coordination Compounds
络合反应的平衡常数用配合物稳定常数表示,又称配合物形成常数。
此常数值越大,说明形成的配合物越稳定。
其倒数用来表示配合物的解离程度,称为配合物的不稳定常数。
以下表格中,表(1)中除特别说明外是在25℃下,离子强度I =0;表(2)中离子强度都是在有限的范围内,I≈0。
表中βn表示累积稳定常数。
金属-无机配位体配合物的稳定常数
Stability Constants of Metal Ion-Inorganic Coordination Compounds
金属-有机配位体配合物的稳定常数
(表中离子强度都是在有限的范围内,I≈0。
)
Stability Constants of Metal Ion-Organic Coordination Compounds
EDTA的lgαY(H)值
lgαY(H) Values of EDTA
精品文档
精品文档。