有机化学教学之十一:醛和酮
- 格式:doc
- 大小:815.00 KB
- 文档页数:30




有机化学中的醛和酮有机化学是研究碳及其化合物的科学,醛和酮是其中重要的有机化合物。
醛和酮是碳氧化合物,它们在生物体内起着重要的生理和生化功能。
本文将详细介绍醛和酮的化学性质、合成方法以及在生活中的应用。
一、醛的化学性质醛是含有唯一一个羰基(C=O)的有机化合物。
醛分子的一个碳原子上连接着一个羰基碳,而另一个碳原子连接着一个氢原子或者是一个有机基团。
醛的命名方式通常以带有羰基的碳作为主链,并在主链末端加上字母“-al” 表示它是一个醛。
醛具有一些特征性质。
首先,醛可以通过氧化反应将其转化为相应的羧酸。
其次,醛在酸性条件下可以发生缩合反应,形成独特的亚胺结构。
此外,醛容易与氨或者胺反应,生成相应的胺类化合物。
醛在水溶液中有时也能形成相应的季铵盐。
二、酮的化学性质酮是含有一个或多个羰基(C=O)的有机化合物。
酮分子中的羰基碳连接着两个碳原子,且没有一个碳原子连接氢原子。
酮的命名通常以长的碳链为主链,并在主链两端加上字母“-one” 表示它是一个酮。
酮也具有一些独特的性质。
和醛一样,酮可以通过氧化反应转化为相应的羧酸。
而且,酮不像醛那样容易发生缩合反应。
由于酮中没有活性氢原子,因此它不会像醛那样发生酸催化的亲核加成反应。
三、醛和酮的合成方法醛和酮的合成方法各异。
常见的醛的合成方法包括脱羧反应、氢化还原、氧化反应等。
通过脱羧反应,羧酸可以经过酰的转化形成醛。
通过氢化还原,酮可以还原为相应的醇。
氧化反应是将氨基醇酮氧化为醛或羧酸。
酮的合成方法包括羰基合成、酰基咪唑反应、酮的羟醇化、弱碱性环化反应等。
羰基合成是由酸酐和脂肪酸生成酮。
酰基咪唑反应是通过酰氯和亚胺之间的反应生成具有酮结构的酮类化合物。
酮的羟醇化是通过酮与过硼酸或缩水为盐酸亚胺反应生成氧代(亚)胺化合物。
四、醛和酮的应用醛和酮在生活中应用广泛。
对于醛,最常见的应用是在食品工业中的食品保存和香精添加剂。
醛具有杀菌抑菌的特性,可以有效延长食品的保鲜期。


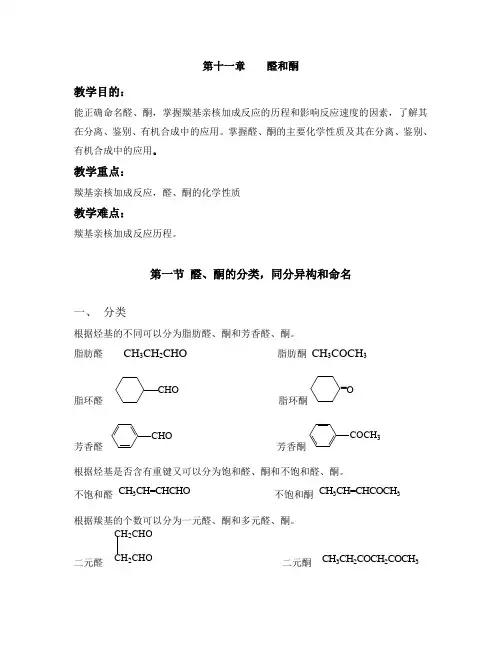
第十一章醛和酮教学目的:能正确命名醛、酮,掌握羰基亲核加成反应的历程和影响反应速度的因素,了解其在分离、鉴别、有机合成中的应用。
掌握醛、酮的主要化学性质及其在分离、鉴别、有机合成中的应用。
教学重点:羰基亲核加成反应,醛、酮的化学性质教学难点:羰基亲核加成反应历程。
第一节醛、酮的分类,同分异构和命名一、分类根据烃基的不同可以分为脂肪醛、酮和芳香醛、酮。
脂肪醛CH3CH2CHO 脂肪酮CH3COCH3脂环醛CHO脂环酮O=芳香醛CHO芳香酮COCH3根据烃基是否含有重键又可以分为饱和醛、酮和不饱和醛、酮。
不饱和醛CH3CH=CHCHO不饱和酮CH3CH=CHCOCH3根据羰基的个数可以分为一元醛、酮和多元醛、酮。
二元醛CH2CHOCH2CHO二元酮CH3CH2COCH2COCH3二、同分异构现象醛的同分异构---碳链异构引起。
酮的同分异构---碳链异构、碳基位置异构。
同碳数饱和一元醛酮,分子式CnH 2n O ,互为同分异构:三、命名1. 系统命名法:(1)选择含羰基最长碳链作主链,称为某醛或某酮;(2)由于醛基是一价原子团,必在链端,命名时不必用数字标明其位置。
酮基的位置则需用数字标明,写在“某酮”之前,并用数字标明侧链所在的位置及个数,写在母体名称之前。
例如:2- 甲基丙醛 2- 苯基丙醛3-甲基-6-庚炔醛C 6H 5CHCHOCH 37HCCCH 2CH 2CHCH 2CHOCH 3654321CH 3CHCHOCH 3CH 3COCH 3丙酮CH 3COCH 2CH 3丁酮CH 3CO(CH 2)CH 32-己酮CH 3COCH 2COCH 2CH 32,4-己二酮COCH 2CH 31-苯-1-乙酮(苯乙酮)1-环己基-1-丙酮COCH 32. 普通命名法醛的命名与醇的习惯命名法相似,称某醛;脂肪酮则按酮基所连接的两个烃基而称为某(基)某(基)酮。
例如:CH 3CHO 乙醛 CH 3CH (CH 3)CHO 异丁醛甲基乙基酮甲基苯基酮(1-苯基-1-乙酮)CH 3C OCH 3C 2H 5C O另外,醛、酮命名时习惯上还采用希腊字母α、β、γ等,α碳指与醛基或酮基直接相连的碳原子。
第十一章 醛和酮学习要求1.掌握羰基(碳氧双键)和碳碳双键的结构差异及其在加成上的不同。
2.掌握醛酮的主要制法。
3.熟练掌握醛酮的化学性质,理解亲核加成反应历程。
4.掌握醛与酮在化学性质上的差异,如氧化反应、歧化反应等。
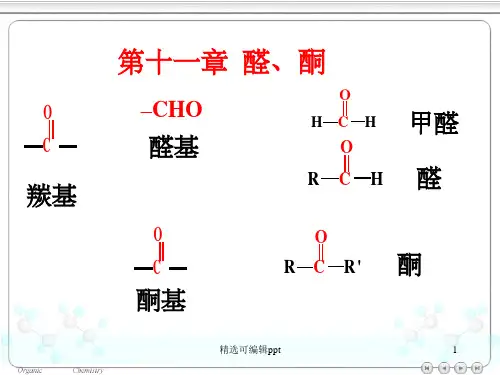
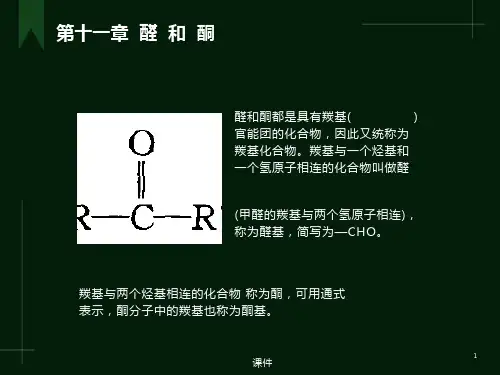
醛和酮都是分子中含有羰基(碳氧双键)的化合物,羰基与一个烃基相连的化合物称 为醛,与两个烃基相连的称为酮。
§11.1 醛、酮的分类,同分异构和命名 11.1.1 分类醛 酮11.1.2同分异构现象RC R'OR C R'OR C HO ( RCHO )( )醛酮CH 3CH 2CH 2CHOCH 3CH 2-C-CH 3OCHO O CHO3OCH 3CH=CHCHO CH 3CH=CH-C-CH 3OCH 2CHO CH 2CHOOCH 3-C-CH 2-C-CH 3OO脂肪醛脂肪酮脂环醛脂环酮芳香醛芳香酮不饱和醛不饱和酮二元醛二元酮醛酮的异构现象有碳连异构和羰基的位置异构。
11.1.3 醛酮的命名选择含有羰基的最长碳链为主链,从靠近羰基的一端开始编号。
例如:碳原子的位置也可用希腊字母表示。
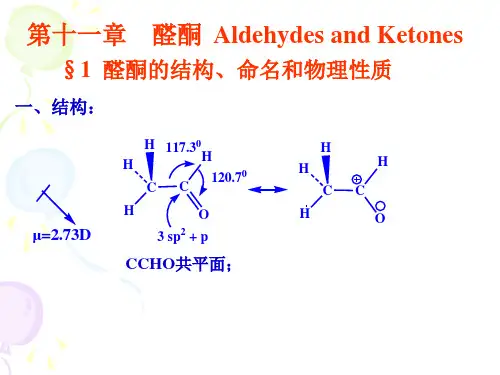
例如:§11.2 醛、酮的结构、物理性质和光谱性质 11.2.1 醛、酮的结构醛酮的官能团是羰基,所以要了解醛酮必须先了解羰基的结构。
CH 3-CH-CH 2CHOC6H 5-CH-CHOCH 3CH 3CH 3-C=CHCH2CH 2-CH-CH 2CHOCH 23CH 3CH 2-C-CH 2CH 3CH 3-C-CH 2-C-CH 3OOOH 3CO甲基丁醛苯基丙醛二甲基 辛醛戊酮戊二酮甲基环戊酮32,433,7623C-CH 2CH 3C-CH 3COCH 2CH 2CH 3OO环己烯酮环己基丙酮苯基 乙酮萘丁酮α111112C C C COHCH 3CH=CHCH 2CHOβ丁烯醛O116.5。
杂化键键近平面三角形结构πσC=O = σ+π 与 相似C=O 双键中氧原子的电负性比碳原子大,所以π电子云的分布偏向氧原子,故羰基是 极化的,氧原子上带部分负电荷,碳原子上带部分正电荷。
<11.2.2 物理性质 (略)11.2.3 光谱性质UVIR羰基有共轭时吸收频率移向低波数 HNMR 醛基氢的δ= 9-10,羰基α-H 的δ= 2.0-2.5§11.3 醛、酮的化学性质醛酮中的羰基由于π键的极化,使得氧原子上带部分负电荷,碳原子上带部分正电 荷。
氧原子可以形成比较稳定的氧负离子,它较带正电荷的碳原子要稳定得多,因此反 应中心是羰基中带正电荷的碳。
所以羰基易与亲核试剂进行加成反应(亲核加成反应)。
此外,受羰基的影响,与羰基直接相连的α-碳原子上的氢原子(α-H )较活泼,能 发生一系列反应。
亲核加成反应和α-H 的反应是醛、酮的两类主要化学性质。
C C O电负性C < OC Oδδ极性双键π 电子云偏向氧原子C O n *200~400nm C CH C Oπ*200~400nm ε= 20ε>1000有弱吸收有强吸收υC=O1850~1650cm -1有强吸收(一般在1740~1705cm -1)醛、酮的反应与结构关系一般描述如下:11.3.1 亲核加成反应1.与氢氰酸的加成反应反应范围:醛、脂肪族甲基酮。
ArCOR 和ArCOAr 难反应。
αβγδ α-羟基腈是很有用的中间体,它可转变为多种化合物,例如:2.与格式试剂的加成反应COHCN 羟基睛αCH 2=C-CN CH 3(CH 3)2CCNOH(CH 3)2CCOOH OH(CH 3)2CCH 2NH 2OHCH 2=C-COOCH 3CH 3C O δδδδCR2R C OH +HOMgX无水乙醚C δδ酸和亲电试剂进攻富电子的氧碱和亲核试剂进攻缺电子的碳涉及醛的反应 氧化反应( )αH 的反应羟醛缩合反应卤代反应式中R 也可以是Ar 。
故此反应是制备结构复杂的醇的重要方法。
见P 319例题这类加成反应还可在分子内进行。
例如;3.与饱和亚硫酸氢钠(40%)的加成反应产物α-羟基磺酸盐为白色结晶,不溶于饱和的亚硫酸氢钠溶液中,容易分离出来; 与酸或碱共热,又可得原来的醛、酮。
故此反应可用以提纯醛、酮。
1°反应范围 醛、甲基酮、七元环以下的脂环酮。
2°反应的应用 a 鉴别化合物 b 分离和提纯醛、酮CH 3Br CH 3MgBrCH 3C CH 3C H 2O/H32CH 3CH 3OH CH 3CH 3OMgBr 干乙醚BrCH 2CH 2CH 2COCH 3Mg ,HgCl OH CH 360%OH SO 3NaCSO 醇钠强酸强酸盐 ()R C RC OH O NaHSO 3RCHO + Na 2SO 3 + CO 2 + H 2O例见P 320c 用与制备羟基腈,是避免使用挥发性的剧毒物HCN 而合成羟基腈的好方法。
例如:4.与醇的加成反应也可以在分子内形成缩醛。
醛较易形成缩醛,酮在一般条件下形成缩酮较困难,用12二醇或13-二醇则易生成 缩酮。
PhCHO NaHSO 3H 2O3NaNaCN PhCHCNHCl PhCHCOOH67%OH OH OH R H ( R' )R C OHH O ( R' )O +R''R''OH RCO HO ( R' )R''OH R''R''干+H 2O半缩醛 酮不稳定一般不能分离出来缩醛 酮 ,双醚结构。
对碱、氧化剂、还原剂稳定,可分离出来。
酸性条件下易水解( )( )HCl干环状半缩醛 稳定( )OHC OH OH OH在糖类化合物中多见反应的应用: 有机合成中用来保护羰基。
例1:必须要先把醛基保护起来后再氧化例2; 例3: 见P 3215.与氨及其衍生物的加成反应醛、酮能与氨及其衍生物的反应生成一系列的化合物。
醛、酮与氨或伯胺反应生成亚胺(西佛碱),亚胺不稳定,故不作要求。
醛、酮与芳胺反应生成的亚胺(西佛碱)较稳定,但在有机合成上无重要意义,故 也不作要求。
醛、酮与有α-H 的仲胺反应生成烯胺,烯胺在有机合成上是个重要的中间体。
RC RO +HO CH 2CH 2HO HR CRO O CH 2CH 2+H 2OCHOHOCH 2CHOHOOC CHO HOCH 2CHO HOOC CH 3OH C HOCH 2OCH 3OCH 3H C OCH 3OCH 3HH2HOOC +2CH 3OHNH 2-OHNH 2-NH 2NH 2-NHNH 2-NH-C-NH 2ONH 2-NHO 2N NO 2羟氨肼苯肼二硝基苯肼氨基脲2,4醛、酮与氨的衍生物反应,其产物均为固体且各有其特点,是有实用价值的反应。
如乙醛肟的熔点为47℃,环己酮肟的熔点为90℃。
上述反应的特点:R C O RCH 2+NHR 2RC RCH NR 22RRCHNR 2仲胺烯胺α羟氨OH N OH熔点NH 2-NH 2肼C O +C2H 2OC N-NH 腙,有固定熔点NH 2-NH苯肼C O +苯腙有固定熔点(NH 2-NH C O +2C N-NH黄(O 2NNO 22,4 -二硝基苯肼O 2NNO 22,4 -二硝基苯腙C O +2C N-NH (NH 2NH-C-NH 2OC-NH 2O氨基脲缩氨脲反应现象明显(产物为固体,具有固定的晶形和熔点),常用来分离、提纯和鉴别 醛酮。
2,4-二硝基苯肼与醛酮加成反应的现象非常明显,故常用来检验羰基,称为 羰基试剂。
6.与魏悌希(Wittig )试剂的加成反应魏悌希(Wittig )试剂为磷的内鎓盐,又音译为叶立德(Ylide ),是德国化学 家魏悌希在1945年发现的。
磷叶立德(魏悌希试剂)通常由三苯基磷与1级或2级 卤代物反应得磷盐,再与碱作用而生成。
此反应即为魏悌希反应,是合成烯烃和共轭烯烃的好方法。
其反应特点是: 1°可用与合成特定结构的烯烃(因卤代烃和醛酮的结构可以多种多样)。
2°醛酮分子中的 C=C 、C ≡C 对反应无影响,分子中的COOH 对反应也无影响。
3°魏悌希反应不发生分子重排,产率高。
4°能合成指定位置的双键化合物。
例如:(Ph)3P +R 1CHX R 2R 1R 2X (Ph)3P-CHR 1R2X(Ph)3P-CH49Li -R 1R 2(Ph)3P = C+ LiX + C 4H 9R 1R 2(Ph)3P - C 内鎓盐磷叶立德(魏悌希试剂)强碱C O R 1R 2(Ph)3P = C +R 1R 2C+(Ph)3P =OO (Ph)3P = CH 2+CH 2+(Ph)3P =O魏悌希(Wittig )发现的此反应对有机合成作出了巨大的贡献,特别是在维生素类 化合物的合成中具有重要的意义,为此他获得了1979年的诺贝尔化学奖(1945年43 岁发现,1953年系统的研究了魏悌希反应,82岁获奖)。
7.与希夫试剂(品红醛试剂)的反应 (略)11.3.2 还原反应利用不同的条件,可将醛、酮还原成醇、烃或胺。
(一)还原成醇( )1.催化氢化 (产率高,90~100%)例如:如要保留双键而只还原羰基,则应选用金属氢化物为还原剂。
2.用还原剂(金属氢化物)还原 (1)LiAlH 4还原C O CH OHR CH O (R')+ H 2热,加压R CH H OH(R')+ H 2O OH50℃MPa6.5CH 3CH=CHCH 2CHO+ 2H 2Ni ℃加压CH 3CH 2CH 2CH 2CH 2OH (C=C, C=O )均被还原CH 3CH=CHCH 2CHOCH 3CH=CHCH 2CH 2OHLiAlH 4是强还原剂,但①选择性差,除不还原C=C 、C ≡C 外,其它不饱和键都可被 其还原(见P 354附录之表1);②不稳定,遇水剧烈反应,通常只能在无水醚或THF 中使用 。
(2)NaBH4还原NaBH4还原的特点:1° 选择性强(只还原醛、酮、酰卤中的羰基,不还原其它基团。
2° 稳定(不受水、醇的影响,可在水或醇中使用)。
3.异丙醇铝—— 异丙醇还原法(麦尔外因-庞道夫MeerWein-Ponndorf 还原法)反应的专一性高,只还原羰基。
其逆反应称为奥彭欧尔(Oppenauer )氧化反应。
(二)还原为烃( )较常用的还原方法有两种。
1.吉尔聂尔-沃尔夫-黄鸣龙还原法(吉尔聂尔为俄国人,沃尔夫为德国人) 此反应是吉尔聂尔和沃尔夫分别于1911、1912年发现的,故此而得名。
CH 3CH=CHCH 2CHO CH 3CH=CHCH 2CH 2OH 只还原C=O ( )R C H O R ( )( i - Pr -O-)AlCH 3-CH-CH 3CH 3-C-CH 3O +RCH HOH R ( )+C O CH 2C ON-NH KOH C H ONa C H OH 或1946年-黄鸣龙改进了这个方法。