杂卤石制备硫酸钾工艺研究
- 格式:pdf
- 大小:200.39 KB
- 文档页数:3

硫酸钾生产方法综述摘要:文章主要是分析了硫酸钾进行生产的几种工艺技术方法,同时讲解了其的特点以及主要工艺技术,望能为有关人员提供到一定的参考和帮助。
关键字:硫酸钾;工艺;综述1、前言硫酸钾是我国农业上重要的无氯钾肥,也是当前农作物中需要硫重要的补充来源。
硫元素能有效提升到我国农作物的产量,还能明显改善到其的品质,由此可知硫酸钾中的硫也是农作物生产中所需要的重要营养元素。
2、硫酸钾生产工艺的现状目前国内外生产硫酸钾的方法大体可分为三大类:一类是从硫酸盐型海湖盐卤水和地下卤水中提取,其产量约占10%~15%;二是用天然硫酸钾矿石或复杂组分的固体钾矿石制取,其产量占10%左右;三是转化法,即用含硫酸根物料与氯化钾转化制取硫酸钾,其产量约占75%。
目前主要有以下几种工艺。
2.1、海湖盐卤水和地下卤水制取硫酸钾海湖盐卤水制取硫酸钾早期主要有高温盐法和苦卤蒸发—浮选法以及离子交换法等方法。
2.1.1、高温盐法制取硫酸钾此工艺是以盐化工厂氯化钾生产中的副产物高温盐为原料,将高温盐与氯化钾进行一段转化后,得到钾镁矾与氯化钠的混合物。
然后向物料中加入脂肪酸胺盐类捕收剂和萜烯醇类起泡剂及系统所产矾母液制成浆料,送入浮选机内进行浮选分离得到软钾镁矾和工业盐。
软钾镁矾再与氯化钾在水溶液中进行二段转化分离得到硫酸钾。
本方法存在投资较高,设备费用较大,流程长,浮选药剂对产品的质量有一定的影响等缺点。
另外此方法由于还要使用艺产出的氯化钾作为原料投入,造成不必要的重复工作,增加了生产成本。
2.1.2、苦卤蒸发浮选法此工艺是高温盐法制取硫酸钾工艺的进一步改进:用系统自产的光卤石与苦卤掺兑分离出苦盐后进行蒸发浓缩,蒸发至固相为NaCl、水合硫酸镁(MgSO4?H2O)、无水钾镁矾(K2SO4?2MgSO4)、光卤石和氯化钾的混合物,然后从混合盐中分离出纯净的无水钾镁矾和水合硫酸镁,再将其在15℃~66℃下转化为软钾镁矾(K2SO4?MgSO4?6H2O):2(K2SO4?2MgSO4)+2KCl+18H2O3(K2SO4?MgSO4?6H2O)+MgC l22(MgSO4?H2O)+2KCl+4H2OK2SO4?MgSO4?6H2O+MgCl2固液分离后的粗矾主要是软钾镁矾、KCl和NaCl的混合物。

硫酸钾生产工艺硫酸钾是一种广泛应用于农业、化工和医药等领域的化工产品,其生产工艺主要包括矿石选矿、焙烧、浸出、结晶、精制和包装等环节。
以下是一种常见的硫酸钾生产工艺流程。
首先,硫酸钾的主要原料是钾矾石,通过矿石选矿提取纯净的钾矾矿石。
选矿过程中,首先对原料进行破碎、磨矿等物理处理,去除杂质和不需要的矿石部分。
然后,通过浮选、重选等方式,将可用的矿石提取出来。
接下来是焙烧阶段,将经过选矿处理的矿石进行焙烧。
焙烧的主要目的是将硫酸钾矿石中的钾还原为氧化物或碳酸盐,方便后续的浸出。
焙烧温度一般在800℃以上,焙烧时间视具体情况而定。
然后是浸出阶段,将焙烧后的矿石进行浸出。
浸出是将焙烧后的硫酸钾矿石与水进行反应,溶解出钾离子。
这一阶段需要根据具体工艺条件和原料特性确定浸出温度、浸出时间、浸出浓度等参数。
浸出后,通过结晶过程将溶液中的钾离子结晶成硫酸钾晶体。
结晶一般采用蒸发结晶法,即将浸出液进行多级蒸发,浓缩至一定浓度后,再降温结晶。
通过控制结晶条件,可以得到不同粒度、纯度的硫酸钾晶体。
接下来是精制阶段,通过过滤、洗涤等工艺,去除晶体中的杂质和不纯物质,提高硫酸钾产品的纯度。
精制过程中需要控制洗涤液的pH值、温度和流速等参数,以确保产品质量的稳定。
最后是包装和储存阶段,将精制后的硫酸钾产品进行包装,通常用塑料袋或纸箱装袋,再装箱储存。
在储存过程中,需要注意防潮、防晒和防爆等措施,确保产品的品质和安全。
这是一种常见的硫酸钾生产工艺,不同生产厂家和工艺条件可能会有所不同。
但总体来说,硫酸钾生产工艺主要包括矿石选矿、焙烧、浸出、结晶、精制和包装等环节。
通过科学合理的工艺控制和质量管理,可以生产出优质的硫酸钾产品,满足市场需求。

一、前言我国硫酸钾镁肥原料主要是软钾镁矾矿,是一种无氯的硫酸钾镁复合肥。
其分子式是K2SO4·MgSO4·6H2O。
K2O质量分数为23.39%、S质量分数为15.92%、Mg质量分数为6.04%、H2O 质量分数为26.84%。
硫酸钾镁肥生产工艺分为天然提取法和掺混法。
天然提取法工艺原理通过盐湖卤水或固体钾镁盐矿,采用机械物理方法分离氯化钠,将钾镁钒矿直接生产工艺;硫酸钾镁肥掺混法是以硫酸钾或氯化钾与镁盐简单掺混而制取的,但因产品有效成分含量不足、质量参差不齐、CL-超标,急待市场规范。
为了增加硫酸钾镁肥生产工艺研究,利用罗布泊卤水晒制的光卤石为原料实验研究,研究其生产工艺技术路线和工艺参数,得到高质量的硫酸钾镁肥。
二、工艺原理和条件1.光卤石晒矿理论分析罗布泊硫酸镁亚型卤水制取的光卤石矿受限于罗布泊夏季酷暑、冬季严寒等因素,在Na+,K+,Mg2+//Cl-,SO42--H2O五元水盐体系(25℃)介稳相图,以溶解度趋势可以得出,光卤石矿在相图上由D点至E点进行晒制(见图2.1),在晒制光卤石的同时夏季高温时有钾盐镁矾矿次生(不作为考察对象),冬季低温时有泻利盐析出。
图2.1 Na+,K+,Mg2+//Cl-,SO42--H2O五元水盐体系(25℃)介稳相图2.光卤石分解理论分析光卤石分子式为KCL·MgCL2·6H2O,是不对称复盐,因含泻利盐和钾盐镁矾,故利用Na+,K+,Mg2+//Cl-,SO42--H2O 五元水盐体系(25℃)介稳相图进行研究。
光卤石分解属于脱镁的过程,目的是将光卤石矿中的MgCL2进入液相,得到单体氯化钾。
相图中D点Mg2+:7.13%,采用低镁饱和卤水分解光卤石,低于D点的卤水都能达到分解效果,故以相图点C为分解母液点(见图2.1)。
Mg2+:0-7.13%,梯度越大,分解动力越大。
3.泻利盐与氯化钾转化软钾镁矾理论分析依据水盐体系相图理论可知,把氯化钾和泻利盐矿物转化为软钾镁矾,理论转化硫钾比≥2.46,转化后的母液相图点C 是软钾镁矾、氯化钾和泻利盐共饱和点。

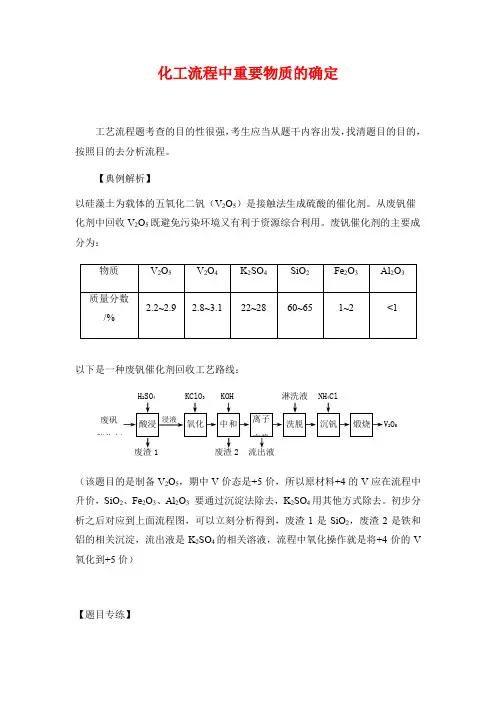
化工流程中重要物质的确定工艺流程题考查的目的性很强,考生应当从题干内容出发,找清题目的目的,按照目的去分析流程。
【典例解析】以硅藻土为载体的五氧化二钒(V2O5)是接触法生成硫酸的催化剂。
从废钒催化剂中回收V2O5既避免污染环境又有利于资源综合利用。
废钒催化剂的主要成分为:以下是一种废钒催化剂回收工艺路线:废矾催化剂V2O5浸液H2SO4KClO3KOH 淋洗液NH4Cl废渣1 废渣2 流出液(该题目的是制备V2O5,期中V价态是+5价,所以原材料+4的V应在流程中升价,SiO2、Fe2O3、Al2O3要通过沉淀法除去,K2SO4用其他方式除去。
初步分析之后对应到上面流程图,可以立刻分析得到,废渣1是SiO2,废渣2是铁和铝的相关沉淀,流出液是K2SO4的相关溶液,流程中氧化操作就是将+4价的V 氧化到+5价)【题目专练】1.废旧印刷电路板是一种电子废弃物,其中铜的含量达到矿石中的几十倍。
湿法技术是将粉碎的印刷电路板经溶解、萃取、电解等操作得到纯铜等产品。
某化学小组模拟该方法回收铜和制取胆矾,流程简图如下:流程中有三处实现了试剂的循环使用,已用虚线标出两处,第三处的试剂是________。
循环使用的NH4Cl在反应Ⅰ中的主要作用是_________________________________________。
答案H2SO4防止由于溶液中的c(OH-)过高,生成Cu(OH)2沉淀解析操作④得到的H2SO4可以利用到反应Ⅲ中,所以第三处循环的试剂为H2SO4;NH4Cl水解溶液呈酸性,可以中和溶液中的OH―,防止由于溶液中的c(OH-)过高,生成Cu(OH)2沉淀。
2.毒重石的主要成分为BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2·2H2O的流程如下:加入NH3·H2O),滤渣Ⅱ中含________(填化学式)。
加入H2C2O4时应避免过量,原因是_____________________________________。

2014年高考题型突破(11 )工艺流程题命题特点:以工业生产为背景,结合给出的流程图进行设问。
主要考查学生利用金属、非金属元素及其化合物的主要性质及相关概念和理论解决化学问题的能力。
一、广东高考题回顾1.(2010广东高考32)碳酸锂广泛应用于陶瓷和医药等领域。
以β-锂辉石(主要成分为Li2O⋅Al2O3⋅4SiO2)为原材料制备Li2CO3的工艺流程如下:已知:Fe3+、Al3+、Fe2+和Mg2+以氢氧化物形式完全沉淀时,溶液的PH分别为3.2、5.2、9.7和12.4;Li2SO4、LiOH和Li2CO3在303K下的溶解度分别为34.2g、12.7g和1.3g。
(1)步骤Ⅰ前,β-锂辉石要粉碎成细颗粒的目的是______ _______。
(2)步骤Ⅰ中,酸浸后得到的酸性溶液中含有Li+、SO42-,另含有Al3+、Fe3+、Fe2+、Mg2+、Ca2+、Na+等杂质,需在搅拌下加入_____________(填“石灰石”、“氯化钙”或“稀硫酸”)以调节溶液的PH到6.0~6.5,沉淀部分杂质离子,然后分离得到浸出液。
(3)步骤Ⅱ中,将适量的H2O2溶液、石灰乳和Na2CO3溶液依次加入浸出液中,可除去的杂质金属离子有___________ ___。
(4)步骤Ⅲ中,生成沉淀的离子方程式为_________ ______。
(5)从母液中可回收的主要物质是_________ ____。
2.(2011广东高考32)由熔盐电解法获得的粗铝含有一定量的金属钠和氢气,这些杂质可采用吹气精炼法除去,产生的尾气经处理后可用钢材镀铝。
工艺流程如下:(注:NaCl熔点为801℃;AlCl3在181℃升华)(1)精炼前,需清除坩埚表面的氧化铁和石英砂,防止精炼时它们分别与铝发生置换反应产生新的杂质,相关的化学方程式为①和②(2)将Cl2连续通入坩埚中的粗铝熔体,杂质随气泡上浮除去。
气泡的主要成分除Cl2外还含有;固态杂质粘附于气泡上,在熔体表面形成浮渣,浮渣中肯定存在(3)在用废碱液处理A的过程中,所发生反应的离子方程式为(4)镀铝电解池中,金属铝为 极,熔融盐电镀中铝元素和氯元素主要以AlCl 4― 和Al 2Cl 7―形式存在,铝电极的主要电极反应式为(5)钢材镀铝后,表面形成的致密氧化铝膜能防止钢材腐蚀,其原因是3.(2012广东高考32)难溶性杂卤石(K 2SO 4·MgSO 4·2CaSO 4·2H 2O )属于“呆矿”,在水中存在如下平衡: K2SO 4·MgSO 4·2CaSO 4·2H 22++2K ++Mg 2++4SO42-+2H 2O为能充分利用钾资源,用饱和Ca(OH)2溶液溶浸杂卤石制备硫酸钾,工艺流程如下:(1)滤渣主要成分有 和 以及未溶杂卤石。

专题6 Ksp专练1.Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备,工艺流程如下:回答下列问题:(1)若“滤液②”中c(Mg2+)=0.02 mol/L,加入双氧水和磷酸(设溶液体积增加1倍),使Fe3+恰好沉淀完全即溶液中c(Fe3+)=1.0×10-5 mol/L,此时是否有Mg3(PO4)2沉淀生成______________(列式计算)。
FePO4、Mg3(PO4)2的Ksp分别为1.3×10-22、1.0×10-24。
2.碳酸钠是一种重要的化工原料,主要采用氨碱法生产。
回答下列问题:(1)向含有BaSO4固体的溶液中滴加Na2CO3溶液,当有BaCO3沉淀生成时溶液中2324 CO SOcc--()()=_____________。
已知K sp(BaCO3)=2.6×10−9,K sp(BaSO4)=1.1×10−10。
3.酸性锌锰干电池是一种一次电池,外壳为金属锌,中间是碳棒,其周围是碳粉,MnO2,ZnCl2和NH4Cl 等组成的糊状填充物,该电池在放电过程产生MnOOH,回收处理该废电池可得到多种化工原料,有关数据下表所示:溶解度/(g/100g水)回答下列问题:(1)用废电池的锌皮制备ZnSO4·7H2O的过程中,需去除少量杂质铁,其方法是:加稀硫酸和H2O2溶解,铁变为_____,加碱调节至pH为时,铁刚好完全沉淀(离子浓度小于1×10-5mol/L时,即可认为该离子沉淀完全);继续加碱调节至pH为_____时,锌开始沉淀(假定Zn2+浓度为0.1mol/L)。
若上述过程不加H2O2后果是,原因是。
4.碘及其化合物在合成杀菌剂、药物等方面具有广泛用途。
回答下列问题:(1)上述浓缩液中含有I-、Cl-等离子,取一定量的浓缩液,向其中滴加AgNO3溶液,当AgCl开始沉淀时,溶液中为:_____________,已知K sp(AgCl)=1.8×10-10,K sp(AgI)=8.5×10-17。

一种硫酸钾的生产工艺
硫酸钾的生产工艺有以下几个步骤:
1. 原料准备:将含有钾的矿石(如钾长石、钾盐矿石等)或含有钾的废料(如矿渣、钾肥废料等)进行破碎、磨细,使其颗粒大小均匀。
2. 硫酸萃取:将破碎后的原料与浓硫酸进行反应,使其反应生成硫酸钾。
反应过程中,通常需要控制反应温度和反应时间,以促进反应的进行。
3. 结晶:将反应产生的硫酸钾溶液进行浓缩,使其达到饱和状态。
然后,通过降温或加入结晶剂等方法,使溶液中的硫酸钾结晶析出。
4. 分离与洗涤:将硫酸钾晶体与母液进行分离,可以通过过滤、离心等方法进行。
然后,对硫酸钾晶体进行洗涤,去除母液和杂质。
5. 干燥:将洗涤后的硫酸钾晶体进行干燥,使其含水量降低到一定程度。
通常使用烘箱或旋转干燥机等设备进行干燥。
6. 粉碎与包装:将干燥后的硫酸钾晶体进行粉碎,使其达到所需的粒度要求。
然后,将粉碎后的硫酸钾进行包装,并进行质量检验。
需要注意的是,硫酸钾的生产工艺可能因生产规模、原料特性等因素而有所差异。
上述步骤仅为一种常见的生产工艺,具体的工艺参数和操作条件需要根据实际情况进行调整。

规范答题模板(四)平衡移动原理的应用[学生用书P175] [掌握规则规范答题赢取满分]续表排查落实练六化学反应速率与化学平衡[学生用书单独成册]一、化学反应速率与化学平衡正误判断题(一)化学反应速率正误判断1.决定化学反应速率的内在因素是反应物本身的性质。
( )2.固体和纯液体的浓度是固定的,增加固体或纯液体的用量,反应速率保持不变。
( )3.可逆反应达到平衡,反应就不再进行。
( )4.增大反应物浓度,化学反应速率一定加快。
( )5.在恒温条件下,增大压强,化学反应速率一定加快。
( )6.在一定条件下,增加反应物的量,化学反应速率一定加快。
( )7.其他条件不变,温度越高,反应速率越快。
( )8.正反应为吸热反应的可逆反应达到平衡时,升高温度,正反应速率增大,逆反应速率减小,平衡向正反应方向移动。
( )9.加入催化剂加快了反应速率,改变了反应吸收或放出的热量。
( )10.同一反应,在相同时间间隔内,用不同物质表示的反应速率,其数值和意义都不一定相同。
( )11.5 mol·L -1·s -1的反应速率一定比1 mol·L -1·s -1的反应速率大。
( )12.对于某可逆反应,反应进行的净速率是正、逆反应速率之差。
( )答案:1.√ 2.√ 3.× 4.× 5.× 6.×7.√ 8.× 9.× 10.× 11.× 12.√(二)化学平衡正误判断1.正反应速率增大,平衡向正反应方向移动。
( )2.在恒容条件下,有两个平衡体系:A(g) 2B(g);2A(g)B(g),都增加A 的量,A 转化率都变小。
( )3.在一定条件下,平衡向正反应方向移动,正反应速率变大。
( )4.由温度或压强改变引起的平衡正向移动,反应物的转化率一定增大。
( )5.平衡向正反应方向移动,反应物的转化率都增大。

昆特依盐湖杂卤石矿“焙烧-热浸”溶钾实验研究程怀德;海擎宇;李俊;唐启亮;李雯霞【摘要】以柴达木盆地昆特依盐湖大盐滩矿区杂卤石矿为原料,进行“焙烧-热浸”溶浸实验,研究300~500℃杂卤石矿的焙烧和焙烧产物90℃热水浸钾效果.结果表明:不同温度下焙烧过程中杂卤石质量减少,是由于杂卤石结构遭受破坏而失去两个结构水;温度越高,杂卤石结构破坏越严重,最低的焙烧温度不低于350℃;焙烧产物在90℃热水中热浸钾收率超过95%,较90℃热水溶杂卤石钾收率(31.23%)和常温21℃溶杂卤石钾收率(23.56%)提高了3倍以上;浸取液钾含量和钾收率随焙烧温度增加而增加.【期刊名称】《无机盐工业》【年(卷),期】2019(051)001【总页数】3页(P26-28)【关键词】杂卤石;焙烧;热浸;钾收率;昆特依盐湖【作者】程怀德;海擎宇;李俊;唐启亮;李雯霞【作者单位】中国科学院青海盐湖研究所,中国科学院盐湖资源综合高效利用重点实验室,青海西宁810008;青海省盐湖地质与环境重点实验室;中国科学院青海盐湖研究所,中国科学院盐湖资源综合高效利用重点实验室,青海西宁810008;青海省盐湖地质与环境重点实验室;中国科学院大学;中国科学院青海盐湖研究所,中国科学院盐湖资源综合高效利用重点实验室,青海西宁810008;青海省盐湖地质与环境重点实验室;中国科学院大学;中国科学院青海盐湖研究所,中国科学院盐湖资源综合高效利用重点实验室,青海西宁810008;青海省盐湖地质与环境重点实验室;中国科学院青海盐湖研究所,中国科学院盐湖资源综合高效利用重点实验室,青海西宁810008;青海省盐湖地质与环境重点实验室【正文语种】中文【中图分类】TQ131.13中国钾盐资源紧缺,钾盐已经成为关系国家利益、粮食安全、矿产资源安全的重要矿种,对国民经济发展具有重要意义。
随着中国卤水钾资源的深度开发及固体可溶性钾资源的缺乏,开发国内丰富的低品位和难溶性钾盐资源,是缓解中国可溶性钾资源贫乏的新途径[1-4]。

关于硫酸钾的生产工艺和市场情况一.硫酸钾的生产工艺:硫酸钾是一种使用广泛的化肥,生产硫酸钾一般分为两大类:一类是从天然矿物中直接提取,如从钾镁矾、明矾石、杂卤石、钾硭硝等矿物中提取;另一类为转化法,即以氯化钾为原料经化学反应后制取硫酸钾,当今世界上70%的硫酸钾是用转化法生产的。
在转化法中,又分为热法和湿法两种。
⒈湿法:主要有复分解法、缔置法、溶剂萃取法等。
⒉热法:曼海姆法、CHISSO 法和CLIMAX法等。
其中,曼海姆法使用最为广泛,反应炉温度只有550℃,设备结构简单,产品硫酸钾品位高,K2O≥50%,生产过程中基本无损失,K收率高。
该发1992年由云南磷肥厂引进日本技术设备,建成1.2万吨/年硫酸钾装置;其后各地陆续引进“台湾青上”的生产装置及国内开发生产装置。
国内装置造价很便宜,相当于引进价格的1/3,水平达到甚至高于引进设备,是制取大量Hcl和PVC的最佳方案。
目前,该套设备已全部国产化。
据统计,到 2003年底为止,国内使用该法生产的厂家已达28家之多,总生产能力达到了100余万吨/年,但个体生产能力都不大,最大的为20万吨/年。
Chisso法是日本最先使用的方法,优点是腐蚀小,但能耗高,流程长,国内很少采用。
Climax法:美国硫化床工艺,国内尚无引进和使用。
二.市场情况⒈原料生产情况:加拿大是世界上最大的钾盐资源国、生产国和出口国,截至1999年底,拥有钾盐资源量44亿吨,占世界总储量的52.3%,年产钾盐940万吨/年,占世界总产量的37.8%。
在世界钾肥市场起决定作用的两家加拿大公司是PotashCorp公司和IMC Global Inc公司,每年开采350万吨钾盐。
俄罗斯是世界第二大钾盐生产国,2002年共开采500万吨,80%为出口,中国是其主要进口国,占其出口总量的一半左右。
白俄罗斯为第三大钾盐生产国。
2002年开采量达400万吨,近年受市场影响,略有下降,每年维持在200万吨左右。