HPLC法测定左亚叶酸钙中的右旋异构体
- 格式:pdf
- 大小:210.54 KB
- 文档页数:2

高效液相色谱法测定磷酸左奥硝唑酯二钠中异构体的含量【摘要】目的:探讨测定磷酸左奥硝唑酯二钠异构体含量的方法。
方法:采用高效液相色谱法。
色谱柱:ULTRON ES-OVM (150mm×4.6mm,5μm),SHINWA CHEMICAL INDUSTRIES.LTD;流动相:以0.02 mol·L-1磷酸盐缓冲液(pH值为3.0)-甲醇(65:35);流速为每分钟1ml;检测波长为321nm;柱温:25℃。
结果:该方法专属性强,在较大范围内线性关系良好,精密度高,RSD为2.1%。
结论:高效液相色谱法可用于测定磷酸左奥硝唑酯二钠原料中异构体的含量。
【关键词】磷酸左奥硝唑酯二钠;异构体;高效液相色谱法磷酸左奥硝唑酯二钠为我公司研发的化学1.1类新药,在体内可以迅速分解为有效成分左旋奥硝唑而起到抗厌氧菌的作用。
本品作为一种手性药物,为有效监控检查其中的异构体杂质,需建立一种完善的异构体测定方法。
迄今为止,尚未见磷酸左奥硝唑酯二钠异构体的含量方法的相关报道,鉴于此,我们研究开发了高效液相色谱法测定磷酸左奥硝唑酯二钠异构体含量的方法,旨在寻找一种更加科学合理的异构体杂质的控制方法。
1.仪器与试药仪器:美国 Thermo U3000高效液相色谱仪, 包括 U3000四元泵, U3000可变检测波长, U3000柱温箱,U3000自动进样器。
试药:磷酸左奥硝唑酯二钠,由华创合成制药股份有限公司提供。
对照品:磷酸左奥硝唑酯二钠,由华创合成制药股份有限公司提供。
异构体杂质对照:磷酸右奥硝唑酯二钠,由华创合成制药股份有限公司提供。
甲醇为色谱纯,其他试剂均为分析纯。
2.方法与结果2.1方法选择高效液相色谱法,由于HPLC方法具有较好的灵敏度及较强的专属性,故建立HPLC方法测定本品的右旋异构体杂质的含量。
2.2检测波长的选择选择磷酸左奥硝唑酯二钠的最大吸收波长321nm作为异构体检测波长。
2.3色谱柱的选择磷酸左奥硝唑酯二钠结构中含强极性的磷酯基团,使得其手性分离较难,目前常用的纤维素类衍生物、淀粉衍生物类型的色谱柱难以对其作出有效分离。
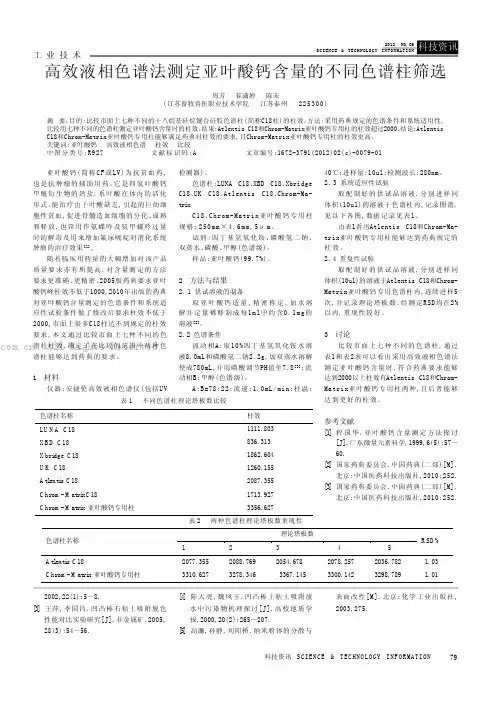
79科技资讯 S CI EN CE & T EC HNO LO GY I NF OR MA TI ON 工 业 技 术亚叶酸钙(简称CF 或LV)为抗贫血药,也是抗肿瘤的辅助用药。
它是四氢叶酸钙甲酰衍生物的钙盐,系叶酸在体内的活化形式。
能治疗由于叶酸缺乏,引起的巨幼细胞性贫血,促进骨髓造血细胞的分化、成熟和释放,也常用作氨蝶呤及氨甲蝶呤过量时的解毒及用来增加氟尿嘧啶对消化系统肿瘤的治疗效果[1]。
随着临床用药量的大幅增加对该产品质量要求亦有所提高,对含量测定的方法要求更准确、更精密。
2005版药典要求亚叶酸钙峰柱效不低于1000,2010年出版的药典对亚叶酸钙含量测定的色谱条件和系统适应性试验条件做了修改后要求柱效不低于2000,市面上很多C18柱达不到规定的柱效要求,本文通过比较市面上七种不同的色谱柱柱效,确定了在比较的范围中两种色谱柱能够达到药典的要求。
1 材料仪器:安捷伦高效液相色谱仪(包括UV检测器)。
色谱柱:LUNA C18、XBD C18、Xbridge C18、UK C18、Atlentis C18、Chrom-Ma-trixC18、Chrom-Matrix亚叶酸钙专用柱规格:250m m ×4.6mm ,5μm 。
试剂:四丁基氢氧化铵、磷酸氢二钠、双蒸水、磷酸、甲醇(色谱级)。
样品:亚叶酸钙(99.7%)。
2 方法与结果2.1供试溶液的制备取亚叶酸钙适量,精密称定,加水溶解并定量稀释制成每1m l中约含0.1m g的溶液[2]。
2.2色谱条件流动相A:取10%四丁基氢氧化铵水溶液8.0mL和磷酸氢二钠2.2g,加双蒸水溶解使成780mL,并用磷酸调节PH值至7.8[3];流动相B:甲醇(色谱级)。
A:B=78:22;流速:1.0mL/min;柱温:40℃;进样量:10ul;检测波长:280nm。
2.3系统适应性试验取配制好的供试品溶液,分别进样同体积(10ul)的溶液于色谱柱内,记录图谱,见以下各图,数据记录见表1。


高效液相色谱法测定叶酸片的含量高效液相色谱法测定叶酸片的含量【摘要】叶酸是由喋呤啶、对氨基苯甲酸和谷氨酸等组成的化合物,是一种水溶性B族维生素,相当于蝶酰谷氨酸。
固定相为:依利特hypersil BDSC18 色谱柱(4.6*250*5u ),乙腈-甲醇-水-冰醋酸(25:10:65∶0.1)为流动相,检测波长为254nm;叶酸在20~280μg·mL-1范围内呈良好的线性关系。
叶酸的平均回收率为99.3%。
本法简便、重现性好、回收率高,可用于叶酸片中叶酸的含量测定。
【关键词】叶酸片;叶酸;测定叶酸是由喋呤啶、对氨基苯甲酸和谷氨酸等组成的化合物,是一种水溶性B 族维生素,相当于蝶酰谷氨酸[1-2]。
叶酸从菠菜叶中提取纯化的,故而命名为叶酸。
叶酸对孕妇尤其重要。
叶酸用于预防胎儿神经管畸形,准妈妈在备孕期间就服用0.4毫克叶酸可以下降胎儿神经管畸形率85%[3-4]。
如在怀孕头3个月内缺乏叶酸,可导致胎儿神经管发育缺陷,从而增加裂脑儿,无脑儿的发生率。
人类如缺乏叶酸可引起巨红细胞性贫血以及白细胞减少症,还会导致身体无力、易怒、没胃口以及精神病症状[5-7]。
本文用高效液相法对叶酸片中的叶酸的进行了含量测定。
1.仪器与试药1.1仪器LC-100(梯度配置)高效液相色谱仪(上海伍丰科学仪器有限公司);CO-1000型色谱柱温箱(武汉恒信世纪科技有限公司);制冷和加热循环槽(上海汗诺仪器有限公司);UV-1800紫外/可见分光光度计(上海美谱达仪器有限公司);ELGA超纯水器(上海澜锐仪器科技有限公司);ABS 220-4分析天平(德祥科技有限公司);3升基本型超声波清洗器(天津市瑞普电子仪器公司);TΜ-1901 双光束紫外可见分光光度计(北京普析通用仪器有限责任公司)。
1.2试药乙腈(杭州兴成化工有限公司)、磷酸(江西省新干县金成化工厂)、盐酸(襄樊金译成精细化工有限公司)、磷酸氢二铵(淄博市淄川区鑫川化工厂)、冰醋酸(吴江市龙申化工有限公司)、甲醇(江西省新干县金成化工厂)、冰乙酸(杭州兴成化工有限公司)、四氢呋喃(吴江市龙申化工有限公司)。

一种快速测定注射用亚叶酸钙中亚叶酸钙含量的方法王春怡;任亚东【摘要】目的建立紫外-可见分光光度法测定注射用亚叶酸钙中间体亚叶酸钙含量的方法.方法采用UV法测定亚叶酸钙含量,检测波长为282 nm,并对UV法与HPLC法测定结果进行比较.结果亚叶酸钙质量浓度在1.0~10.0μg·mL-1范围内与吸光度呈良好的线性关系,r=0.999 9,平均回收率为99.87%,RSD为0.87%.UV 法与HPLC法在测定同一批注射用亚叶酸钙样品时,两者差异无统计学意义(P>0.05).结论该方法操作简便、快速、准确,可用于亚叶酸钙中间体质量控制.%Objective To establish ultraviolet spectrometry method to determine the intermediate for calcium folinate injection. Methods Ultraviolet spectrometry was applied with 282 nm detection wavelength, and the determination results with UV and HPLC methods were compared and analyzed. Results The calibration curve of calciun folinate was in a good linearity within the range of 1.0 - 10.0 μg · mL-1 ,and the average recovery was 99. 87% with RSD of 0. 87%. No significant difference was observed between the determination results with UV and HPLC methods ( P > 0. 05 ). Conclusion This method is convenient,rapid and accurate,and can be used in quality control of calcium folinate intermediate for injection.【期刊名称】《广东药学院学报》【年(卷),期】2011(027)002【总页数】3页(P154-156)【关键词】注射用亚叶酸钙;亚叶酸钙;UV法【作者】王春怡;任亚东【作者单位】广州中医药大学中药学院,广东,广州,510006;扬子江药业集团,广东,广州,510663【正文语种】中文【中图分类】R927.1注射用亚叶酸钙为亚叶酸钙的无菌冻干品,为类白色至黄色的疏松块状物或粉末,主要成分为亚叶酸钙,常用作氨蝶呤及氨甲蝶呤过量时的解毒剂,具有对抗叶酸拮抗剂(如氨甲蝶呤、乙胺嘧啶和甲氧苄氨嘧啶等药)毒性作用。

右旋佐匹克隆中手性杂质含量测定的方法学研究
王国成;杨芳;杨丽萍;郭立民
【期刊名称】《沈阳药科大学学报》
【年(卷),期】2004(21)2
【摘要】目的建立右旋佐匹克隆中手性杂质含量的测定方法。
方法RP HPLC法 ,色谱柱为CHI RALCELOD R( 2 5 0mm× 4 6mm ,5 μm) ;流动相为乙腈磷酸氢二钠缓冲液( pH =6 5 ,V∶V =5 0∶5 0 ) ;流速0 6mL·min-1;检测波长为 3 0 5nm ;柱温3 5℃。
结果右旋佐匹克隆质量浓度在 0 5~8 0mg·L-1内 ,线性关系良好(r=0 9998)。
结论可用于右旋佐匹克隆中手性杂质的含量测定。
【总页数】3页(P124-125)
【关键词】右旋佐匹克隆;手性杂质;含量测定
【作者】王国成;杨芳;杨丽萍;郭立民
【作者单位】天津天士力集团化学制药研究所
【正文语种】中文
【中图分类】R94
【相关文献】
1.柱前手性衍生化-高效液相色谱法测定棉籽仁中左旋和右旋棉酚含量 [J], 何晓文;李新霞;姚军;张煌涛;薛海燕
2.固相萃取-手性气相色谱法测定醒脑静注射液中右旋龙脑和麝香酮的含量 [J], 张莉;陈飞;红玉;高展;孙玉侠;王家成;郭青
3.手性流动相添加剂法测定苯磺酸左旋氨氯地平片的含量及其右旋杂质 [J], 刘志辉
4.2种分析测定右旋苯醚菊酯原药中右旋体含量的方法比对研究 [J], 史卫莲;陈萍;孙春燕;张春妮
因版权原因,仅展示原文概要,查看原文内容请购买。

亚叶酸钙检验操作规程
《亚叶酸钙检验操作规程》
一、实验目的
通过本次实验,掌握亚叶酸钙检验的操作方法,学习化学分析的基本原理和技能,提高实验操作的能力。
二、实验仪器与试剂
1. 仪器:pH计、天平、恒温槽等
2. 试剂:硝酸亚铁溶液、食盐溶液、硝酸铁溶液、硫代硫酸钠溶液、硫酸亚铁溶液、巯基乙酸、亲水树脂等
三、实验步骤
1. 取亚叶酸钙样品0.5g,加入试管中,用硝酸亚铁溶液溶解,再加入食盐溶液,定容至25ml。
2. 取一部分试液,空白对照用硝酸亚铁定容至25ml。
3. 两管试液中加入硝酸铁溶液,振荡混匀,再加入硫代硫酸钠和硫酸亚铁溶液。
4. 在试管中分别加入巯基乙酸,振荡混匀,过滤,收集滤液,测定pH值。
5. 将收集的滤液加入亲水树脂中,将树脂滴入的那部分液体与另一部分用盐酸溶解的标准叶酸相对照,用紫外分光光度计分析。
四、实验注意事项
1. 实验操作过程中需要仔细,遵循实验规程,注意安全。
2. 实验中使用的仪器和试剂需要及时清洗清理,保持良好状态。
3. 实验中需要精确控制操作时间和温度,确保实验数据的准确性。
通过本次实验,不仅可以掌握亚叶酸钙检验的操作方法,还可以加深对化学分析原理和技能的理解,为今后的实验操作积累经验。

㊀基金项目:山东省重点研发计划(No.2018GSF118132)ꎻ∗同为通信作者㊀作者简介:赵琦ꎬ女ꎬ主管药师ꎬ研究方向:药学ꎬE-mail:828zhaoqi@163.com㊀通信作者:李永贵ꎬ男ꎬ高级工程师ꎬ研究方向:新药研发ꎬTel:135****2390ꎬE -mail:lyg-1230@163.comꎻ孙清ꎬ女ꎬ副主任药师ꎬ研究方向:化药质量研究ꎬTel:0531-88562292ꎬE-mail:1483476147@qq.comHPLC法测定叶酸原料中光学异构体的含量赵琦1ꎬ邹云红2ꎬ李永贵2∗ꎬ孙清2∗(1.山东省荣军总医院ꎬ山东济南250014ꎻ2.山东省药学科学院ꎬ山东省化学药物重点实验室ꎬ山东济南250101)摘要:目的㊀建立高效液相色谱(HPLC)法测定叶酸原料药中光学异构体(D-叶酸)的检测方法ꎮ方法㊀采用QN-AX手性色谱柱(4.6mmˑ150mmꎬ5μm)ꎬ甲醇-乙腈-乙酸-三乙胺(50ʒ50ʒ2ʒ3)为流动相ꎬ流速0.6mL min-1ꎬ检测波长280nmꎬ柱温35ħꎮ结果㊀D-叶酸与叶酸之间的分离度良好ꎬD-叶酸浓度在0.2497~1.9974μg mL-1范围内线性关系良好(R2=0.9998)ꎬ平均回收率为97.24%ꎬRSD为1.20%ꎮ结论㊀该方法简单㊁快速㊁专属性强ꎬ可用于叶酸原料中D-叶酸的检测ꎮ关键词:叶酸ꎻD-叶酸ꎻ异构体ꎻ高效液相色谱法ꎻ含量测定中图分类号:R927.2㊀文献标识码:A㊀文章编号:2095-5375(2022)03-0162-003doi:10.13506/j.cnki.jpr.2022.03.006DeterminationofopticalisomersinfolicacidbyHPLCZHAOQi1ꎬZOUYunhong2ꎬLIYonggui2∗ꎬSUNQing2∗(1.ShandongRongjunGeneralHospitalꎬJinan250014ꎬChinaꎻ2.ShandongProvincialKeyLaboratoryofBiomedicalPolymersꎬShandongAcademyofPharmaceuticalScienceꎬJinan250101ꎬChina)Abstract:Objective㊀ToestablishanHPLCmethodforthedeterminationoftheopticalisomer(D-folicacid)infolicacid.Methods㊀ThechromatographicseparationwasperformedonchiralchromatographycolumnQN-AX(4.6mmˑ150mmꎬ5μm).Themobilephasewasconsistedofmethanol-acetonitrile-aceticacid-triethylamine(50ʒ50ʒ2ʒ3)andtheflowratewas0.6mL min-1.Thedetectionwavelengthwas280nmandthecolumntemperaturewas35ħ.Results㊀TheseparationwasgoodbetweenD-folicacidandfolicacid.ThelinearrangofD-folicacidwas0.2497~1.9974mL min-1(R2=0.9998)andtheaveragerecoverywas97.24%ꎬwithRSDof1.20%.Conclusion㊀Themethodwassimpleꎬrapidandhighlyspecific.ItcanbeusedforthedeterminationofD-folicacidinfolicacid.Keywords:FolicacidꎻD-folicacidꎻOpticalisomersꎻHPLCꎻDetermination㊀㊀叶酸(folicacid)是B族维生素的一种ꎬ又称维生素B9㊁维生素Bc㊁维生素Mꎬ是一种抗贫血及预防新生儿出生缺陷的药物[1-3]ꎮ它集预防㊁治疗和保健于一身ꎬ是机体细胞生长和繁殖所必需的物质ꎬ在体内以四氢叶酸的形式起作用ꎬ参与嘌呤核酸和嘧啶核苷酸的合成和转化ꎮHouse等[4-9]对叶酸对妇女孕育生命及不良生育新生儿神经管畸形的发生方面做了研究ꎬ缺乏叶酸会引起神经缺陷㊁动脉硬化㊁高血压㊁心血管疾病甚至癌症等ꎮ叶酸由蝶啶环㊁对氨基苯甲酸和谷氨酸组成ꎬ分子中含有手性结构ꎬ存在光学异构体D-叶酸ꎮ药物的光学异构体在活性㊁代谢过程及药理毒理学方面与药物本身常常有显著差异ꎬ为提高药物活性㊁减小副作用ꎬ需要对药物中的光学异构体进行分离研究[10]ꎮ国家药品监督管理局药品审评中心发布的«第一批拟不推荐参比制剂化药品种药学研究技术要求»(征求意见稿)中明确要求对叶酸片(0.4mg)中光学异构体进行研究ꎬ但目前叶酸各国药典标准中ꎬ均未提供叶酸光学异构体D-叶酸的检测方法ꎮ本研究建立了高效液相色谱法测定叶酸中光学异构体D-叶酸的检测方法ꎬ弥补了药典缺陷ꎬ为药典标准提供补充ꎬ更好的控制叶酸质量ꎬ保证叶酸的用药安全[11-13]ꎮ1㊀仪器与试药1.1㊀仪器㊀高效液相色谱仪(岛津LC-20AT泵㊁SPD-M20A型PDA检测器)ꎻ分析天平(SartoriusBT125D)ꎻpH计(梅特勒SevenExcellence)ꎻ超纯水机(上海杲森仪器设备有限公司)ꎮ1.2㊀试药㊀D-叶酸对照品(KLSSstandards纯度:96.46%)ꎻ叶酸(河北冀衡集团有限公司)ꎻ甲醇(山东禹王实业有限公司ꎬ色谱纯)ꎻ乙腈(天津赛孚瑞科技有限公司ꎬ色谱纯)ꎻ三乙胺(天津大茂化学试剂厂ꎬ分析纯)ꎻ乙酸(天津市富宇精细化工有限公司ꎬ分析纯)ꎮ2㊀方法与结果2.1㊀色谱条件㊀色谱柱为大赛璐QN-AX手性色谱柱(4.6mmˑ150mmꎬ5μm)ꎻ流动相为甲醇-乙腈-乙酸-三乙胺(50ʒ50ʒ2ʒ3)ꎬ流速0.6mL min-1ꎻ检测波长为280nmꎬ柱温为35ħꎬ进样体积20μL[14]ꎮ2.2㊀样品制备㊀配样溶剂:3%三乙胺甲醇溶液ꎮD-叶酸对照品溶液:精密称取D-叶酸对照品约10mg置100mL量瓶中ꎬ加配样溶剂适量使溶解ꎬ用配样溶剂稀释至刻度ꎬ摇匀ꎬ作为D-叶酸储备液ꎮ精密量取D-叶酸储备液1mL置100mL量瓶中ꎬ加配样溶剂稀释至刻度ꎬ摇匀ꎬ作为对照品溶液ꎮ供试品溶液:精密称取叶酸约10mg置50mL量瓶中ꎬ加配样溶剂溶解并稀释至刻度ꎬ摇匀ꎮ2.3㊀专属性试验㊀分别取 2.2 项下配样溶剂㊁对照品溶液㊁供试品溶液各20μL注入液相色谱仪ꎬ记录色谱图及峰面积ꎮ结果表明ꎬ在本检测条件下ꎬ配样溶剂对D-叶酸测无干扰ꎬD-叶酸与叶酸分离良好ꎮ2.4㊀定量限与检测限㊀量取 2.2 项下对照品溶液ꎬ加配样溶剂稀释成不同浓度梯度的溶液ꎬ分别取20μL注入液相色谱仪ꎬ测得D-叶酸定量限为2.50ng(S/Nʈ10)ꎬ检测限为1.00ng(S/Nʈ3)ꎮ2.5㊀线性试验㊀量取 2.2 项下叶酸对照品储备液5mL置100mL量瓶中ꎬ用配样溶剂稀释至刻度ꎬ摇匀ꎬ作为线性储备液ꎮ分别精密量取线性储备液0.5㊁1.0㊁2.0㊁3.0㊁4.0mL置10mL量瓶中ꎬ用配样溶剂稀释至刻度ꎬ摇匀ꎬ作为线性溶液1~5ꎮ精密量取上述溶液各20μL注入液相色谱仪ꎬ记录色谱图及峰面积ꎮ以D-叶酸浓度C为横坐标ꎬD-叶酸峰面A.配样溶剂ꎻB.D-叶酸对照品溶液ꎻC.供试品溶液图1㊀专属性试验HPLC图谱积A为纵坐标做线性回归ꎬ求得回归方程Y=87137X-5179ꎬR2=0.9998ꎬ说明D-叶酸浓度在0.2497~1.9974μg mL-1浓度范围内线性关系良好ꎮ图2㊀D-叶酸峰面积与浓度线性关系图2.6㊀溶液稳定性试验㊀取 2.2 项下对照品溶液ꎬ分别于0㊁2㊁4㊁6㊁8㊁12㊁24h量取20μL注入液相色谱仪ꎬ记录色谱图及峰面积ꎮ结果D-叶酸平均峰面积为81122ꎬRSD为0.99%ꎬ说明D-叶酸对照品溶液24h内稳定ꎮ2.7㊀仪器精密度试验㊀量取 2.2 项下D-叶酸对照品溶液20μL注入液相色谱仪ꎬ连续进样6次ꎬ记录色谱图中D-叶酸峰面积Aꎬ结果D-叶酸平均峰面积为80277ꎬRSD为0.63%ꎬ表明仪器精密度良好ꎮ2.8㊀回收率试验㊀精密量取 2.2 项下D-叶酸对照品储备液0.8㊁1.0㊁1.2mL(约相当于D-叶酸限度的80%㊁100%㊁120%)置100mL量瓶中ꎬ分别加入叶酸20mg用配样溶剂溶解并稀释至刻度ꎬ摇匀ꎬ各浓度平行配制3份ꎬ依法测定ꎬ计算回收率ꎬ结果见表1ꎮ表1㊀D-叶酸回收率试验结果(n=9)加入量/μg测得量/μg回收率(%)平均回收率(%)RSD(%)79.9576.3895.5379.9576.8796.1579.9577.4096.8199.9397.2097.2799.9397.3597.4297.241.2099.9399.6599.72119.92117.3897.88119.92116.5697.20119.92116.5197.162.9㊀样品检测㊀取叶酸3批ꎬ按照 2.2 项下方法配制供试品及D-叶酸对照品溶液ꎬ按照 2.1 项下色谱条件ꎬ分别取20μL注入色谱仪ꎬ记录色谱图及峰面积ꎬ按外标法计算ꎬ结果D-叶酸含量分别为0.049%㊁0.046%㊁0.043%ꎮ3 讨论3.1㊀检测波长选择㊀对D-叶酸对照品溶液进行全波长扫描ꎬ结果显示D-叶酸在280nm波长处有最大吸收ꎬ因此选用280nm检测波长进行检测ꎮ3.2㊀配样溶剂选择㊀叶酸在水㊁乙醇㊁乙腈中溶解性差ꎬ在碱性溶液中易溶ꎮ研究过程中分别选用流动相㊁甲醇㊁乙腈㊁5%氨水溶液㊁四氢呋喃-甲醇-水-醋酸-三乙胺(10ʒ80ʒ10ʒ2.4ʒ3)㊁3%三乙胺甲醇溶液作为配样溶剂ꎬ结果叶酸在流动相㊁甲醇㊁乙腈均不能完溶解ꎬ在5%氨水溶液㊁四氢呋喃-甲醇-水-醋酸-三乙胺(10ʒ80ʒ10ʒ2.4ʒ3)㊁3%三乙胺甲醇溶液中可以完全溶解ꎮ由于叶酸在3%三乙胺甲醇溶液中溶解快速且与流动相接近ꎬ因此最终选用3%三乙胺甲醇溶液作为最终配样溶剂ꎮ3.3㊀目前«欧洲药典»«日本药典»«美国药典»«英国药典»«中国药典»等多国药典均已收录叶酸质量标准ꎬ但均未对叶酸光学异构体进行控制ꎮ本研究建立了高效液相色谱法测定叶酸异构体D-叶酸的检测方法ꎬ并进行了方法学研究ꎬ结果表明该方法专属性强ꎬ可用于检测叶酸中异构体D-叶酸的含量ꎮ参考文献:[1]㊀吴宏富ꎬ黄卫平ꎬ刘放.高效液相色谱法测定叶酸片的含量与有关物质[J].医药导报ꎬ2014ꎬ33(3):389-392. [2]赵洪霞ꎬ梁劲松.高效液相色谱法测定叶酸片有关物质方法学研究[J].安徽农业科学ꎬ2011ꎬ39(28):17139-17140.[3]魏炜.色质联用分析叶酸杂质谱和未知残留溶剂[D].杭州:浙江工业大学ꎬ2016.[4]HOUSESHꎬNICHOLSJAꎬRAESꎬetal.Folatesꎬfolicacidandpreconceptioncare-areview[J].JRSMOpenꎬ2021ꎬ12(5):2054270420980875.[5]袁碧波ꎬ王秋霞ꎬ李增彦ꎬ等.叶酸代谢障碍与复发性流产相关性研究进展[J].国际妇产科学杂志ꎬ2021ꎬ48(2):191-195.[6]段梅红.叶酸不仅是孕育生命的需要[J].百科知识ꎬ2021(8):44-48.[7]胡浩梅ꎬ杨华.叶酸与不良生育的相关研究[J].国际妇产科学杂志ꎬ2021ꎬ48(1):89-94.[8]DELAFOURNIÈREBꎬDHOMBRESFꎬMAURICEPꎬetal.PreventionofNeuralTubeDefectsbyFolicAcidSup ̄plementation:ANationalPopulation-BasedStudy[J].Nu ̄trientsꎬ2020ꎬ12(10):3170.[9]BROWNLLꎬCOHENBEꎬEDWARDEꎬetal.Physiologi ̄calNeedforCalciumꎬIronꎬandFolicAcidforWomenofVariousSubpopulationsDuringPregnancyandBeyond.[J].JWomensHealthꎬ2021ꎬ30(2):207-211.[10]唐琴ꎬ宋航ꎬ付超ꎬ等.高效液相色谱手性固定相法拆分克伦特罗对映体[J].分析化学ꎬ2004ꎬ32(6):755-758. [11]康文怀ꎬ叶晓利ꎬ李慧ꎬ等.食品中叶酸分析方法及稳定性研究进展[J].河北科技大学学报ꎬ2019ꎬ40(5):446-453.[12]李娜ꎬ黄挺ꎬ全灿ꎬ等.叶酸标准物质中杂质的分析研究[J].化学试剂ꎬ2016ꎬ38(11):1077-1080.[13]徐陈凤ꎬ惠文凯ꎬ孙莉莉ꎬ等.基于超滤离心前处理的液相色谱-串联质谱法手性拆分人血浆中的亚叶酸和5-甲基四氢叶酸非对映异构体及其药代动力学应用[J].色谱ꎬ2019ꎬ37(6):581-588.[14]周书荣ꎬ李冰洁ꎬ陈雯ꎬ等.分离检测叶酸中叶酸及叶酸光学异构体的方法:112649524A[P].2021-04-13.。

叶酸液相色谱检测方法1. 引言1.1 背景介绍叶酸是一种B族维生素,也被称为维生素B9,是人体生长发育和细胞分裂所必需的营养物质。
叶酸在体内主要参与DNA和RNA的合成,对胎儿脑部和脊柱的发育具有重要影响。
由于人体无法自行合成叶酸,因此需要通过饮食来摄入。
叶酸缺乏可能导致贫血、胎儿神经管缺陷、心血管疾病等严重健康问题。
为了准确检测叶酸的含量,液相色谱检测方法应运而生。
液相色谱是一种高效、精确的分析方法,通过样品溶液在固定相中的移动速度差异来分离和检测不同物质。
叶酸液相色谱检测方法具有高灵敏度、高准确性、高分辨率的优势,已被广泛应用于食品安全、生物医学等领域。
本文旨在介绍叶酸的生物学功能、叶酸缺乏的危害、液相色谱检测方法的原理和步骤,以及叶酸液相色谱检测方法的优势和应用前景,以加深对叶酸及其检测方法的理解。
1.2 研究目的研究目的是为了建立一种高效、准确、稳定的叶酸液相色谱检测方法,以满足日益增长的叶酸检测需求。
通过对叶酸的生物学功能和缺乏危害的深入研究,我们可以更好地了解叶酸在人体中的作用和重要性。
探讨液相色谱检测方法的原理和步骤,可以帮助我们更好地理解该方法的工作机制和操作流程。
分析叶酸液相色谱检测方法的优势,可以帮助我们更好地评估该方法在叶酸检测中的作用和价值。
最终,通过探讨叶酸液相色谱检测方法的应用前景和意义,可以为该方法的推广和应用提供理论支持和指导,为叶酸检测及相关领域的研究和临床应用提供有益参考。
2. 正文2.1 叶酸的生物学功能叶酸是一种维生素B族的重要成员,也被称为维生素B9。
它在人体内扮演着多种重要的生物学功能。
叶酸在DNA合成过程中起着关键的作用,帮助细胞进行分裂和生长,对胎儿的神经系统发育至关重要。
叶酸还参与了氨基酸代谢,并帮助维持正常的红细胞形成。
叶酸在蛋白质代谢和细胞信号传导中也发挥着重要作用。
叶酸的生物学功能在身体内是十分复杂而精密的,对许多生理过程都有着重要影响。
确保身体充足的叶酸水平对于维持身体健康至关重要。

高效液相色谱法测定叶酸片的含量与有关物质吴宏富;黄卫平;刘放【摘要】目的建立测定叶酸片含量及有关物质的高效液相色谱(HPLC)法.方法采用Hypersil C18(4.6 mm×250 mm,5 μm)色谱柱,流动相磷酸盐缓冲液(磷酸二氢钾6.8 g与0.1 mol·L-1氢氧化钾溶液70 mL,加水稀释至800 mL,调节pH至6.3,加甲醇80 mL,用水稀释成1 000 mL为流动相),检测波长254 nm.结果叶酸在19.80~277.24 μg·mL-1浓度范围内,峰面积与浓度呈良好线性关系(r=0.999 9,n =7),平均回收率98.65%~98.95%,RSD=0.20%~0.60% (n=9).叶酸及其有关物质得到基线分离,方法最低检测限0.6 ng,控制总杂质量不得超过2.0%.结论该方法测定叶酸片的含量及有关物质,方法简便、快速、结果准确,专属性好,适用于叶酸片及其制剂的质量控制.【期刊名称】《医药导报》【年(卷),期】2014(033)003【总页数】4页(P389-392)【关键词】叶酸;有关物质;质量控制;色谱法,高效液相,反相【作者】吴宏富;黄卫平;刘放【作者单位】浙江省庆元县中医院药剂科,庆元,323800;浙江医学高等专科学校,杭州,310053;浙江省医学科学院药物研究所,杭州,310013【正文语种】中文【中图分类】R977.2;R927.1叶酸(folic acid)是一种抗贫血药物,亦称维生素M或维生素BC,与人体重要的生化过程密切相关,直接影响核酸的合成及氨基酸代谢,对细胞分裂、增殖和组织生长具有极其重要的作用,妇女怀孕早期适量增补叶酸可以降低神经管畸形的发生[1]。
叶酸已成为一种集预防、治疗和保健于一身的多功能药物而越来越受到重视。
有关叶酸分析方法的报道有紫外分光光度法[2]、一阶导数光谱法[3]、流动注射化学发光法[4]以及高效液相色谱法等,其中以高效液相色谱法最常用。

高效液相色谱法测定左亚叶酸钙注射液有关物质的条件研究【摘要】目的建立左亚叶酸钙注射液有关物质测定方法。
方法采用反相离子对试剂高效液相色谱法,色谱柱为Varian C18 (250mm×4.6mm,5μm),流动相:(磷酸氢二钠2.2g加10%四丁基氢氧化铵8ml,以水稀释到780ml,用1→10磷酸调节pH至7.8):甲醇为78:22;流速:1.0ml/min;柱温:40℃;检测波长286nm。
结果左亚叶酸钙质量浓度为0.04~120μg/ml内,线性关系良好(r=0.9999)。
结论方法专属性好,准确,灵敏,用于左亚叶酸钙注射液有关物质测定结果可靠。
【关键词】高效液相色谱法;左亚叶酸钙注射液;有关物质;10-甲酰叶酸【Abstract】 Objective To establish the method to determine the related substance in calcium levfolinate injection.Methods The RP-ion pair HPLC methods was used,use a Varian C18 column (250mm×4.6mm,5μm),the mobile phase consisted 0.8mg/ml tetrabutyl aminourium hydroxide acid and 2.2g disodium hydrogen phosphate,adjusted to pH 7.8 with 1→10phosphoric acid:methanol 78:22,at a flow rate of 1.0ml/min,the temperature of the column was 40℃,detection wavelength was286nm.Results The linear calibratien curves obtained in concentration range of 0.04~120μg/ml at calcium levfolinate (r=0.9999).Conclusion The method is simple,accurate,sensitive and reliable for determination the related substance in calcium levofolinate injection.【Key words】 HPLC;calcium levofolic acid injection; related substance;10-formylfolic acid左亚叶酸钙注射液是采用经手性拆分亚叶酸钙后所得左亚叶酸钙原料药配制而得的一种手性药物注射剂。
HPLC测定叶酸片中的叶酸溶出度
HPLC测定叶酸片中的叶酸溶出度
许佳;
【期刊名称】《现代妇女:幸福生活》
【年(卷),期】2015(000)004
【摘要】本次研究采用的是高效液相色谱的方法对叶酸片的溶出度进行测定的,运用小杯方法,在流动相为酸性值是5的磷酸盐溶液中,测定的的速度控制在1.5毫升每分钟。
通过对叶酸片的也算溶出度进行测定,可以看出运用HPLC 的放大对叶酸片的溶出度进行测定,可以实现很好地分离效果,而且能够形成对称的峰形,在测定的时候不会受到干扰。
【总页数】2页(P.287-288)
【关键词】HPLC;叶酸片;叶酸溶出度
【作者】许佳;
【作者单位】安徽省立医院药剂科,安徽合肥230001;
【正文语种】英文
【中图分类】O657.72
【相关文献】
1.HPLC测定叶酸片中的叶酸溶出度 [J], 许佳
2.HPLC法测定叶酸片溶出度 [J], 柳世萍
3.HPLC法测定氯诺昔康分散片的含量含量均匀度及溶出度 [J], 曹薇薇; 王志平
4.HPLC法测定甲磺酸溴隐亭片的含量、含量均匀度及其溶出度[J], 黄剑英; 郑淑凤; 叶飞云
5.安喘片中马来酸氯苯那敏的含量测定及溶出度考察 [J], 陈波。
(10)申请公布号 CN 101863889 A(43)申请公布日 2010.10.20C N 101863889 A*CN101863889A*(21)申请号 200910082212.8(22)申请日 2009.04.20C07D 475/04(2006.01)A61P 7/06(2006.01)A61P 39/02(2006.01)(71)申请人重庆华邦胜凯制药有限公司地址401520 重庆市合川区南津街街道办事处荣军路666号(72)发明人郝光富 邹长忠 蒋世盛(74)专利代理机构北京海虹嘉诚知识产权代理有限公司 11129代理人张涛(54)发明名称左亚叶酸钙的纯化方法(57)摘要左亚叶酸钙的纯化方法,将左亚叶酸钙粗品加入纯化水中,溶解;用酸调PH 至6.0~7.5后,加入乙醇,过滤,滤液中再加入乙醇搅拌后结晶。
用本发明的方法,仅进行一次重结晶,即可达到左亚叶酸钙的欧洲药典标准。
(51)Int.Cl.(19)中华人民共和国国家知识产权局(12)发明专利申请权利要求书 1 页 说明书 3 页权 利 要 求 书CN 101863889 A1/1页1.左亚叶酸钙的纯化方法,步骤如下:①将左亚叶酸钙粗品加入纯化水中,溶解;②用酸调PH至6.0~7.5后,加入乙醇,过滤,收集滤液;③在滤液中再加入乙醇搅拌后,放置结晶。
2.权利要求1所述的左亚叶酸钙的纯化方法,所述左亚叶酸钙粗品与纯化水的用量比为1∶20~32(W/W);所述酸是无机酸;步骤②中乙醇的用量与左亚叶酸钙投料量的比例为4~8∶1(W/W)。
3.权利要求2所述的左亚叶酸钙的纯化方法,所述无机酸是盐酸。
4.权利要求1所述的左亚叶酸钙的纯化方法,步骤③中乙醇的用量与左亚叶酸钙粗品的投料量的比例为30~50∶1(W/W)。
5.权利要求1~5中任一所述的左亚叶酸钙的纯化方法,步骤①还包括加入左亚叶酸钙粗品投料量的5%~20%(W/W)的活性炭。
左亚叶酸钙的纯化方法技术领域:[0001] 本发明涉及左亚叶酸钙的纯化方法。
左亚叶酸钙及其片剂的HPLC测定
张宇佳;郑稳生
【期刊名称】《中国医药工业杂志》
【年(卷),期】2005(36)9
【摘要】建立了HPLC法测定左亚叶酸钙及其片剂含量与有关物质。
采用ODSC18柱,0.05mol/L氯化铵缓冲液(含溴化四丁铵3.22g,用氨水调至pH7.8)-甲醇-乙腈(18∶2∶3)为流动相,检测波长287nm。
线性范围0.01~0.1mg/ml,检测限1ng。
平均回收率99.6%,RSD0.47%。
【总页数】2页(P568-569)
【关键词】左亚叶酸钙;片剂;有关物质;高效液相色谱;测定
【作者】张宇佳;郑稳生
【作者单位】中国医学科学院中国协和医科大学药物研究所
【正文语种】中文
【中图分类】TQ460.72;O657.72
【相关文献】
1.HPLC法测定左亚叶酸钙中的右旋异构体△ [J], 刘凤丽;沈园园
2.高效液相色谱法测定血浆中左亚叶酸钙的含量 [J], 邓富良;陈本美;饶均明;周平;邓世林;陈新;余俊龙
3.HPLC-UV 色谱法检测人血浆中左亚叶酸钙浓度 [J], 罗晨辉;邓富良;李坤艳;陈本美;仇宇;蒋云;林小平
4.HPLC法测定苯丙氨酯原料药及片剂的含量和有关物质 [J], 王昕;王卫;唐素芳
5.流动注射化学发光法快速测定尿液中左亚叶酸钙 [J], 王瑞琪;黄玉明
因版权原因,仅展示原文概要,查看原文内容请购买。
左氟沙星注射液中右旋体含量的HPLC测定
王晓黎
【期刊名称】《中国医药工业杂志》
【年(卷),期】2001(32)6
【摘要】采用配基交换手性添加剂 ,以硫酸铜和 L -异亮氨酸为流动相 ,在 ODS柱上对氧氟沙星对映异构体进行了手性分离。
并对左氟沙星注射液中右旋体的含量测定进行了研究 ,右旋体在 2 .0~18.0μg/ m l的范围内线性良好 ,平均回收率为98.6 % ,RSD=0 .3%
【总页数】2页(P260-261)
【关键词】氧氟沙星;对映体;HPLC;测定
【作者】王晓黎
【作者单位】辽宁省药品检验所
【正文语种】中文
【中图分类】R927.2;R978.1
【相关文献】
1.096用HPLC法测定原料药和制剂中的替马氟沙星、沙拉氟沙星和双氟沙星 [J],
2.高效液相色谱法测定左氟沙星鼻喷剂中左氟沙星、盐酸麻黄碱的含量 [J], 张建兰;郭文萍;白小石
3.HPLC法测定盐酸二氟沙星粉中二氟沙星的含量 [J], 陈晓林;陆春波;陈慧华;林仙
军;包爱情
4.HPLC法测定左氟沙星滴眼液的含量 [J], 杨健;赵震;向仁芝;蔡鸿生
因版权原因,仅展示原文概要,查看原文内容请购买。