通辽一中2015届高二化学作业甲烷041
- 格式:doc
- 大小:154.50 KB
- 文档页数:2
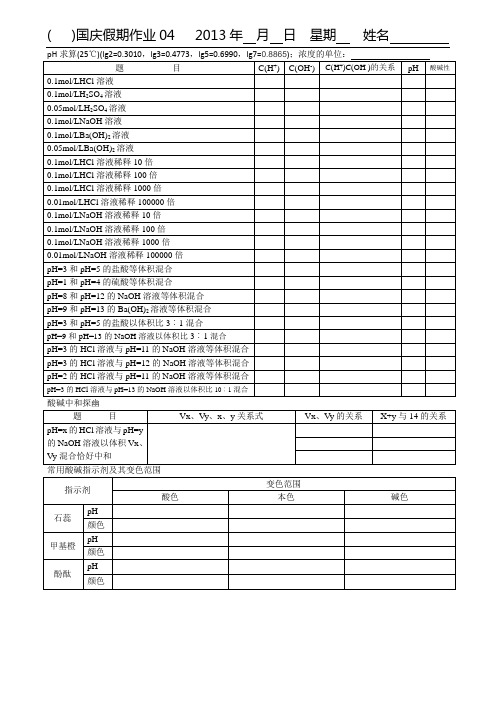
1.在容积一定的密闭容器中,反应2A B(g)+C(g)达到平衡后,升高温度容器内气体的密度增大,则下列叙述正确的是)A.正反应是吸热反应,且A不是气态B.正反应是放热反应,且A是气态C.其他条件不变,加入少量C,物质A的转化率增大D.改变压强对该平衡的移动无影响2.下图表示反应X(g)4Y(g)+Z(g)ΔH<0,在某温度时X的浓度随时间变化的曲线:下列有关该反应的描述正确的是()A.第6min后,反应就终止了B.X的平衡转化率为85%C.若升高温度,X的平衡转化率将大于85%D.若降低温度,v正和v逆将以同样倍数减小3.在如图所示的三个容积相同的容器①②③中进行如下反应:3A(g)+B(g)2C(g)ΔH<0,若起始温度相同,分别向三个容器中通入3molA和1molB,则达到平衡时各容器中C物质的体积分数由大到小的顺序为()A.③②①B.③①②C.①②③ D.②①③4.对已达化学平衡的下列反应2X(g)+Y(g)2Z(g),减小压强时,对反应产生的影响是()A.逆反应速率增大,正反应速率减小,平衡向逆反应方向移动B.逆反应速率减小,正反应速率增大,平衡向正反应方向移动C.正、逆反应速率都减小,平衡向逆反应方向移动D.正、逆反应速率都增大,平衡向正反应方向移动5.在一体积可变的密闭容器中,加入一定量的X、Y,发生反应m X(g)n Y(g);ΔH=Q kJ/mol。
反应达到平衡时,Y的物下列说法正确的是(C.温度不变,压强增大,Y的质量分数减少D.体积不变,温度升高,平衡向逆反应方向移动6.可逆反应:A2(?)+B2(?)2AB(?),当温度和压强改变时,n(AB)的变化如下图,下列叙述正确的是()A.A2、B2及AB均为气体,ΔH<0B.AB为气体,A2、B2至少有一种为非气体,ΔH<0C.AB为气体,A2、B2有一种为非气体,ΔH>0D.AB为固体,A2、B2有一种为非气体,ΔH>0(g)B(g)的关系如图所示,有关叙述正确的是()①n<q②n>q③X点,v正>v逆;Y点,v正<v逆④X点比Y点反应速率快A.①③B.①④C.②③D.②④9.可逆反应3A(g)3B(?)+C(?)ΔH<0达到化学平衡后,升高温度,用“变大”、“变小”、“不变”或“无法确定”填空。

1.下列说法正确的是( )A .放热反应的焓变小于零,熵变大于零B .放热及熵增加的反应,一定能自发进行C .放热反应的焓变大于零,熵变小于零D .放热及熵减小的反应,一定能自发进行2.已知100 kPa 、298.15 K 时氢氟酸的电离过程:HF(aq)= H +(aq)+F -(aq) ΔH =-12.5 kJ·mol -1ΔS =-102.5J·mol -1·K -1。
试判断该过程的自发性( )A .可自发进行B .不能自发进行C .达到平衡D .不能判定3.考察下述自然界的一些自发变化,可发现它们有一些共同的特点。
下列说法不.正确的是( )A .都有一定的方向性,按某一物理量标度由高到低自发进行B .都可以用来做功,自发过程一旦发生后体系做功的本领就会降低C .有一定的进行限度,自发过程总是单向地趋向于非平衡状态D .有一定的数据差来判断自发变化能否发生4.已知反应CO(g)= C(s)+12O 2(g)的ΔH 为正值,ΔS 为负值。
设ΔH 与ΔS 不随温度而变,下列说法中正确的是( )A .低温下是自发变化B .高温下是自发变化C .低温下是非自发变化,高温下是自发变化D .任何温度下都是非自发变化5.(1)化学反应2NO(g) +2CO(g)= N 2(g)+2CO 2 (g),在298 K 、100 kPa 下:ΔH =-113.0 kJ/mol, ΔS =-145.3 J/(mol·K),反应在常温下________(填“能”或“不能”)自发进行。
(2)求反应2HCl(g)= H 2(g)+Cl 2(g)标准熵变。
已知:HCl(g)的S =+186.6 J/(mol·K),H 2(g)的S =+130 J/(mol·K),Cl 2(g)的S =+223 J/(mol·K),ΔS =________。
6.对于化学反应能否自发进行,下列说法中错误的是( )A .若ΔH <0,ΔS <0低温时可自发进行B .若ΔH >0,ΔS >0低温时可自发进行C .若ΔH >0,ΔS <0任何温度下都不能自发进行D .若ΔH <0,ΔS >0任何温度下都能自发进行7.碳铵是重要的农用肥料,在冬季及早春等季节使用较好。

1.判断正误。
(1)甲烷是含氢元素的百分含量最大的有机化合物( )(2)乙烯的产量是衡量一个国家石油化工工业发展水平的标志( )(3)乙烯中所有原子都在一个平面上,丙烯也如此( )(4)乙烯和乙烷都能发生加聚反应( )(5)乙烯和苯都能使溴水褪色,褪色的原因相同( )(6)乙烷和丙烯的物质的量共1 mol ,完全燃烧生成3 mol H 2O( )(7)制备CH 3CH 2Cl 通常用乙烯和氯化氢,而不用乙烷和氯气( )(8)丙烷分子的比例模型示意图为( )(9)有机物中,碳与碳之间只能形成碳碳单键、碳碳双键和碳碳三键( )(10)溴水和酸性KMnO 4溶液都可鉴别己烷和苯( )(11)石油和天然气的主要成分都是碳氢化合物( )(12)水煤气是通过煤的液化得到的气体燃料( ) (13)石油的分馏、裂化、裂解都为化学变化( )(14)煤油可由石油分馏获得,可用作燃料和保存少量金属钠( )(15)石油的裂解和油脂皂化都是由高分子生成小分子的过程( )2.下列关于有机物说法正确的是( )A .甲烷、乙烯和苯在工业上都可以通过石油分馏得到B .苯和乙烯都可使溴的四氯化碳溶液褪色C .甲烷、乙烯、乙醇都可发生氧化反应D .汽油、柴油属于烃,植物油属于高分子化合物3.下列说法中错误的是( )A .无论乙烯与Br 2的加成,还是乙烯使酸性KMnO 4溶液褪色,都与分子内含有碳碳双键有关B .用溴的四氯化碳溶液或酸性KMnO 4溶液都可以鉴别乙烯和乙烷C .相同质量的乙烯和甲烷完全燃烧后产生的水的质量相同D .乙烯的化学性质比乙烷的化学性质活泼4.下列有关苯的叙述正确的是( )A .邻二氯苯的结构有两种B .苯不能使酸性KMnO 4溶液褪色,因此苯不能发生氧化反应C .7.8 g 苯和苯乙烯(CHCH 2)的混合物中含碳原子的数目为0.6N AD .用苯萃取溴水中的溴时,溴的苯溶液从分液漏斗的下口流出5.某气态烃1体积只能与1体积氯气发生加成反应,生成氯代烷,此氯代烷1 mol 可与4 mol 氯气发生完全的取代反应,则该烃的结构简式为( )A .CH 3CH=CH 2B .CH 2=CH 2C .CH 3CH 3D .CH 2=CHCH=CH 26.下列叙述不正确...的是( ) A .除去甲烷中混有的乙烯可以将混合气体通过盛有酸性高锰酸钾溶液的洗气瓶B .等质量的乙烯和聚乙烯完全燃烧消耗氧气的物质的量相同C .同分异构现象是有机物种类繁多的原因之一D .乙醇和乙酸反应生成酯和酯的水解反应都属于取代反应7.下列反应中,属于取代反应的是( )①CH 3CH=CH 2+Br 2――→CCl 4CH 3CHBrCH 2Br ②CH 3CH 2OH ――→浓H 2SO 4△CH 2=CH 2+H 2O ③CH 3COOH +CH 3CH 2OH ――→浓H 2SO 4△CH 3COOCH 2CH 3+H 2O ④C 6H 6+HNO 3――→浓H 2SO 4△C 6H 5NO 2+H 2O A .①② B .③④ C .①③D .②④8.下列实验能获得成功的是( )A .用溴水鉴别苯、CCl 4、苯乙烯B .加浓溴水,然后过滤可除去苯中少量的己烯C .苯、溴水、铁粉混合制溴苯D .可用分液漏斗分离二溴乙烷和二甲苯9.进行一氯取代反应后,只能生成3种沸点不同的有机产物的烷烃是( )A .(CH 3)2CHCH 2CH 2CH 3B .(CH 3CH 2)2CHCH 3C .(CH 3)2CHCH (CH 3)2D .(CH 3)3CCH 2CH 310.为了证明液溴与苯发生的反应是取代反应,有如图所示装置。

1.下列关于化学反应的熵变的叙述正确的是()A.化学反应的熵变与反应的方向无关B.化学反应的熵变直接决定了反应的方向C.熵值增大的反应都是混乱度增大的反应D.熵值增大的反应都能自发进行2.能用焓判据判断下列过程方向的是()A.湿的衣服经过晾晒变干B.硝酸铵溶于水C.100 ℃时的水蒸气凝结成水D.25 ℃、101 kPa 时,2N2O5(g)= 4NO2(g)+O2(g)ΔH=+56.7 kJ/mol能自发进行3.“熵”与“焓”是化学热力学中两个重要的参数,是判断化学反应进行程度和方向的两个重要判据,若熵增大、焓减小则反应可以在任何情况下自发进行,下列问题不.能用“熵”和“焓”解释的是() A.蛋白质胶体加热发生凝聚B.一般情况下,升高温度,固体物质的溶解度增大,气体物质的溶解度减小C.(NH4)2Cr2O7在一定条件下发生反应:(NH4)2Cr2O7=Cr2O3+N2+4H2OΔH<0,该反应无逆反应D.水解反应是中和反应的逆反应,加热可以促进水解4.25 ℃和1.01×105 Pa时,反应2N2O5(g)=4NO2(g)+O2(g)ΔH=+56.76 kJ·mol-1,自发进行的原因是) A.是吸热反应B.是放热反应C.是熵减小的反应D.熵增大效应大于能量效应的反应5.下列说法不.正确的是(双选)()A.体系有序性越高,熵值就越低B.自发过程将导致体系的熵增大C.吸热反应不可以自发进行D.同种物质气态时熵值最大6.往平底烧瓶中放入氢氧化钡晶体[Ba(OH)2·8H2O]和固态氯化铵晶体,塞紧瓶塞。
在瓶底和木板间滴少量水,如图所示。
一会儿,就会发现瓶内固态物质变稀并有液体产生,瓶壁变冷,小木板上因少量水冻结而被烧瓶黏住,这时打开瓶塞,出来的气体有氨味。
这是自发地发生了反应:Ba(OH)2·8H2O(s)+2NH4Cl(s)= BaCl2(s)+2NH3(g)+10H2O(l) 下列结论正确的是()A.自发反应一定是放热反应B.自发反应一定是吸热反应C.有的吸热反应也能自发进行D.吸热反应不能自发进行7.已知在等温条件下,化学反应方向的判据为:ΔH-TΔS<0,反应能正向自发进行;ΔH-TΔS=0,反应达平衡状态;ΔH-TΔS>0,反应能逆向自发进行。
一.基础知识点 1.(1)烯烃是指分子中含有_________的链烃。
最简单的烯烃的分子式是_________结构式是_________,结构简式是_________,电子式是_________。
(2)从乙烯分子的球棍模型或比例模型可以看出:乙烯分子呈_________结构,若乙烯分子每个碳原子与碳原子或氢原子形成的化学键之间的夹角均相等,则其夹角为_________。
(3)乙烯分子在_________反应和_________反应中,分子内的碳碳双键有一个发生断裂;而在_________反应中,乙烯分子中的碳碳双键全部断裂。
2.(1)若烯烃分子中含有n 个碳原子和1个碳碳双键,其分子式为_________;若烯烃分子中含有n 个碳原子和2个碳碳双键,其分子式为_________;若烯烃分子中含有n 个碳原子和m 个碳碳双键,其分子式为_________。
(2)烯烃的物理性质随着碳原子数目的增加而递变:一般地,碳原子数越多,沸点依次_________,液态时的密度依次_________。
二.选择题1、通常用来衡量一个国家石油化工发展水平的标志是( )(A)石油的产量 (B)乙烯的产量 (C)塑料的产量 (D)合成纤维的产量 2、对比甲烷和乙烯的燃烧反应,下列叙述中正确的是( ) (A )二者燃烧时现象完全相同 (B )点燃前都不需验纯(C )甲烷燃烧的火焰呈淡蓝色,乙烯燃烧的火焰较明亮(D )二者燃烧时都有黑烟生成 3.下列物质中,一定属于不饱和烃的是( )。
A .42H C B .64H C C .63H C D .125H C 4.下列方法中,不可以用来鉴别甲烷和乙烯的方法是()。
A .通入足量溴水中B .分别进行燃烧C .通入高锰酸钾溶液中D .在一定条件下通入氢气 5.点燃乙烯可以观察到的实验现象是( )。
A .火焰呈蓝色,产生大量白雾B .火焰明亮,伴有黑烟C .火焰呈苍白色,产生有刺激性气味的气体D .火焰呈红色,伴有浓烈黑烟 6.下列关于乙烯用途的叙述中,错误的是( )。
1.下列有机物中,不属于烃的衍生物的是()2.现代家居装修材料中,普遍存在着甲醛、苯及苯的同系物等有毒物质,如果不注意处理就会对人体产生极大的危害。
按照有机物的分类,甲醛属于醛。
下面各项对有机物的分类方法与此方法相同的是()A.①②B.②③C.②④D.①④3.某烯烃的结构简式为:,其命名正确的是()A.2甲基-5-乙基-3,5己二烯B.2乙基-1,3己二烯C.6甲基-3,4庚二烯D.5甲基-2-乙基-1,3己二烯4.某有机化合物的结构简式如下:此有机化合物属于()①烯烃②多官能团有机化合物③芳香烃④烃的衍生物⑤高分子化合物A.①②③④B.②④C.②④⑤D.①③⑤5.对复杂的有机物的结构,可以用“键线式”简化表示,与键线6.已知下列两个结构简式:CH3—CH3和CH3—,两式中均有短线“—”,这两条短线所表示的意义是()A.都表示一对共用电子对B.都表示一个共价单键C.前者表示一对共用电子对,后者表示一个未成对电子D.前者表示分子内只有一个共价单键,后者表示该基团内无共价单键7.将下列液体分别与溴水混合并振荡,静置后分为两层,溴水层几乎呈无色的是()A.氯水B.乙烯C.乙醇D.碘化钾溶液8.某烷烃的相对分子质量为86,与氯气反应生成的一氯代物只有两种,其结构简式是() A.CH3(CH2)4CH3B.(CH3)2CHCH(CH3)2 C.(C2H5)2CHCH3D.C2H5C(CH3)39.下列哪个选项属于碳链异构()A.CH3CH2CH2CH3和CH3CH(CH3)2 B.CH2=C(CH3)2和CH3CH=CHCH3C.CH3CH2OH和CH3OCH3 D.CH3CH2CH2COOH和CH3COOCH2CH310.有机物A和B只由C、H、O中的两种或三种元素组成,等物质的量的A和B完全燃烧时,消耗相等物质的量的氧气,则A和B的相对分子质量的差值(其中n为正整数)不可能为() A.0 B.14n C.18n D.44n11.有一种AB2C2型分子,在该分子中以A为中心原子。
1.分别取下列溶液各2 mL ,用水稀释到20 mL ,溶液的pH 由3.0变成4.0,则该溶液是( ) (a)一元强酸 (b)二元弱酸(c)一元弱碱 (d)二元强酸 A .(a) B .(b) C .(a)(c) D .(a)(d)2.常温下,某溶液中由水电离产生的c (H +)=1×10-11 mol·L -1,则该溶液的pH 可能是(双选)( ) A .3 B .7 C .8 D .113.下列物质中,加入10 mL HCl 溶液时,其pH 不.会改变的是( ) A .20 mL 同一浓度的HCl 溶液 B .20 mL NH 4Cl 溶液 C .10 mL 水 D .10 mL 稀NaOH 溶液 4.室温下将pH =4的弱酸溶液与pH =10的NaOH 溶液等体积混合后,溶液的pH( ) A .等于7 B .大于7 C .小于7 D .无法确定5.25 ℃时,向纯水中加入NaOH ,使溶液的pH 为11,则由NaOH 电离出的OH -浓度与水电离出的OH -浓度之比为( )A .1010∶1B .(5×109)∶1C .108∶1D .1∶1 6.下列叙述正确的是( )A .95 ℃时纯水的pH <7,说明加热可导致水呈酸性B .pH =3的醋酸溶液,稀释至10倍后pH =4C .0.2 mol/L 的盐酸与等体积水混合后pH =1D .pH =3的醋酸溶液与pH =11的氢氧化钠溶液等体积混合后pH =77.在一定体积pH =12的Ba(OH)2溶液中逐滴加入一定物质的量浓度的NaHSO 4溶液,当溶液中的Ba 2+恰好完全沉淀时,溶液pH =11。
若反应后溶液的体积等于Ba(OH)2溶液与NaHSO 4溶液的体积之和,则Ba(OH)2溶液与NaHSO 4溶液的体积比是( )A .1∶9B .1∶1C .1∶2D .1∶48.已知NaHSO 4在水中的电离方程式为:NaHSO 4Na ++H ++SO 2-4。
1.下列分子中所有原子都在同一平面的是()A.甲烷B.乙烯C.丙烯(CH3—CH=CH2) D.苯2.关于苯分子结构的下列说法中正确的是()A.苯分子中含有三个和三个C—C键,且交替连接B.苯分子为正六边形,每个氢原子垂直于碳原子所在的平面C.苯环上的碳碳键是一种介于碳碳单键和碳碳双键之间的独特的键D.苯分子里六个C—H键完全相同3.下列关于苯的性质的叙述中,不正确的是()A.苯是无色带有特殊气味的液体B.常温下苯是一种不溶于水且密度小于水的液体C.苯在一定条件下能与溴发生取代反应D.苯不具有典型的双键所具有的加成反应的性能,故不可能发生加成反应4.下列物质与溴水混合充分振荡,静置后上层液体呈橙红色,下层液体无色的是()A.碘化钾溶液B.苯C.四氯化碳D.己烯5.将苯分子中的一个碳原子换成一个氮原子,得到一种类似苯环结构的稳定有机物,此有机物的相对分子质量为()A.78 B.79 C.80 D.816.下列关于苯的叙述正确的是()A.苯的分子式为C6H6,它不能使酸性KMnO4溶液褪色,属于饱和烃B.从苯的凯库勒式()看,苯分子中含有碳碳双键,应属于烯烃C.在催化剂作用下,苯与液溴反应生成溴苯,发生了加成反应D.苯分子为平面正六边形结构,6个碳原子之间的价键完全相同7.中学实验室用如图所示装置制取少量溴苯。
请填写下列空白。
(1)在烧瓶a中装的试剂是苯、溴和铁屑。
导管b的作用有两个:一是导气,二是兼起____________的作用。
(2)反应过程中在导管c的下口附近可以观察到白雾出现,这是由于反应生成的________遇水蒸气而形成的。
(3)反应完毕后,向锥形瓶d中滴入AgNO3溶液,有________生成。
(4)反应完毕后,将烧瓶a中的液体倒入盛有冷水的烧杯里,可以观察到烧杯底部有________色不溶于水的液体。
这是溶解了________的粗溴苯。
(5)写出烧瓶a中发生反应的化学方程式:_____________________________________________________。
1.如下图所示均能表示甲烷的分子结构,哪一种更能反映其真实存在状况()
A.ⅠB.ⅡC.ⅢD.Ⅳ
2.人类已知的化合物种类最多的是()
A.第ⅠA族元素的化合物B.第ⅢA族元素的化合物
C.第ⅣA族元素的化合物D.第ⅦA族元素的化合物
3.能够证明甲烷分子的空间结构为正四面体的事实是()
A.甲烷的4个碳氢键的键能相等B.甲烷的4个碳氢键的键长相等
C.甲烷的一氯代物只有1种D.甲烷的二氯代物只有1种
4.下列物质常温下呈气态的是()
A.CH3Cl B.CH2Cl2 C.CHCl3D.CCl4
5.若甲烷与氯气以物质的量之比1︰1混合,在光照下得到的取代产物是()
①CH3Cl②CH2Cl2③CHCl3④CCl4
A.只有①B.只有③C.①②③的混合物D.①②③④的混合物
6.三个装有CH4和Cl2混合气体的集气瓶,用玻璃片盖好瓶口后,分别作如下处理,各有怎样的现象发生?
(1)①置于黑暗中:_________________________________;
②将点燃的镁条靠近集气瓶外壁:_____________________;
③放在有光线的房子里:_____________________________。
(2)CH4和Cl2发生的一系列反应都是________(填反应类型)反应,请写出CH4和Cl2反应生成一氯甲烷的化学方程式:_________________________________________________。
(3)若要使0.5 mol CH4完全和Cl2发生取代反应,并生成相同物质的量的四种取代产物,则需要Cl2的物质的量为()
A.2.5 mol B.2 mol C.1.25 mol D.0.5 mol
7.有3 mL甲烷和一氧化碳的混合气体,完全燃烧恰好用去了3 mL氧气,则此混合气体中甲烷和一氧化碳的体积比是多少?
8.如图所示,U形管的左端被水和胶塞封闭有甲烷和氯气(体积比为1:4)的混合
气体,假定氯气在水中的溶解度可以忽略。
将封闭有甲烷和氯气的混合气体的装置
放置在有光亮的地方,让混合气体缓慢地反应一段时间。
(1)假设甲烷与氯气反应充分,且只产生一种有机物,请写出化学方程式:
_________________________________________________。
(2)经过几个小时的反应后,U型管右端的玻璃管中水柱的变化是()
A.升高B.降低C.不变D.无法确定
(3)已知CH4分子在空间呈四面体形状,1个C原子与4个H原子各共用一对电子形
成4条共价键,C原子位于中心,4个H原子位于4个顶点。
如图所示为一个立方
体,已画出1个C原子(在立方体中心)、1个H原子(在立方体顶点)和1条共价键(实
线表示)。
请画出另外3个H原子的合适位置和3条共价键。
1.答案:D
点拨:第Ⅳ种情况既能表示出甲烷的空间构型,又能表示出分子中C、H原子的相对大小,和甲烷分子的真实结构最接近,故选D。
2.答案:C
点拨:种类最多的化合物是含碳化合物,碳位于元素周期表第ⅣA族。
3.答案:D
点拨:先把CH4分子空间构型的几种可能性画出来,然后依次思考排列可得到答案。
4.答案:A
点拨:CH4的四种氯代产物在常温下,只有CH3Cl是气体,其它3种都是液体。
5.答案:D
点拨:甲烷和氯气在光照下发生的四步取代反应是连锁反应,反应进行到哪一步不是由反应物甲烷和氯气的物质的量之比来决定的。
即使是甲烷和氯气的物质的量之比是1︰1的情况,也不会仅发生CH4+
Cl2CH3Cl+HCl这样一种取代反应,因为一旦生成CH3Cl后,CH3Cl分子中的氢原子又可继续被氯原子取代,因此其产物不是纯净的CH3Cl,而是四种取代产物的混合物。
有机化学反应比较复杂,它不像无机反应那样,只要有反应物的化学计量数便可确定生成物的种类和数量。
6.答案:(1)①无明显现象②爆炸③黄绿色逐渐变浅,有油状液滴生成
(2)取代CH4+Cl2CH3Cl+HCl(3)C
点拨:对于有机反应,反应条件非常重要,通过控制反应条件,可使CH4和Cl2的取代反应发生的现象不同。
0.5 mol CH4生成等物质的量的4种取代产物,即0.125 mol CH3Cl、0.125 mol CH2Cl2、0.125 mol CHCl3、0.125 mol CCl4,则所需n(Cl2)=0.125 mol×1+0.125 mol×2+0.125 mol×3+0.125 mol×4=1.25 mol,故选C项。
7.答案:1∶2
点拨:CH4+2O2―→CO2+2H2O,2CO+O2=2CO2,假设甲烷的体积为x,一氧化碳的体积为y,则分别消耗的氧气的物质的量为2x、0.5y,故有:x+y=3 mL,2x+0.5y=3 mL,解得2x=y。
所以此混合气体中甲烷和一氧化碳的体积比为1:2。
8.答案:(1)CH4+4Cl2CCl4+4HCl(2)B
(3)。