《章末整合提升》元素与物质世界
- 格式:pptx
- 大小:1.21 MB
- 文档页数:31

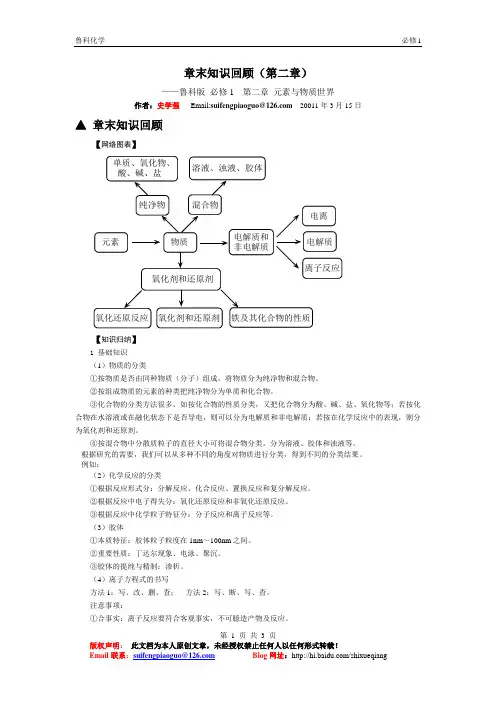
章末知识回顾(第二章)——鲁科版必修1 第二章元素与物质世界作者:史学强Email:suifengpiaoguo@20011年3月15日▲章末知识回顾【网络图表】【知识归纳】1 基础知识(1)物质的分类①按物质是否由同种物质(分子)组成,将物质分为纯净物和混合物。
②按组成物质的元素的种类把纯净物分为单质和化合物。
③化合物的分类方法很多,如按化合物的性质分类,又把化合物分为酸、碱、盐、氧化物等;若按化合物在水溶液或在融化状态下是否导电,则可以分为电解质和非电解质;若按在化学反应中的表现,则分为氧化剂和还原剂。
④按混合物中分散质粒子的直径大小可将混合物分类,分为溶液、胶体和浊液等。
根据研究的需要,我们可以从多种不同的角度对物质进行分类,得到不同的分类结果。
例如:(2)化学反应的分类①根据反应形式分:分解反应、化合反应、置换反应和复分解反应。
②根据反应中电子得失分:氧化还原反应和非氧化还原反应。
③根据反应中化学粒子特征分:分子反应和离子反应等。
(3)胶体①本质特征:胶体粒子粒度在1nm~100nm之间。
②重要性质:丁达尔现象、电泳、聚沉。
③胶体的提纯与精制:渗析。
(4)离子方程式的书写方法1:写、改、删、查;方法2:写、断、写、查。
注意事项:①合事实:离子反应要符合客观事实,不可臆造产物及反应。
第 1 页共3 页版权声明:此文档为本人原创文章,未经授权禁止任何人以任何形式转载!Email联系:suifengpiaoguo@ Blog网址:/shixueqiang版权声明 Email②式正确:化学式与离子符号使用正确合理。
③号实际:“↑”“↓”等符号符合实际。
④两守恒:两边原子数、电荷数必须守恒(氧化还原反应离子方程式中氧化剂得电子总数与还原剂失电子总数要相等)。
⑤明类型:依据离子反应原理,分清类型,总结方法技巧。
⑥检查细:结合书写离子方程式过程中易出现的错误,细心检查。
(5)氧化还原反应:①特征:化合价升降;②实质:电子的转移。

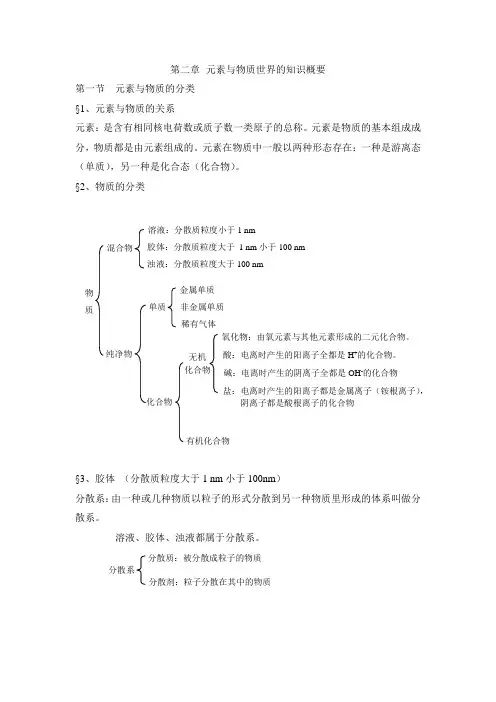
第二章 元素与物质世界的知识概要第一节 元素与物质的分类§1、元素与物质的关系元素:是含有相同核电荷数或质子数一类原子的总称。
元素是物质的基本组成成分,物质都是由元素组成的。
元素在物质中一般以两种形态存在:一种是游离态(单质),另一种是化合态(化合物)。
§2、物质的分类§3、胶体 (分散质粒度大于1 nm 小于100nm )分散系:由一种或几种物质以粒子的形式分散到另一种物质里形成的体系叫做分散系。
溶液、胶体、浊液都属于分散系。
物 质 混合物 溶液:分散质粒度小于1 nm 胶体:分散质粒度大于 1 nm 小于100 nm 浊液:分散质粒度大于100 nm 纯净物 单质 金属单质 非金属单质 稀有气体 化合物 有机化合物 无机 化合物 氧化物:由氧元素与其他元素形成的二元化合物。
酸:电离时产生的阳离子全都是H +的化合物。
碱:电离时产生的阴离子全都是OH -的化合物 盐:电离时产生的阳离子都是金属离子(铵根离子), 阴离子都是酸根离子的化合物 分散系 分散质:被分散成粒子的物质分散剂:粒子分散在其中的物质第二节电解质一、电解质注意:电解质是本身在溶于水或熔融状态能导电,有些物质虽然溶于水后也能导电,但是已于水发生了化学反应。
如:CO2、SO2、NH3等溶于水后形成H2CO3、H2SO3、NH3·H2O,虽然能导电,但并不是CO2、SO2、NH3本身能导电。
二、电解质的电离电离:溶解于水或受热熔化时,离解成能够自由移动的离子的过程称为电离。
电离可用电离方程式表示:(书写电离方程式时注意事项)Na2SO4===2Na+ + SO42-1、左边是化学式,右边为离子式。
2、满足质量守恒与电荷守恒。
3、有原子团的不能拆离4、完全电离的物质用“==”连接。


章末回顾排查专练(二)排查一、常考易错离子方程式再强化1.CuSO 4溶液与过量Ba(OH)2反应:Cu 2++SO 2-4+Ba 2++2OH -===Cu(OH)2↓+BaSO 4↓。
2.碳酸氢铵溶液和过量NaOH 溶液反应:NH +4+HCO -3+2OH -===NH 3·H 2O +CO 2-3+H 2O 。
3.向AgCl 悬浊液中滴加Na 2S 溶液:2AgCl(s)+S 2-(aq)Ag 2S(s)+2Cl -(aq)。
4.向NaHCO 3溶液中加入过量澄清石灰水:HCO -3+Ca 2++OH -===CaCO 3↓+H 2O 。
5.Al 2(SO 4)3溶液中加入过量氨水:Al 3++3NH 3·H 2O===Al(OH)3↓+3NH +4。
6.向NH 4HCO 3溶液中加少量NaOH 溶液并加热:HCO -3+OH -=====△CO 2-3+H 2O 。
7.将过量SO 2气体通入冷氨水中:SO 2+NH 3·H 2O===HSO -3+NH +4。
8.硅酸钠溶液与醋酸溶液混合: SiO 2-3+2CH 3COOH===H 2SiO 3↓+2CH 3COO -。
9.0.01 mol·L -1 NH 4Al(SO 4)2溶液与0.02 mol·L -1 Ba(OH)2溶液等体积混合: NH +4+Al 3++2SO 2-4+2Ba 2++4OH -===2BaSO 4↓+Al(OH)3↓+NH 3·H 2O 。
10.醋酸溶液与水垢中的CaCO 3反应:2CH 3COOH +CaCO 3===Ca 2++2CH 3COO -+H 2O +CO 2↑。
11.向Na[Al(OH)4]溶液中通入过量CO 2:[Al(OH)4]-+CO 2===Al(OH)3↓+HCO -3。
12.用Na 2S 去除废水中的Hg 2+:S 2-+Hg 2+===HgS ↓。

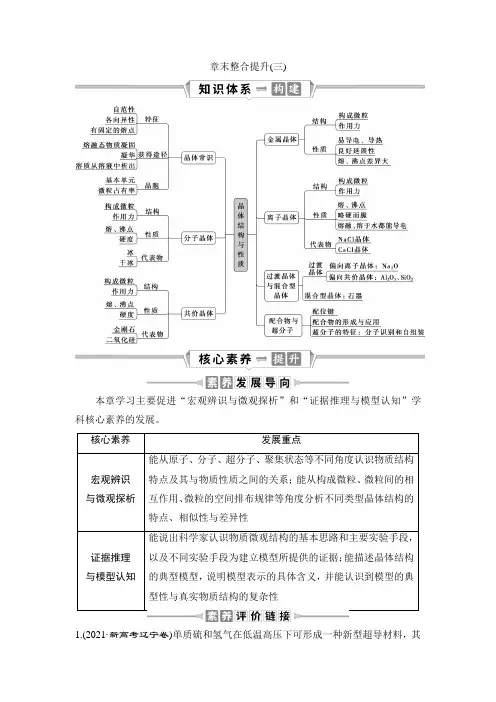
章末整合提升(三)本章学习主要促进“宏观辨识与微观探析”和“证据推理与模型认知”学科核心素养的发展。
核心素养发展重点宏观辨识与微观探析能从原子、分子、超分子、聚集状态等不同角度认识物质结构特点及其与物质性质之间的关系;能从构成微粒、微粒间的相互作用、微粒的空间排布规律等角度分析不同类型晶体结构的特点、相似性与差异性证据推理与模型认知能说出科学家认识物质微观结构的基本思路和主要实验手段,以及不同实验手段为建立模型所提供的证据;能描述晶体结构的典型模型,说明模型表示的具体含义,并能认识到模型的典型性与真实物质结构的复杂性1.(2021·新高考辽宁卷)单质硫和氢气在低温高压下可形成一种新型超导材料,其晶胞如图。
下列说法错误的是()A.S位于元素周期表p区B.该物质的化学式为H3SC.S位于H构成的八面体空隙中D.该晶体属于分子晶体解析:选D。
A.S原子的价层电子排布式为3s23p4,故S位于元素周期表p区,A正确;B.由该物质形成晶体的晶胞可知,S原子个数为8×18+1=2,H原子个数为12×14+6×12=6,故H、S原子个数比为3∶1,故该物质的化学式为H3S,B正确;C.S位于H构成的八面体空隙中,如图所示,C正确;D.由于该晶体是一种新型超导材料,说明其是由阴、阳离子构成的,故该晶体属于离子晶体,D错误。
2. (2021·新高考湖北卷)某立方晶系的锑钾(Sb-K)合金可作为钾离子电池的电极材料,图a为该合金的晶胞结构图,图b表示晶胞的一部分。
下列说法正确的是()A.该晶胞的体积为a3×10-36 cm3B.K和Sb原子数之比为3∶1C.与Sb最邻近的K原子数为4D.K和Sb之间的最短距离为12a pm解析:选B。
A.该晶胞的边长为a×10-10 cm,故晶胞的体积为(a×10-10 cm)3=a3×10-30cm3,A项错误;B.该晶胞中K的个数为12×14+1+8=12,Sb的个数为8×18+6×12=4,故K和Sb原子数之比为3∶1,B项正确;C.以面心处Sb为研究对象,与Sb最邻近的K原子数为8,C项错误;D.K和Sb的最短距离为晶胞体对角线长度的14,即34a pm,D项错误。