活检钳标准(DOC)
- 格式:doc
- 大小:1.12 MB
- 文档页数:12

内镜一次性使用活检钳的类型和适用范围
标准活检钳:带侧孔的圆形环,获取的组织损伤尽可能小。
适合少量活检取量,减少出血量。
椭圆形活检钳:椭圆杯形,从而能获得较大的活组织样本。
椭圆带针活检钳:椭圆杯形能准确定位,不易打滑,获取较大的组织样本鳄口活检钳:适用于肿瘤等较硬的组织上进行活检。
鳄口侧转式活检钳:可左右侧转90°,用于易滑黏膜上或在硬组织上活组织检查。
【8大产品优点、卖点、特点】
1.活检钳头采用医用不锈钢制成,头部精心打磨,无任何钝角,可通过任意弯曲的腔道,弹簧管绕两圈钳头可正常闭合,不影响正常使用;
2.钳头操作灵活,切口锋利,吻合度好,取样大小适中,阳性检出率高;
3.专利设计的防松脱手柄,上下止点清晰,手感舒适;
4.采用钢性四连杆结构,咬合力更强,具有优良的力学功能,取样时能分切咬取而不是撕裂组织,病人几乎无疼痛感,取样更轻松;
5.外弹簧管超滑塑料涂层包塑,出入钳道阻力变小,有效降低对钳道孔的磨损;
6.鳄齿型钳头咬合力更优秀,同时能够避免取样时打滑,带针设计,适合精准取样和较硬组织块。
7.10万级净化车间生产装配,经严格检测后出厂,产品质量保证,性价比高,适合临床广泛推广使用;
8.无菌包装,启袋即用,无需消毒,杜绝交叉感染,降低医疗事故风险;
9.规格型号:全国临床各临床规格型号都有,满足临床需求。
10.质量要求:美洲、欧洲、亚洲、非洲等多个国家和地区,已经有数千万患者使用,质量保证,放心使用。
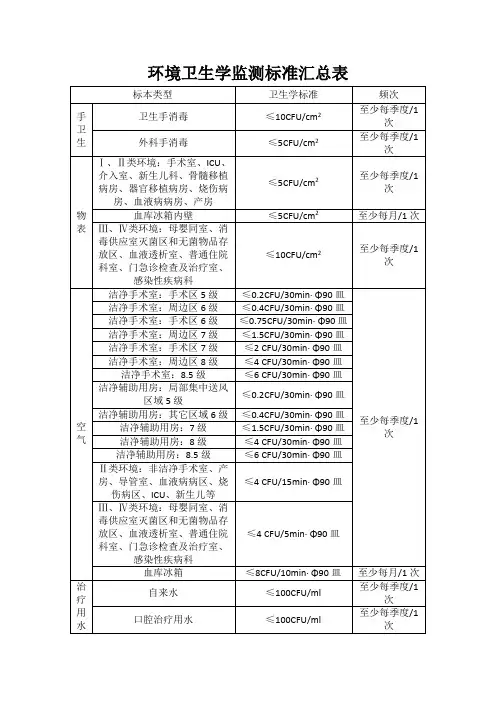
环境卫生学监测标准汇总表
②怀疑医院感染暴发或疑似暴发与医院环境、物品及医务人员手等有关时,应进行目标微生物监测;
③采样后应尽快对样品进行相应指标的检测,送检时间不得超过4h;若样品保存于0℃~4℃时,送检时间不得超过24h;
④不推荐医院常规开展灭菌物品的无菌检查,当流行病学调查怀疑医院感染事件与灭菌物品有关时,进行相应物品的无菌检查。
常规监督检查可不进行致病性微生物检测,涉及疑似医院感染暴发、医院感染暴发调查或工作中怀疑微生物污染时,应进行目标为生物的检测。

医疗器械注册产品标准YZB/ 浙 XXXX-2013 一次性使用活组织取样钳2013-11-1 发布2013-11-1 实施诸暨市鹏天医疗器械有限公司发布前言 ........................................................................................ n1范围 (1)2引用标准 (1)3分类 (1)4要求 (6)5试验方法 (6)6检验规则 (7)7标志、使用说明书 (8)8包装、运输、储存 (9)《一次性使用活组织取样钳》编制说明 (11)经检索,尚无同类产品现行的国家标准或行业标准,特制定本企业注册产品标准。
本标准编写遵循了GB/T 1.1-2009《标准化工作导则第一部分:标准的结构和编写规则》中有关产品标准编写的基本规定。
本标准自2013年11月1日起实施。
本标准由诸暨市鹏天医疗器械有限公司提出。
本标准起草单位:诸暨市鹏天医疗器械有限公司本标准主要起草人:王海江赵海龙雷俊一次性使用活组织取样钳本标准规定了内镜用软管式一次性使用活组织取样钳的分类、要求、试验方法、检验规则、标志、使用说明书、包装、运输及贮存。
本标准适用于通过软性内窥镜钳道钳取活体组织用的一次性使用活组织取样钳(以下简称取样钳)2规范性引用文件下列文件中的条款通过本标准的引用而成为本标准的条款。
凡是注日期的引用文件,其随后所有的修改单(不包括勘误的内容)或修订版均不适用于本标准,然而,鼓励根据本标准达成协议的各方研究是否使用这些文件的最新版本。
凡是不注日期的引用文件,其最新版本适用于本标准。
GB 18279-2000 医疗器械环氧乙烷灭菌确认和常规控制GB/T 2828.1-2003GB/T 2829-2002GB/T 4340.1-2009GB/T 8938-2008GB/T191-2008GB/T16886.1-2011GB/T16886.7-2001GB/T14233.1-2008GB/T14233.2-2005GB/T1220-2007YY/T1076-2004YY/T0149-2006YY/T0294.1-2005YY/T 0466.1-20093 分类3. 1 型号和基本尺寸取样钳的型号和基本尺寸应符合取样钳型号一览表的规定。

临床--消毒灭菌效果监测标准消毒、灭菌效果监测标准一、环境卫生学包括各类环境室内空气、物体表面、医护人员手(医疗机构消毒技术规范WS/T367-2012。
16-18)1、细菌菌落总数卫生标准(沉降法)环境类别范围标准空气物体表面医务人员手cfu/(皿.暴露时间)cfu/cm2cfu/cm2Ⅰ层流洁净手术室、层流病房遵循GB 50333≤5≤5Ⅱ非洁净手术部(室)、非洁净骨髓移植病房、产房、导管室、新生儿室、器官移植病房、烧伤病房、重症监护病房、血液病病区≤4cfu/(φ9cm .15min)≤5≤5Ⅲ儿科病房、母婴同室、人流室、消毒供应室中心(室)、血液透析中心、各类普通病房(治疗室、注射室、换药室)。
≤4cfu/(φ9cm .5 min)≤10Ⅳ普通门(急>诊及其检查、治疗室;感染性疾病科门诊和病区≤4cfu/(φ9cm .5 min)≤10≤10母婴同室、人流室、消毒供应室中心(室)检查打包区及无菌物品储存区≤5儿科病房、妇产科检查室、输血科、血液透析中心、急诊室、化验室、各类普通病房、感染疾病科门诊及其病房≤10二、内镜(内镜清洗消毒技术操作规范2004年版)1、灭菌后的活检钳、内镜(如腹腔镜、关节镜、胆道镜、脑室镜、膀胱镜、胸腔镜等):不得检出任何微生物。
2、消毒后的内镜(如喉镜、气管镜、支气管镜、胃镜、肠镜、乙状结肠镜、直肠镜等):细菌菌落总数应≤20cfu/件,不得检出致病菌。
三、使用中消毒剂和灭菌剂(无菌器械保存液)(医疗机构消毒技术规范WS/T367-2012。
18)1、使用中灭菌剂(无菌器械保存液):无菌生长。
2、使用中皮肤黏膜消毒液染菌量:≤10cfu/ml。
3、其他使用中消毒液染菌量:细菌菌落数应≤100cfu/ml;不得检出致病性微生物。
四、透析液:(血透科)1、透析用水:细菌菌落总数应<200cfu/ml;(血液净化标准操作规程2010版)2、透析器入口液:细菌菌落总数应<200cfu/ml;不得检出致病微生物。

一次性使用内镜用活体取样钳注册技术审查指导原则(2022年)本指导原则是在现行法规和标准体系以及当前认知水平下制定的,随着法规和标准的不断完善,以及科学技术的不断发展,本指导原则相关内容也将进行适时的调整。
一、适用范围本指导原则适用于一次性使用内镜用活体取样钳,配合软式内镜使用,以无菌形式提供,按第二类医疗器械管理,分类编码02-04。
本指导原则不适用于重复使用内镜用活体取样钳以及有源产品,如配合高频手术设备使用的热活检钳。
配合硬性内镜使用一次性使用取样钳未在本指导原则中描述,可部分参考《第二类腹腔镜手术器械产品注册技术审查指导原则》。
二、技术审查要点(一)产品名称要求产品名称应符合《医疗器械通用名称命名规则》(国家食品药品监督管理总局令第19号)的要求,可采用相关国家标准、行业标准上的通用名称,或以产品结构和适用范围为依据命名,例如“一次性使用内镜用活体取样钳”等。
(二)产品的结构和组成产品所用材料主要包括金属和高分子材料,通常由头部、软性导管(可带有包塑层)和手柄组成,头部为一对带钳喙的叶片,可有多种形式,可有定位针。
典型产品外形结构见图1、钳头举例见图2。
图1典型一次性使用内镜用活体取样钳(带包塑层)图2钳头形式分别为带窗平口型、鳄口型、带针型。
(三)产品的工作原理/作用机理一次性使用内镜用活体取样钳通过手柄操作传递、控制头部工作,通过内镜通道(如消化道内镜、呼吸道内镜等)完成活组织取样。
(四)注册单元划分的原则和实例1.医疗器械产品的注册单元以产品的技术原理、结构组成、性能指标和适用范围为划分依据。
2.申报同一注册单元的产品,上市后应采用同一产品名称。
例:一次性使用内镜用活体取样钳与重复使用内镜用活体取样钳建议划分为两个注册单元,配合软式内镜用取样钳与配合硬式内镜用取样钳应划分为两个注册单元。
产品适用及引用的标准应适宜且齐全,在产品技术要求中所引用的相关国家、行业标准应完整并准确。
对所引用的标准中的具体条款,应在产品技术要求中予以实质性采纳,文字表述繁多内容复杂的可以直接引用标准及条文号,比较简单的可直接引述具体内容。

《内镜清洗消毒技术操作规范(2004年版)》卫生部关于印发《内镜清洗消毒技术操作规范(2004年版)》的通知各省、自治区、直辖市XXX,XXX:为进一步加强医疗机构内镜清洗消毒工作,保障医疗质量和医疗安全,我部组织有关专家,在调查研究的基础上制定了《内镜清洗消毒技术操作规范(2004年版)》(以下简称《规范》),现印发给你们,请遵照执行。
为保证《规范》顺利实施,提出以下要求:一、各级各类医疗机构必须高度重视内镜消毒工作,将内镜消毒质量纳入医疗质量和医疗安全管理。
本《规范》实施前,开展内镜诊疗业务的医疗机构必须按照《规范》的要求进行自查和整改工作,建立健全并落实有关内镜消毒的各项规章制度,切实保证消毒质量,严格预防和控制因内镜消毒问题导致的医院感染。
二、加强《规范》的研究和培训工作。
开展内镜诊疗工作的医疗机构,必须认真组织研究和全面贯彻本《规范》,有关的医院感染管理人员、从事内镜诊疗和内镜清洗消毒工作的医务人员应当接受相应培训,正确掌握内镜的清洗和消毒灭菌技术。
三、各级卫生行政部门要加强对医疗机构内镜消毒工作的监督管理,未达到本《规范》要求的医疗机构,不得开展相应的内镜诊疗业务。
附件:内镜洗濯消毒技术操纵标准(2004年版)二○○四年四月一日附件:内镜洗濯消毒技术操纵标准(2004年版)第一章总则第一条为规范医疗机构内镜清洗消毒工作,保障医疗质量和医疗安全,制定本规范。
第二条本规范适用于开展内镜诊疗工作的医疗机构。
第三条开展内镜诊疗工作的医疗机构,应当将内镜的清洗消毒工作纳入医疗质量管理,加强监测和监督。
第四条各级地方卫生行政部门负责辖区内医疗机构内镜洗濯消毒工作的监督管理。
第二章基本请求第五条开展内镜诊疗工作的医疗机构应当制定和完善内镜室管理的各项规章制度,并当真落实。
第六条从事内镜诊疗和内镜清洗消毒工作的医务人员,应当具备内镜清洗消毒方面的知识,接受相关的医院感染管理知识培训,严格遵守有关规章制度。

标准胃镜操作与报告一、标准胃镜操作1、病毒指标及凝血功能的检测:胃镜检查前需检查乙肝两对半、丙型肝炎、HIV、梅毒血清学及肝功能,血常规及凝血功能检查.询问近期是否服用抗凝药或抗血小板药物。
胃镜检查前停药2-3天.2、预约与急诊胃镜的安排:患者持胃镜检查申请单及相关化验单在内镜中心预约,内镜中心安排3-5个工作日内进行胃镜检查.急诊胃镜随时操作或安排在24小时内进行。
内镜中心护士负责解释操作中的注意事项.急诊胃镜操作时患者右侧肢体输液,活动性出血或肝硬化患者治疗时需备血2-4单位。
3、知情同意书的签署:内镜中心护士负责普通胃镜检查患者或家属签署知情同意书,护士无法解释的内容或问题由操作医生解释,急诊胃镜检查由操作医生解释操作中可能出现的危险和并发症,并让患者或家属签署知情同意书。
知情同意书的内容应详细、易懂,且符合法律程序与要求。
4、操作中注意事项的解释:胃镜检查的主要痛苦是恶心呕吐、上浮胀痛,主要危险是出血、穿孔与窒息,术前护士的解释工作对于减少患者的痛苦至关重要,而胃镜操作中医生的细致、轻柔与患者的密切配合是成功的关键。
解释工作包括:(1)胃镜检查的意义:明确诊断及胃镜下相关治疗;(2)胃镜操作的过程:麻醉、解腰带、取假牙、咬合口垫、胃镜经口或鼻进入鼻腔、口咽、喉咽、食管、胃、十二指肠;(3)产生痛苦的原因:心理抗拒、紧张、恐惧、对现代科技的害怕、不会放松、过于敏感、年轻、吸烟、饮酒、返流性食管炎、消化性溃疡;(4)减少痛苦的方法:心理上的接受检查、学会放松、教会深呼吸、理解睡眠状态、暂时禁烟酒、观看好、口垫的结构、检查口垫咬合的力度、解痉剂的使用、静脉麻醉、环境中的轻音乐或选择经鼻胃镜检查亦可减少痛苦;(5)操作中患者与医生的配合:患者全身肌肉松弛、使身体处于睡眠状态,均匀深呼吸,轻轻咬合牙垫使其不致脱落、胃腔充气时胃胀要忍受不要嗳气、胃镜进入球降交接部时深呼吸,坚持—再坚持.(6)操作中医生的注意事项:操作很重用余光观察患者的手是否处于自然放松状态;让患者的好、口张开、检查牙垫是否轻轻咬合口内;检查患者是否均匀深呼吸;充气不要过度,以观察满意为度,操作者动作轻柔贯穿操作全过程.5、标准化胃镜操作:(1)口咽、喉咽表面麻醉5分钟(0。

【最新整理,下载后即可编辑】YZB/浙XXXX-2013【最新整理,下载后即可编辑】YZB/浙杭0084—2003 医疗器械注册产品标准2013-11-1 发布2013-11-1 实施诸暨市鹏天医疗器械有限公司发布【最新整理,下载后即可编辑】目录前言......................................Ⅱ1 范围.....................................12 引用标准...................................13 分类.....................................14 要求.....................................65 试验方法...................................66 检验规则...................................77 标志、使用说明书...............................88 包装、运输、储存...............................9 《一次性使用活组织取样钳》编制说明.......................11前言经检索,尚无同类产品现行的国家标准或行业标准,特制定本企业注册产品标准。
本标准编写遵循了GB/T 1.1-2009《标准化工作导则第一部分:标准的结构和编写规则》中有关产品标准编写的基本规定。
本标准自2013年11月1日起实施。
本标准由诸暨市鹏天医疗器械有限公司提出。
本标准起草单位:诸暨市鹏天医疗器械有限公司本标准主要起草人:王海江赵海龙雷俊一次性使用活组织取样钳1 范围本标准规定了内镜用软管式一次性使用活组织取样钳的分类、要求、试验方法、检验规则、标志、使用说明书、包装、运输及贮存。
本标准适用于通过软性内窥镜钳道钳取活体组织用的一次性使用活组织取样钳(以下简称取样钳)。

第10卷 第4期2019年7月Vol. 10 No. 4Jul. 2019器官移植Organ Transplantation【摘要】 为了进一步规范器官移植病理学临床技术操作,中华医学会器官移植学分会组织器官移植专家和移植病理学专家,从移植心脏心内膜心肌活组织检查的临床操作规范、移植心脏排斥反应的病理学诊断临床技术操作规范、移植心脏的心肌缺血损伤的病理学诊断临床技术操作规范、移植心脏血管病的病理学诊断临床技术操作规范、移植后淋巴组织增生性疾病的病理学诊断临床技术操作规范、移植心脏心内膜心肌活组织检查病理报告的基本内容规范、移植心脏心内膜心肌活组织检查病理学诊断的难点与局限性、移植心脏病理学相关的其它临床技术操作规范等方面,制定器官移植病理学临床技术操作规范(2019版)之移植心脏病理学临床技术操作规范。
【关键词】 移植病理学;器官移植;心脏移植;心内膜心肌活组织检查;排斥反应;心肌缺血损伤;移植心脏血管病;移植后淋巴组织增生性疾病【中图分类号】R617,R36 【文献标志码】A 【文章编号】1674-7445(2019)04-0008-09器官移植病理学临床技术操作规范(2019版)—心脏移植中华医学会器官移植学分会DOI: 10.3969/j.issn.1674-7445.2019.04.008基金项目:国家高技术研究发展计划(“国家863计划”)(2012AA021009);国家卫生和计划生育委员会行业科研专项基金(201302009);中国医学科学院医学与健康科技创新工程(2016-12M-01-015);中国医学科学院中央级公益性科研院所基本科研业务费专项基金(2018PT32018);华中科技大学自主创新基金(01-08-540149)执笔作者单位:100037 北京,中国医学科学院阜外医院(王红月、李莉);华中科技大学同济医学院附属同济医院 器官移植教育部重点实验室 卫健委器官移植重点实验室 中国医学科学院器官移植重点实验室(郭晖)通信作者:郭晖,研究方向为移植病理学基础及临床应用研究,Email :**************本文为移植心脏病理学临床技术操作规范。
活检钳标准一、简介活检钳是一种医疗器械,用于采集组织样本进行病理学检查。
它的设计和材料选择与采集样本的区域和目的有关,可以适用于不同部位和厚度的组织。
本文将介绍活检钳的标准和要求。
二、材料选择1.制作材料应符合医疗器械的相关国家标准,并具备合格的认证文件。
2.活检钳的制作材料应选用不锈钢、镍钛合金等具有优良耐腐蚀性能的材料,以确保其使用寿命和安全性。
三、结构设计1.活检钳应具备人体工程学设计,确保医务人员在使用时的舒适性和操作性。
2.夹持部分的设计应能有效固定组织样本,避免损坏和容易脱落。
3.活检钳应具备可调节的夹持力,以适应不同组织的厚度和硬度。
4.活检钳应具备易于清洁和消毒的设计,以确保无菌操作和防止交叉感染。
四、使用要求1.在进行组织活检前,医务人员应经过相关培训和资质认证,熟悉使用方法和注意事项。
2.活检钳在使用前应经过消毒,并进行必要的检查,确保其无损坏和松动。
3.活检钳应用力均匀,避免过度夹紧组织造成损伤。
4.活检钳使用完毕后应及时清洁和消毒,避免污染和细菌滋生。
五、质量控制1.活检钳的生产厂商应具备相关医疗器械生产资质,并有质量管理体系。
2.活检钳的生产过程应符合医疗器械的相关国家标准,确保产品安全和质量稳定。
3.活检钳应进行严格的出厂检验,确保产品的功能和性能符合要求。
4.活检钳的生产企业应建立完善的售后服务体系,及时处理用户的投诉和需求。
六、使用注意事项1.活检钳在使用过程中,应注意避免碰撞和摔落,以免损坏或影响使用效果。
2.活检钳在使用后应及时清洗和进行必要的消毒,避免交叉感染。
3.活检钳的储存和保养应按照相关规定进行,避免长期受潮和暴晒,影响其使用寿命。
七、结论活检钳作为一种重要的医疗器械,在组织活检中起到至关重要的作用。
它的标准和要求是为了确保其安全性和有效性,保障医患双方的利益。
只有在合格的活检钳的使用下,才能获得准确的诊断结果,并为疾病的治疗和预后提供准确的依据。
因此,严格按照活检钳的标准和要求进行设计、制造和使用,对于医疗质量和患者安全至关重要。
活检钳的使用配合流程及评分标准1. 活检钳的概述活检钳是一种医疗工具,用于进行临床诊断中的活组织检查。
其主要功能是通过取得人体内组织的样本,以便进行病理学分析和疾病诊断。
活检钳通常由不锈钢或钛合金制成,具有一对夹持器和一个手柄。
2. 活检钳的使用流程使用活检钳进行活组织检查需要严格的操作流程,以下是一般的使用流程:2.1 准备工作•清洁活检钳:使用酒精或水清洁活检钳,确保其无污染。
•准备标本容器:准备好合适的标本容器,一般使用带有标签的密封容器。
2.2 麻醉患者•根据需要,在活检区域进行局部麻醉,以减轻患者的疼痛感。
2.3 定位和标记•使用医学影像技术或其他适当的方法确定活检钳应用的位置。
•在确定的位置上使用皮肤标记剂标记活检区域。
2.4 活检操作•使用活检钳的夹持器小心地夹住活检区域的组织。
•施加适量的压力并旋转活检钳,以确保获得足够的组织样本。
•将获得的组织样本放入标本容器。
2.5 清理和处理•将使用过的活检钳放入消毒溶液中,进行必要的清洁和消毒。
•注意正确处置活检废物,以遵守医疗废物管理规定。
2.6 标本处理•将标本容器封好,标记上患者的姓名、日期和活检区域等信息。
•将标本送往实验室进行病理学分析。
3. 活检钳的评分标准为了评估活检钳的使用质量和结果,以下是一些常用的评分标准:3.1 样本质量•完整性:样本是否完整,有无碎片。
•可用性:样本是否足够用于病理学分析。
3.2 操作技术•熟练度:操作者是否具备足够的经验和技术。
•正确性:操作是否符合规范和良好的操作技巧。
3.3 安全性•麻醉效果:麻醉是否足够,患者是否有疼痛感。
•并发症:是否引发并发症,如感染或出血等。
3.4 卫生条件•活检环境:使用活检钳的场所是否干净整洁。
•消毒处理:活检钳是否经过正确的消毒处理。
结论本文介绍了活检钳的使用配合流程及评分标准。
了解和遵守正确的使用流程,以及评估和改善活检钳的使用质量,对于确保活组织检查的准确性和安全性至关重要。
第1篇第一章总则第一条为加强植介入耗材的管理,保障医疗质量和医疗安全,提高医疗服务水平,根据《中华人民共和国医疗器械监督管理条例》、《医疗机构管理条例》等法律法规,结合我国实际情况,制定本规定。
第二条本规定适用于医疗机构中使用的植介入耗材,包括但不限于心脏介入、神经介入、血管介入、骨科植入等领域的耗材。
第三条植介入耗材的管理应当遵循以下原则:(一)依法管理,规范使用;(二)保障医疗质量和医疗安全;(三)提高医疗服务水平;(四)合理配置资源,降低医疗成本;(五)加强监管,强化责任。
第四条各级卫生行政部门负责本行政区域内植介入耗材的监督管理,医疗机构应当建立健全植介入耗材管理制度,落实管理责任。
第二章分类与注册第五条植介入耗材按照医疗器械分类管理,分为第一类、第二类和第三类。
第六条第一类植介入耗材:指通过常规管理足以保证其安全性、有效性的植介入耗材。
第七条第二类植介入耗材:指通过风险管理足以保证其安全性、有效性的植介入耗材。
第八条第三类植介入耗材:指植入人体,用于支持、维持生命,对人体具有潜在危险,对其安全性、有效性必须严格控制的植介入耗材。
第九条植介入耗材的生产、经营企业应当按照国家规定办理注册手续,取得相应的医疗器械注册证书。
第十条植介入耗材的注册应当符合以下要求:(一)产品技术要求明确;(二)产品技术指标符合国家标准;(三)产品生产质量管理体系符合要求;(四)产品安全性、有效性评价合格。
第三章质量管理第十一条植介入耗材的生产企业应当建立健全质量管理体系,确保产品质量。
第十二条植介入耗材的生产企业应当对原材料、生产过程、成品进行严格检验,确保产品符合国家标准。
第十三条植介入耗材的包装、标签、说明书应当符合国家规定,真实、准确、完整。
第十四条植介入耗材的流通企业应当建立健全质量管理制度,对所经营的产品进行严格审查,确保产品来源合法、质量可靠。
第十五条植介入耗材的医疗机构应当对所采购的耗材进行验收,确保产品符合国家标准。
,.医疗器械注册产品标准一次性使用活组织取样钳2013-11-1 发布2013-11-1 实施诸暨市鹏天医疗器械有限公司发布目录前言......................................Ⅱ1 范围.....................................12 引用标准...................................13 分类.....................................14 要求.....................................65 试验方法...................................66 检验规则...................................77 标志、使用说明书...............................88 包装、运输、储存...............................9 《一次性使用活组织取样钳》编制说明....................... 11前言经检索,尚无同类产品现行的国家标准或行业标准,特制定本企业注册产品标准。
本标准编写遵循了GB/T 1.1-2009《标准化工作导则第一部分:标准的结构和编写规则》中有关产品标准编写的基本规定。
本标准自2013年11月1日起实施。
本标准由诸暨市鹏天医疗器械有限公司提出。
本标准起草单位:诸暨市鹏天医疗器械有限公司本标准主要起草人:王海江赵海龙雷俊一次性使用活组织取样钳1 范围本标准规定了内镜用软管式一次性使用活组织取样钳的分类、要求、试验方法、检验规则、标志、使用说明书、包装、运输及贮存。
本标准适用于通过软性内窥镜钳道钳取活体组织用的一次性使用活组织取样钳(以下简称取样钳)。
2 规范性引用文件下列文件中的条款通过本标准的引用而成为本标准的条款。
医疗器械注册产品标准一次性使用活组织取样钳2013-11-1 发布2013-11-1 实施诸暨市鹏天医疗器械有限公司发布目录前言......................................Ⅱ1 范围.....................................12 引用标准...................................13 分类.....................................14 要求.....................................65 试验方法...................................66 检验规则...................................77 标志、使用说明书...............................88 包装、运输、储存...............................9《一次性使用活组织取样钳》编制说明.......................11前言经检索,尚无同类产品现行的国家标准或行业标准,特制定本企业注册产品标准。
本标准编写遵循了GB/T 《标准化工作导则第一部分:标准的结构和编写规则》中有关产品标准编写的基本规定。
本标准自2013年11月1日起实施。
本标准由诸暨市鹏天医疗器械有限公司提出。
本标准起草单位:诸暨市鹏天医疗器械有限公司本标准主要起草人:王海江赵海龙雷俊一次性使用活组织取样钳1 范围本标准规定了内镜用软管式一次性使用活组织取样钳的分类、要求、试验方法、检验规则、标志、使用说明书、包装、运输及贮存。
本标准适用于通过软性内窥镜钳道钳取活体组织用的一次性使用活组织取样钳(以下简称取样钳)。
2 规范性引用文件下列文件中的条款通过本标准的引用而成为本标准的条款。
凡是注日期的引用文件,其随后所有的修改单(不包括勘误的内容)或修订版均不适用于本标准,然而,鼓励根据本标准达成协议的各方研究是否使用这些文件的最新版本。
凡是不注日期的引用文件,其最新版本适用于本标准。
GB 18279-2000 医疗器械环氧乙烷灭菌确认和常规控制GB 医疗保健产品灭菌生物指示剂第一部分:通则GB/T 计数抽样检验程序第一部分:按接收质量限(AQL)检索的逐批检验抽样计划GB/T 2829-2002 周期检查计数抽样程序及表(适用于对过程稳定性的检验)GB/T 金属维氏硬度试验第1部分:试验方法GB/T 8938-2008 打字纸GB/T191-2008 包装运输储运图示标志GB/ 医疗器械生物学评价第1部分:评价与试验GB/ 医疗器械生物学评价第7部分:环氧乙烷灭菌残留量GB/ 医用输液、输血、注射器具检验方法第1部分:化学分析法GB/ 医用输液、输血、注射器具检验方法第2部分:生物学试验方法GB/T1220-2007 不锈钢棒YY/T1076-2004 内窥镜用软管式活组织取样钳通用技术条件YY/T0149-2006 不锈钢医用器械耐腐蚀性能试验方法YY/ 外科器械金属材料第1部分:不锈钢YY/T 医疗器械用于医疗器械标签、标记和提供信息的符号第1部分:通用要求分类3.1 型号和基本尺寸取样钳的型号和基本尺寸应符合取样钳型号一览表的规定。
3.1.2 型号、规格命名方法XXXXX □取样钳有效长度取样钳代码举例说明,如:3.2 主要零件材料表2注:带*表示与人体接触的零件其中E~H型号的钳子杯与顶针材料为07Cr17Ni7Al,A~D型号的钳子杯材料为05Cr17Ni4Cu4Nb,顶针材料为06Cr19Ni10。
4 要求4.1 使用性能4.1.1 钳子杯应光滑,刃口或齿应完整、锐利。
钳头闭合时头端至二分之一处应吻合,不得有明显偏歪。
4.1.2 钳子杯二片张开角度应不小于80°;带针钳子杯张开至80°时,针尖应长于钳端,闭合时不得露出钳子杯。
4.1.3 钳子杯开闭应轻松灵活,不得有卡塞现象。
4.1.4 取样钳的弹簧软管应洁净无毛刺,其中无包塑的弹簧软管盘绕应紧密、平直,不应有明显的间隙和折曲。
4.1.5 取样钳各链接处均应牢固。
4.2 硬度取样钳的钳子杯的硬度为200~550HV1。
4.3 表面粗糙度钳子杯的头部表面粗糙度参数R a之数值应不大于:有光亮μm,无光亮μm。
4.4 外观4.4.1取样钳表面应光洁,色泽均匀,不应有锋棱、毛刺。
4.4.2金属材料外观无锈蚀痕迹。
取样钳所使用的金属材料的耐腐性能应不能低于YY/T0149中沸水试验法b级的要求。
4.5 尺寸取样钳的尺寸应符合产品标准中的规定。
主要零件材料取样钳与人体接触材料应符合本标准中表2 的规定。
环氧乙烷残留量产品灭菌后放置7天,环氧乙烷残留量应不大于10μg/g。
4.8 生物性能,按GB/选择生物学试验项目。
无菌取样钳应无菌。
细胞毒性取样钳与人体接触部分,应无细胞毒性反应。
致敏取样钳与人体接触部分,应无致敏反应。
皮内反应取样钳与人体接触部分,应无皮内反应。
化学性能(适用于带包塑的弹簧管)酸碱度专用料的水浸液与空白对照液pH值之差不得超过。
还原物质还原物质(易氧化物)含量(也就是还原物质在mol/L高锰酸钾标准溶液中的消耗量)应不大于ml/20mL。
5 试验方法5.1 使用性能5.1.1 模仿使用动作,在钳子杯三分之二处咬住一层GB/T 8938—2008中规定的26g/m2~32g/m2规格的打字纸,然后用手拉动纸片直至拉破,钳口咬住的纸片不应滑脱,符合的规定。
5.1.2 模仿使用动作,用通用量具测量,并用正常目力观察钳子杯,应符合的规定。
5.1.3 模仿使用动作,将取样钳插入软性模拟钳道中进行钳子杯开闭,应轻松灵活。
前后移动软管应无明显重感;抽出取样钳钳并目测软管表面,符合、的规定。
5.1.4 取样钳头部承受80N轴向静态拉力,且持续10s后无断裂,用目力观察连接部位应牢固,符合的规定。
5.2 硬度将钳头部分用镶嵌的方法固定,研磨镶嵌件表面直到露出平整金属表面,用硬度仪在表面测三个点,取其每处三点的算术平均值,应符合条的规定。
5.3 表面粗糙度用样块比较法进行,符合的规定。
5.4 外观5.4.1用正常目力观察,将钳头组件放在脱脂棉上翻滚,不应将脱脂棉带离,应符合的规定。
5.4.2取样钳中所使用的金属材料,按YY/T 0149-2006《不锈钢医用器械耐腐蚀性能试验方法》中沸水试验法进行试验,正常目力检查或显微镜观察试件表面的腐蚀痕迹,其腐蚀程度应不超过b级。
应符合4.的规定。
5.5 尺寸用通用量具测量,应符合的规定。
主要零件材料取样钳的主要零件材料以供方(或本公司)提供的有效材质证明为依据,应符合的规定。
环氧乙烷残留量按GB/中规定的方法进行,应符合的规定。
生物性能无菌周期检验时:按GB/T 中无菌试验法进行试验,应符合条的要求。
逐批检验时:按GB18279-2000 标准中规定的传统放行方法,审核灭菌过程的物理参数和生物指示剂培养结果(符合GB 的用于监测灭菌过程的BI生物指示剂培养后不应发生有试验菌生长)。
细胞毒性按GB/中显微镜观察法进行,应符合的规定。
致敏按GB/中规定的方法进行,应符合的规定。
皮内反应按GB/中规定的方法进行,应符合的规定。
化学性能(适用于带包塑的弹簧管)酸碱度按GB/中进行酸碱度试验时,应符合条的要求。
还原物质按GB/中进行还原物质试验时,应符合条的要求。
供试液的制备依据标准GB/《医用输液、输血、注射器具检验方法第1部分:化学分析方法》中的表1中的第2种方法。
6 检验规则6.1 验收取样钳应由制造厂检验部门进行检验,合格后方可出厂。
6.2 组批规则取样钳应成批提交检查,检查分为逐批检查(出厂检查)和周期检查(型式检查)。
6.3 逐批检查(出厂检查)6.3.1 逐批检查按GB/T —2003中的规定进行。
抽样方案采用一次抽样,抽样方案的严格性从正常检查抽样方案开始,其不合格分类,检查项目,检查水平和接受质量限(AQL)按表3的规定。
表3 逐批检查6.4 周期检查(型式检查)6.4.1 在下列情况下,应进行周期检查:a) 新产品投产前;b) 连续生产的产品每年不少于一次;c) 间隔一年以上再投产时;d) 在设计、工艺、材料有重大改变时;e) 国家质量监督检验机构对产品质量进行监督检验时;6.4.2周期检查应按GB/T 2829—2002中的规定进行。
6.4.3周期检查采用一次抽样方案,其不合格分类、试验组、检查项目、判别水平、RQL(不合格质量水平)和抽样方案按表4的规定。
(按每百单位产品不合格品数计算)。
表4 周期检查6.4.4周期检查合格,是指本周期内所有试验组周期检查都合格,否则就认为周期检查不合格。
生物相容性检查在下列情况下应按表5进行生物相容性再评价:a)制造产品所用材料来源或技术条件任何变化时;b)产品配方、工艺、初级包装或灭菌任何变化时;c)关于贮存的指导书或期望发生任何变化时,如保质期或运输发生变化时;d)产品的预期用途发生任何变化时;e)有证据表明产品用于人体会产生不良反应时。
表5 生物相容性检查抽样表7 包装使用说明书包装小包装袋(盒)上应有下列标志:a) 制造厂名称、地址;b) 产品名称;c) 数量、规格;d) 产品标准号;e) 产品注册号;f) 生产批号;g) 灭菌标识;h) 一次性使用标识;i) 有效期;j) 生产日期;大包装箱标志a) 制造厂名称、地址;b) 产品名称;c) 数量、规格;d) 产品标准号;e) 产品注册号;f) 生产批号;g) 灭菌标识;h) 一次性使用标识;i) 有效期;j) 生产日期;k)“怕晒”、“怕雨”等字样和标识应符合GB/T191-2008中的有关规定。
检验合格标识上应有下列标志:a) 制造厂名称;b) 检验员代号;使用说明书a)产品名称、型号、规格;b)生产企业名称、注册地址、生产地址、联系方式;c)生产许可证编号、注册证书编号、产品标准编号;d)产品的性能、主要结构、适用范围。
e) 使用方法、禁忌症、注意事项8包装、运输、贮存包装每把取样钳头部应套一塑料软管以保护钳头,盘绕封装入纸塑包装袋。
数个纸塑包装装入中包装盒内,盒内应有使用说明书、产品合格证,盒上应贴有封签。
数个中包装盒装入外运输箱,外箱应能保证在运输过程中产品不会破损、散落。
特殊要求按订货合同的规定进行包装。
运输装箱和运输要求按订货合同的规定。
贮存包装后的取样钳应贮存在相对湿度不超过80%,环境温度10℃~40℃,无腐蚀气体和通风良好的室内。
取样钳经包装后,在遵守贮存规则的条件下,应保证在三年内有效使用。
质保期经包装后的取样钳,在遵守储运、贮存和使用规则的条件下,自生产之日起质保期为3年。