紫外光谱(UV)
- 格式:ppt
- 大小:3.14 MB
- 文档页数:128

UV光谱的名词解释引言:在日常生活中,我们经常听到UV光谱这个名词,尤其是在涉及到光学、化学和医学等领域时更为常见。
那么,什么是UV光谱?为了更好地理解和应用它,我们有必要对其进行解释。
1. UV光谱的概念UV光谱是指在紫外线(UV)光区域内的光的能量和频率分布。
紫外线是指太阳辐射出的能量较高、波长较短的电磁辐射。
UV光谱通过测量不同波长的紫外线的强度,获得不同波长的光的能量分布曲线。
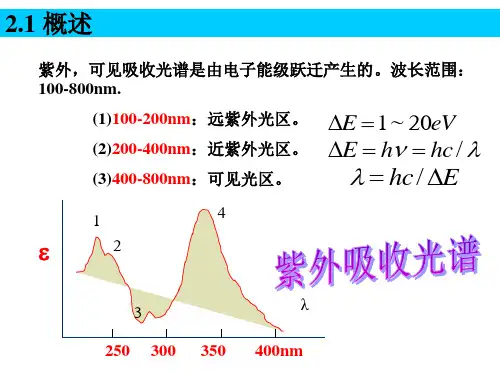
2. UV光谱的分类根据紫外线波长的不同,UV光谱通常分为三个区域:近紫外区(200-400 nm)、中紫外区(200-280 nm)和远紫外区(100-200 nm)。
其中,近紫外区是我们日常生活中最为常见的部分。
3. 光谱学与UV光谱光谱学是研究光的性质和光与物质相互作用的学科。
而在光谱学中,模拟和测量UV光谱是一种重要的手段。
通过分析UV光谱,我们可以深入了解光与物质的相互作用方式。
4. UV光谱与分子结构分子的化学结构和紫外线的吸收有着密切的关系。
不同的分子结构对紫外线的吸收和反射具有特定的特征。
通过测量和分析UV光谱,可以确定物质的分子结构,从而对物质进行定性和定量分析。
5. UV光谱在医学中的应用医学中广泛使用的药物和化妆品往往也受到UV光谱的影响。
通过测量UV光谱,可以判断药物和化妆品中是否存在不纯物质,保证其质量和安全性。
同时,UV光谱也被应用于药物的肝脏代谢和体内分布研究等领域。
6. UV光谱在环境监测中的应用紫外线是对环境具有一定损害作用的一种辐射。
因此,通过测量UV光谱可以对环境中的紫外线强度进行监测,为环境保护和预防紫外线辐射造成的危害提供重要数据。
7. UV光谱仪器的发展为了更好地研究和利用UV光谱,科学家们发展了一系列UV光谱仪器。
这些仪器可以精确测量和分析光的能量和频率分布。
随着技术的发展,现代UV光谱仪不仅具备高精度和高灵敏度,还能进行数据存储和自动分析等功能。
结论:综上所述,UV光谱是一种对紫外线能量和频率分布进行测量和分析的手段。


紫外光谱的原理及其应用紫外光谱是紫外分光光度计等分析化学中的重要工具。
UV(紫外线)光谱的另一个名称是电子光谱,因为它涉及将电子从基态提升到更高的能量或激发态。
在本文中,我将解释紫外光谱的基本原理、工作原理和所有应用。
一、紫外光谱简介紫外光谱是一种吸收光谱,其中紫外线区域(200-400nm)的光被分子吸收。
紫外辐射的吸收导致电子从基态激发到更高能态。
被吸收的紫外线辐射的能量等于基态和高能态之间的能量差(deltaE=hf)。
通常,有利的跃迁是从MAX占据分子轨道(HOMO)到LOW未占据分子轨道(LUMO)。
对于大多数分子来说,LOW能量占据的分子轨道是s轨道,对应于sigma键。
p轨道处于较高的能级,具有未共享电子对的轨道(非键轨道)位于较高的能级。
未占轨道或反键轨道(pie*和sigma*)是能量High的占据轨道。
在所有化合物(除了烷烃)中,电子都会经历各种跃迁。
一些随着能量增加的重要转变是:非键到派*,非键到sigma*,派到派*,sigma到pie*和sigma到sigma*。
二、紫外光谱学原理紫外光谱遵循比尔-朗伯定律,该定律指出:当一束单色光通过吸收物质的溶液时,辐射强度随吸收溶液厚度的下降率与入射辐射成正比:以及溶液的浓度。
Beer-Lambert定律的表达式为-A=log(I0/I)=Ecl其中,A=吸光度,I0=入射到样品池,目的光强度I=离开样品池的光强度C=溶质L目的摩尔浓度=样品池长度(cm.),E=摩尔吸光率从比尔-朗伯定律可以清楚地看出,能够吸收给定波长的光的分子数量越多,光吸收的程度就越大。
这是紫外光谱的基本原理。
三、紫外光谱的仪器和工作可以同时研究紫外光谱仪的仪器和工作。
大多数现代紫外光谱仪由以下部分组成:光源:钨丝灯和氢氘灯是广泛使用的光源,因为它们覆盖了整个紫外区域。
钨丝灯富含红色辐射;具体地说,它们发出375nm的辐射,而氢氘灯的强度低于375 nm。
单色器:单色器通常由棱镜和狭缝组成。


第一章紫外光谱(Ultraviolet Spectroscopy,UV)在分子光谱中,根据电磁波的波长( )划分为几个不同的区域,如下图所示:只有光子的能量恰好等于两个能级之间的能量时才能被吸收; 对某一分子来说,它只能吸收一定波长的电磁波供激发某一特殊能态之用,这样就得到各种不同的吸收光谱而用来鉴别有机分子的结构。
利用物质对电磁波的选择性吸收来进行物质结构解析的方法称为波谱(或光谱)分析。
吸收光谱:紫外光谱、红外光谱、核磁共振谱质谱:不是吸收光谱,是由高能电子(EI)冲击分子生成的离子按质量数的顺序表现的谱线。
1.1 紫外光谱的基本原理紫外光谱又称电子吸收光谱,是研究分子中电子能级的跃迁。
一般有机分子中存在的化学键主要有σ电子和π电子,另外还有未参与成键的n电子,正是这些电子的跃迁形成了有机化合物的电子吸收光谱。
1.1.1 紫外光谱的波长范围远紫外区 10~190 nm紫外区 190~400 nm可见区 400~800 nm电子跃迁主要是最高占有轨道的价电子吸收相应能量而发生的跃迁。
电子轨道能级和跃迁示意图1.σ→σ﹡跃迁λmax<150 nm饱和碳氢化合物: 只有σ-键,仅在真空紫外区可能观测到它们的紫外吸收谱带。
2.n→σ﹡跃迁λmax~200 nm含氧、氮、卤素和硫等杂原子的饱和烃化合物:有一对非键电子(n-电子),它们除了σ →σ﹡跃迁外,还有n→σ﹡跃迁。
非键轨道能级较高,比较容易激发,所以n→σ﹡跃迁产生的吸收谱带一般比σ →σ﹡跃迁产生的吸收谱带波长要长。
3.π→π﹡跃迁λ=160~190 nm不饱和烃化合物:π电子容易跃迁到反键轨道π﹡上,对应的吸收波长较长。
非共轭双键体系的π→π﹡跃迁比n→σ﹡跃迁产生的波长短一些,波长范围一般在160~190 nm。
两个或两个以上π键共轭,π→π﹡跃迁能量降低,谱带向长波方向移动。
4.n→π﹡跃迁λ= 270~290 nm含杂原子的双键:如C=O、C=S、N=O等基团,杂原子上的非键电子可激发到双键π﹡反键轨道,称为n→π﹡跃迁。




uv光谱的认识在我们日常生活中,我们经常听说UV光谱,但是对于UV光谱的认识可能相对较少。
UV光谱是指紫外线(Ultraviolet,简称UV)的频谱分布,它在物理、化学以及生物学领域中起着重要的作用。
本文将介绍UV光谱的基本概念、应用以及相关的实验方法,让我们对UV光谱有更全面的认识。
一、UV光谱基本概念紫外线是指波长在10纳米到400纳米之间的电磁波,它在光谱中的位置位于可见光和X射线之间。
根据紫外线的波长分布,可以将紫外线分为三个主要区域:近紫外线(NUV,200-400nm),中紫外线(MUV,190-200nm)和远紫外线(FUV,10-190nm)。
其中,NUV 紫外线是对人眼可见的。
紫外线的频谱分析被称为UV光谱,它可以帮助我们了解物质的结构、性质和反应过程。
UV光谱是通过测量物质对紫外线的吸收和散射来获得的。
当物质吸收紫外线时,它会吸收特定波长的光,产生一个光谱图,其中包含吸收峰和吸收谷。
二、UV光谱的应用1. 化学领域:UV光谱在化学研究中起着重要作用。
它可以用于确定物质的结构、测量溶液中的浓度和反应速率。
通过比较样品和标准物质的UV吸收光谱,我们可以确定化合物的成分和纯度。
2. 生物学领域:在生物学研究中,UV光谱被广泛应用于核酸和蛋白质的定量和纯化。
DNA和RNA在特定波长下具有明显的吸收峰,利用UV光谱可以确定核酸的含量和纯度。
蛋白质也具有吸收紫外线的特性,因此可以通过UV光谱来监测蛋白质的浓度和纯度。
3. 材料科学领域:UV光谱在材料科学中也有重要应用。
例如,UV 光谱可以评估塑料、涂料和染料的稳定性、耐久性和色彩变化。
通过测量材料在UV波段下的吸收和反射特性,可以评估材料在不同环境下的性能。
三、UV光谱实验方法对于UV光谱的实验测量通常使用紫外可见分光光度计或紫外可见吸收光谱仪器。
以下是一般的实验方法:1. 准备样品:选取适当的物质样品,制备溶液或固体样品。
溶液样品通常需在适当溶剂中稀释,以获得合适的浓度。