有机酸测定
- 格式:pdf
- 大小:244.89 KB
- 文档页数:3

果酒有机酸含量的测定方法
果酒是一种含有很高有机酸的饮品,例如苹果酒、草莓酒、葡萄
酒等,因此测定果酒的有机酸含量对于了解饮品的质量和口感有着重
要的作用。
下面就介绍一种测定果酒有机酸含量的方法。
(一)实验原理
使用碱溶液滴定果酒中的有机酸,有机酸和碱反应产生盐和水,
反应速度快,且滴定结束点明显,准确度高。
(二)实验步骤
1.称取10毫升的果酒,加入50毫升蒸馏水稀释至100毫升,混
匀待用。
2.取25毫升这个混合溶液,加入几滴酚酞指示剂,并加入
0.1mol/L的氢氧化钠溶液,搅拌均匀。
3.用0.1mol/L盐酸滴定氢氧化钠至混合液颜色变为粉红色,记
录所需的滴定计数N。
(三)计算结果
(1)计算盐酸的摩尔浓度(C)。
C=0.1mol/L(由于盐酸与氢氧化钠的滴定反应是一对一的反应,因此
盐酸的摩尔浓度与氢氧化钠的摩尔浓度相等)
(2)计算有机酸含量(m/V)。
m/V = N*C*88.01/1000
其中,N为滴定计数,C为盐酸浓度,88.01为分子量,1000为溶液的
体积(单位为毫升)。
以上就是测定果酒有机酸含量的实验步骤,需要注意的是,在实
验过程中应该保证实验器材的干净和精准,以确保实验结果的准确性。
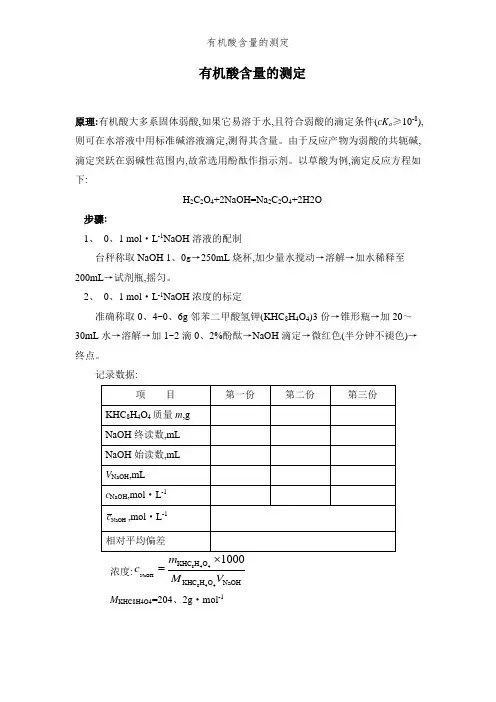
有机酸含量的测定原理:有机酸大多系固体弱酸,如果它易溶于水,且符合弱酸的滴定条件(cK a ≥10-8),则可在水溶液中用标准碱溶液滴定,测得其含量。
由于反应产物为弱酸的共轭碱,滴定突跃在弱碱性范围内,故常选用酚酞作指示剂。
以草酸为例,滴定反应方程如下:H 2C 2O 4+2NaOH=Na 2C 2O 4+2H2O步骤:1、 0、1 mol ·L -1NaOH 溶液的配制台秤称取NaOH 1、0g →250mL 烧杯,加少量水搅动→溶解→加水稀释至200mL →试剂瓶,摇匀。
2、 0、1 mol ·L -1NaOH 浓度的标定准确称取0、4~0、6g 邻苯二甲酸氢钾(KHC 8H 4O 4)3份→锥形瓶→加20~30mL 水→溶解→加1~2滴0、2%酚酞→NaOH 滴定→微红色(半分钟不褪色)→终点。
记录数据:浓度:844NaOH844KHC H O KHC H O NaOHc M V =M KHC8H4O4=204、2g ·mol -1相对平均偏差:NaOH100%r dd c =⨯,而3NaOH NaOH 113i d c c ==-∑3、 有机酸含量的测定(1)准确称取草酸0、6~0、8g →100mL 烧杯→加适量水溶解→定量转入100mL 容量瓶,→用水稀释至刻度,摇匀.(2、)准确移取上述溶液25、00mL(3份)→锥形瓶→加酚酞1~2滴→NaOH 滴定→微红色(半分钟不褪色)→终点。
含量:224224NaOH NaOH H C O H C O 100%25.0021000100.0c V M w m =⨯⨯⨯M H2C2O4=90、03g ·mol -1 相对平均偏差:224H C O 100%r d d w =⨯,而2242243H C O H C O 113i d w w ==-∑。

蔬菜中有机酸含量的测定实验30果实、蔬菜中有机酸含量的测定在植物的各个器官中,普遍存在着有机酸,并在代谢中起着重要作用。
在呼吸作用中,它们是碳水化合物、脂肪、蛋白质代谢的中间产物,也是这三大类物质代谢的重要联结者。
有机酸在植物体内存在状况,随植物的不同部位有所不同。
在果实和浆果中,自由酸最多,而在叶中主要是有机酸的盐类,它们的含量因栽培条件而异。
果蔬在成熟和储藏过程中,其酸的性质与含量都发生变化。
故测定果蔬中有机酸含量,可以鉴别其品质的变化。
一、原理有机酸易溶于水、醉和谜中,可用这些溶剂先将有机酸提取出来,然后用碱液滴定,即能测定出有机酸的含量。
二、实验材料、试剂与仪器设备(一)实验材料苹果、梨或植物其他组织。
(二)试剂1% 酚fit试剂,0. 1 mol/L NaOH。
(三)仪器设备天平,恒温水浴,研钵,漏斗,滴定管,移液管,容量瓶,量筒,三角瓶。
三、实验步骤1.提取称取果实或蔬菜5 g放入研钵中,加少许石英砂研磨成匀浆,用少量蒸储水冲洗至50 mL三角瓶中,再加水至30 mL左右,置于80 ?水浴中浸提30min ,每隔5 min搅拌1次,取出冷却后过滤,滤液与冲洗残渣滤液合并,定容50 mL o摇匀,供测定之用。
2.测定取50 mL干洁三角瓶3只,分别装入样品提取液10 mL , 1%酚酸3滴,用0. 1 mol/L NaOH滴定至微红色,摇动1 min 不褪色即为滴定终点,记录消耗碱液的数量。
如提取液有颜色时可能干扰滴定终点,为此可在提取液中放入一块石蕊试纸,根据颜色变化来确定终点。
四、结果计算式中:W ——样品重量,g o C —— NaOH浓度,0. 1 mol/L。
K 一一换算系数:苹果酸为67 ,酒石酸为75 oV 1 ——提取时样液总量,mL oV 2 一一测定时样液用量,mL oV3——消耗NaOH液量,mL 。

有机酸摩尔质量的测定实验报告有机酸摩尔质量测定一、实验目的1、进一步熟悉分析天平减量称量法。
2、进一步熟悉滴定方法。
3、了解滴定误差的减免方法4、进一步掌握酸碱指示剂的使用二、实验原理大部分有机酸是弱酸,且为固体,这类物质纯度测定大都采用酸碱滴定法。
当浓度约为0.1mol•L-1时,若CKa≥10-8,即可用NaOH标准溶液滴定。
因滴定突跃在弱碱性范围内,常选用酚酞作指示剂。
滴定至终点溶液呈微红色,根据NaOH标准溶液的浓度和滴定时所消耗的体积,可计算该有机酸的摩尔质量。
相关反应过程以及计算公式如下:1、有机酸与氢氧化钠反应方程式:nNaOH+HnA Na n A+nH2O有机酸除了具有抗生素作用外,还具有其它几种作用,包括降低消化物pH和增加胰腺分泌。
有几个国家已撤消了在动物饲料中使用非治疗性抗生素的主张,饲喂低剂量促生长剂的行为在世界范围内也在迅速消失。
那些想在无药市场进行销售活动的生产者正在寻求饲料抗生素的非药物性替代物。
为了弄清什么是合适的替代物,有必要了解抗生素的作用方式。
多数数据表明,抗生素的促生长作用可以完全归于它们的抗菌活性和由此带来的生理反应。
因此,寻找替代物着重注意具有抗菌活性的天然分子物质。
最有效的候选替代物是有机酸,可以是单项酸,也可以是多项酸的混合物。
这些有机酸长期用于断奶仔猪日粮中,对仔猪的健康和生长都有积极作用。
本报告将比较抗生素和有机酸的作用,并描述一种新的有机酸,即2-羟基-4-(甲硫基)丁酸(HMB) 的活性。
HMB是一种蛋氨酸补充源,一般用于猪、禽及反刍动物饲料中。
HMB 实际是一种天然的L-蛋氨酸前体,饲喂时,从化学上是一种一元羧酸,即有机酸,直至到动物组织后被酶转化为L-蛋氨酸。
与其它具抗菌活性的有机酸一样,HMP 在低pH环境下是亲脂的,且可以以扩散的方式被吸收到脊椎动物和细菌或真菌细胞中。
一旦进入细胞,pH的变化就会引起这些弱酸的溶解。
有机酸的多重作用就是由于这种细胞内的溶解和由此引起的细胞反应。

有机酸的分析与检验——对羟基联苯比色法测定乳酸含量有机酸是一类含有羧基(COOH)的有机化合物,具有特殊的化学性质和广泛的应用。
有机酸的分析与检验对于实验室研究和工业生产都具有重要意义。
其中,对羟基联苯比色法可以用于测定乳酸含量。
乳酸(lactic acid)是一种常见的有机酸,是由乳酸菌在发酵过程中产生的。
乳酸广泛应用于食品工业、药品工业和医药领域。
因此,测定乳酸含量是非常重要的。
对羟基联苯比色法基于乳酸与对羟基联苯反应生成有色产物的原理进行测定。
该方法操作简便,灵敏度高,具有较高的准确性和精密度。
具体操作步骤如下:步骤一:制备标准曲线1.准备一系列乳酸浓度逐渐递增的标准溶液。
可以使用已知浓度的乳酸溶液进行稀释,或通过乳酸的溶液配制。
2.将标准溶液分别转移到不同的容量瓶中,加入定量的对羟基联苯试剂。
3.在常温环境下,利用分光光度计测量乳酸和对羟基联苯试剂反应产生的有色产物的吸光度。
4.利用所得吸光度数据绘制乳酸浓度与吸光度之间的标准曲线。
步骤二:样品处理1.取适量待测样品,用水稀释至一定体积。
2.将稀释后的样品分别转移到不同的容量瓶中。
3.各个容量瓶中加入定量的对羟基联苯试剂。
4.在常温环境下,利用分光光度计测量样品和对羟基联苯试剂反应产生的有色产物的吸光度。
步骤三:计算样品中乳酸含量1.根据标准曲线,利用所得吸光度数据计算出样品中乳酸的浓度。
2.根据样品的稀释倍数和最初样品的体积,计算出样品中乳酸的实际含量。
需要注意的是,实验过程中应该严格控制温度和时间,避免有色产物与空气中的氧气反应产生误差。
此外,对乳酸本身的特性和分子结构也需要了解,以正确操作和解读实验结果。
通过对羟基联苯比色法测定乳酸含量,可以实现对有机酸乳酸的定量分析。
这种方法具有操作简便、准确度高的特点,适用于实验室研究和工业生产过程中乳酸含量的测定。

果蔬有机酸含量的测定植物材料中含有丰富的有机酸,如苹果酸、柠檬酸、琥珀酸、酒石酸、草酸等。
利用酸碱滴定法测定果蔬中的可滴定酸含量,可以从风味及营养的角度衡量其品质。
重点:①碱式滴定管的调零、体积读数,容量瓶、移液管的正确使用;②邻苯二甲酸氢钾及有机酸样品的正确称取(差减法);③有效数字的取舍及确定。
难点:滴定终点的判断及掌握。
一、实验目的1.学习强碱滴定弱酸的基本原理及指示剂的选择。
2.掌握NaOH的配制和标定方法以及基准物质的选择。
二、实验原理1.大多数有机酸是弱酸,如果某有机酸易溶于水,解离常数Ka>>10-7,用标准碱溶液可直接测其含量,反应产物为强碱弱酸盐。
滴定突跃范围在弱碱性内,可选用酚酞指示剂,滴定溶液由无色变为微红色即为终点。
2. NaOH标准溶液是采用间接配制法配制的,因此必须用基准物质标定其准确浓度。
邻苯二甲酸氢钾(KHC8H4O4),它易制得纯品,在空气中不吸水,容易保存,摩尔质量较大,是一种较好的基准物质,标定反应如下:反应产物为二元弱碱,在水溶液中显微碱性,可选用酚酞作指示剂。
邻苯二甲酸氢钾通常在105-110℃下干燥2h后备用,干燥温度过高,则脱水成为邻苯二甲酸酐。
3. 在一定温度下,用蒸馏水或乙醇将植物材料中的有机酸浸提出来,用碱溶液滴定浸出液,即可计算出样品的可滴定酸含量。
果实中的有机酸含量如柑橘类可换算成柠檬酸、葡萄可换算成酒石酸,苹果类可换算成苹果酸表示。
二、仪器设备1. 天平2. 250 mL三角瓶3. 匀浆机(或研钵)4. 恒温水浴锅5. 低速离心机(或漏斗) 6. 50mL离心管(或定性滤纸)7. 碱式滴定管8. 100 mL容量瓶9.25mL移液管三、试剂1. 0.05 mol·L–1NaOH标准溶液:在天平上取约0.5g固体NaOH(可用干燥小烧杯称取),另用大量筒量取250mL去离子水(无CO2),倒少量水入装有NaOH固体的小烧杯中,搅拌使NaOH溶解后将其倒入试剂瓶中;再将大量筒中剩余的水倒入试剂瓶中,混匀。

大肠发酵有机酸的测定大肠发酵是指大肠杆菌等肠道菌群在人体肠道中将未被小肠吸收的食物残渣进行发酵作用产生有机酸的过程。
有机酸是一类碳原子数较少的含有羧基的有机化合物,常见的有机酸包括乙酸、丙酸、丁酸等。
测定大肠发酵产生的有机酸对于评估肠道菌群功能、消化道健康以及某些疾病的诊断和治疗具有重要意义。
测定大肠发酵有机酸的方法有很多种,下面将介绍一种常用的方法。
收集被测者的粪便样本。
在收集样本前,被测者需要遵守相关的采样要求,避免将其他物质污染到样本中。
在收集样本时,可以使用专用的容器或者塑料袋,并尽量保持样本的新鲜性。
接下来,将样本进行处理。
将收集到的粪便样本均匀搅拌后,取适量的样本加入含有生理盐水或缓冲液的试管中。
接着,用离心机将样本离心,以将固体颗粒与液体分离。
离心后,取上清液进行后续的测定。
然后,利用高效液相色谱法(HPLC)进行有机酸的测定。
HPLC是一种高效、精确的分析方法,可以实现对多种有机酸的定量分析。
在进行HPLC测定前,需要准备好相应的试剂和标准品。
首先,根据需要测定的有机酸种类选择合适的色谱柱和流动相。
然后,根据标准品的浓度制备一系列浓度不同的标准曲线。
接着,将样本和标准品按照一定比例混合,并进行必要的稀释。
最后,将混合好的样品注入到HPLC系统中进行分析,通过峰面积或峰高来计算样品中有机酸的浓度。
根据测定结果进行数据分析和解读。
根据测定的有机酸浓度,可以评估大肠发酵的强度和菌群功能。
较高的有机酸浓度可能表示肠道菌群的过度生长或发酵产物的代谢紊乱,而较低的有机酸浓度可能与肠道菌群失调或功能异常有关。
因此,通过测定大肠发酵有机酸的浓度,可以为评估肠道健康和疾病诊断提供参考依据。
测定大肠发酵产生的有机酸是一种评估肠道菌群功能和消化道健康的重要方法。
通过收集样本、处理样品、利用HPLC进行分析以及数据分析和解读,可以获得有关大肠发酵有机酸的相关信息。
这些信息对于研究肠道菌群、评估肠道健康以及某些疾病的诊断和治疗具有重要意义。
![[工学]食品中有机酸的分离与测定](https://uimg.taocdn.com/d0ab1c61b307e87101f696aa.webp)

有机酸摩尔质量的测定一、实验目的。
1、掌握有机酸摩尔质量的测定原理和方法;2、明确多元酸滴定中的及称量过程中应注意的若干问题;3、掌握NaOH溶液的配制及标定原理和方法;4、熟练掌握称量、溶液配制及滴定分析的基本操作。
二、实验原理。
1、称量台秤:在称量之前,要先调整台秤的零点。
调整好零点后,称量时,左盘放称量物,右盘放砝码。
砝码用镊子夹取,10g 或5g以下的质量的砝码,可直接移动游码标尺上的游码。
当加减砝码到台秤指针停在刻度盘的中间位置时,台秤处于平衡状态。
称量物的质量=砝码+游码电子天平:称量时,横梁围绕支承偏转,传感器输出电信号,经整流放大反馈到力矩线圈中,然后使横梁反向偏转恢复到零位,此力矩线圈中的电流经放大且模拟质量数字显示。
此数字就是称量物的质量。
2、溶液的配制NaOH溶液的配制:因为NaOH没有基准物质,故不能直接准确配制,应用间接法配制。
其过程:计算—>称量—>溶解-->转入容量瓶,稀释至刻度线-->装瓶-->贴标签—>备用用配制好的NaOH溶液标定邻苯二甲酸氢钾基准试剂。
NaOH +KHC8H4O4 =KNaC8H4O4 + H2OC( NaOH )=m(邻苯二甲酸氢钾)*10^3/(M(邻苯二甲酸氢钾)V( NaOH ))柠檬酸溶液的配制:因为柠檬酸(C6H8O7 .H2O)能稳定存在,且摩尔质量大,可做基准物质,故可用直接法配制柠檬酸溶液。
其过程:计算—>称量—>溶解-->转入容量瓶,稀释至刻度线-->装瓶-->贴标签—>备用3、滴定分析强酸强碱以及CKa和CKb的弱酸弱碱大于或等于10^-8,均可用标准浓度的酸或标准浓度的碱进行直接滴定。
对于二元弱酸,若Ka1/ Ka2>10^5,则可分步滴定;若Ka1/ Ka2<10^5,则不可分步滴定,只能测定二元酸两步电离的总酸。
柠檬酸(C6H8O7):Ka1=7.4*10^-4 Ka2=1.7*10^-5Ka3=4.0*10^-7 M(柠檬酸)=210.14g/mol因为:CKa1> CKa2 > Ka3>10^-8Ka1/ Ka2<10^5 Ka2/ Ka3<10^5故柠檬酸的三步电离的酸不能分步滴定,只能测其总酸量。

果酒有机酸含量的测定方法果酒是一种以果实为原料,经过发酵过程制成的酒类饮品。
它不仅口感清爽,而且含有丰富的营养成分,如有机酸、维生素等。
其中,有机酸是果酒中的重要成分之一,它不仅能够改善酒的口感和品质,还具有一定的保健作用。
因此,准确测定果酒中有机酸的含量,对于保证果酒的品质和营养成分的充分利用具有重要意义。
一、测定方法测定果酒中有机酸含量的方法很多,常用的有滴定法、高效液相色谱法、气相色谱法等。
其中,滴定法是最为简便、实用的方法之一,下面以滴定法为例介绍具体操作步骤:1.仪器和试剂仪器:酸碱滴定管、分液漏斗、烧杯、磁力搅拌器、电子天平。
试剂:0.1mol/L NaOH溶液、酚酞指示剂、果酒样品。
2.样品准备取适量的果酒样品,用分液漏斗将其过滤并加入烧杯中,放入磁力搅拌器中搅拌均匀。
3.滴定操作将0.1mol/L NaOH溶液加入到酸碱滴定管中,滴加酚酞指示剂,使其变成粉红色。
然后将滴定管放入烧杯中,缓慢滴加NaOH溶液,同时磁力搅拌器不停地搅拌,直到溶液由粉红色变成淡黄色。
记录滴定所需的NaOH溶液体积V1。
4.空白对照取同样的量的去离子水,按照上述方法进行滴定,记录滴定所需的NaOH溶液体积V2。
5.计算有机酸含量有机酸的含量计算公式为:有机酸含量(g/L)=[(V1-V2)×N×M]/V其中,N为NaOH溶液的标准浓度(mol/L),M为NaOH溶液的摩尔质量(g/mol),V为果酒样品体积(L)。
二、注意事项1.样品的准备:为了保证滴定结果的准确性,应选取新鲜、干净、无杂质的果酒样品进行测定。
2.滴定操作:滴定过程中,应注意滴定速度要缓慢,确保滴定液体积准确。
3.空白对照:为了排除NaOH溶液中可能存在的杂质对滴定结果的影响,应进行空白对照实验。
4.计算有机酸含量:在计算有机酸含量时,应保证各项参数的准确性,如NaOH溶液的浓度、摩尔质量以及样品的体积等。
三、结论滴定法是一种简便、实用的果酒中有机酸含量测定方法。

发酵液中有机酸含量的测定好啦,今天咱们聊聊发酵液中有机酸含量的测定。
说到发酵,可能大家第一反应就是酸酸的味道,或者是酿酒的过程,咱们日常喝的酸奶也是通过发酵做出来的。
发酵不仅仅是酸奶的专利,它还和很多食品、饮料甚至工业产品有着密切的关系。
而发酵液中的有机酸,哦,那可是一个关键的角色,不仅关系到发酵的质量,还直接影响到成品的口感、保质期和营养价值。
所以呀,咱们得好好研究一下怎么测定这些有机酸含量。
首先得说,有机酸是什么玩意儿。
简单来说,有机酸就是含有酸性氢的有机化合物。
那有机酸是如何产生的呢?嘿,发酵过程可不简单,细菌、酵母菌等微生物在糖分的帮助下,活跃得像小猴子一样,经过一系列复杂的生化反应,就把糖分转化成了酸。
这个过程就好比是它们的“饭后消化”,给它们能量,也让食物产生了味道。
比如常见的醋酸、乳酸、柠檬酸,这些不都是有机酸吗?它们可是发酵液中的“明星”,可是个大人物!那么问题来了:我们怎么知道发酵液里有多少有机酸呢?答案就是,得测量。
测量有机酸,简单的说就是用科学的办法,量一量它们在发酵液中的含量。
咋量呢?有几种方法,最常用的莫过于酸碱滴定法了。
你想象一下,滴定法就像是你去餐馆吃饭,最后结账时,服务员给你账单,你一个个核对,总得算出这顿饭到底花了多少钱吧?酸碱滴定法的原理也差不多,就是通过加入一种已知浓度的碱性溶液,慢慢中和发酵液中的有机酸,看什么时候两者的酸碱性恰好平衡,然后根据使用了多少碱,就能算出有机酸的含量。
这不,滴定法就是这样一个“大致估算”的方法,原理简单,操作也不复杂,虽然每次加液都得小心翼翼的,但总体来说,成功率还是蛮高的。
酸碱滴定法不仅准确,而且成本不高,几乎是实验室标配。
可是,话又说回来,滴定法也有局限性,毕竟有些发酵液里面的成分多样,混合得像菜市场似的,得小心别把别的物质的酸性也算进去。
哦,别忘了,如果操作不当,还可能把误差给搞得一塌糊涂。
除了滴定法,还有一些其他的测定方法,比如高效液相色谱法(HPLC)和气相色谱法(GC)。
实验三有机酸摩尔质量的测定一、实验目的与要求1.掌握用基准物标定NaOH 溶液浓度的方法。
2.了解有机酸摩尔质量测定的原理和方法。
二、实验原理绝大多数有机酸为弱酸,它们和NaOH 溶液的反应为:nNaOH + H n A = Na n A + nH2O当有机酸的各级离解常数与浓度的乘积均大于10-8时,有机酸中的氢均能被准确滴定。
用酸碱滴定法,可以测得有机酸的摩尔质量。
测定时,n值须已知。
由于滴定产物是强碱弱酸盐,滴定突跃在碱性范围内,因此可选用酚酞作指示剂。
NaOH 不符合基准物的条件,必须用近似法配制,然后用基准物标定。
本实验采用邻苯二甲酸氢钾(KHC8H4O4)为基准物,酚酞为指示剂标定NaOH 溶液的浓度,其反应式为:OH- + HC8H4O4- = C8H4O42- + H2O三、仪器与试剂NaOH、邻苯二甲酸氢钾(KHC8H4O4)、有机酸试样乙酰水杨酸(C9H8O4)、酚酞指示剂(0.2%乙醇溶液)、量筒(10mL)、烧杯、试剂瓶、滴定管(50mL)、锥形瓶(250mL)、移液管、容量瓶。
四、实验步骤1. 0.10mol/L NaOH的配制用直接称量法在台秤上称取2g NaOH于小烧杯中,溶解后,置于500ml戴橡皮塞的试剂瓶中稀至500ml摇匀。
(需要定量吗?)2. 0.10mol/L NaOH的标定在称量瓶中用差减法平行称量邻苯二甲酸氢钾7份,每份约 0.4~0.6 g ,(分子式约204)分别倒入250 mL 锥形瓶中,加入 40~50 mL 水使之溶解,加入 1~2 滴酚酞指示荆,用待标定的 NaOH 溶液滴定至呈现微红色,保持 30 秒内不褪色,即为终点。
平行测定 3 次,计算 NaOH 溶液的浓度和相对平均偏差。
3. 有机酸摩尔质量的测定用差减法准确称取试样乙酰水杨酸(C9H8O4)(分子式约为180) 0.5~0.7 g 于 100 mL 烧杯中,加 40~50 mL 水溶解,定量转入 100 mL 容量瓶中,用水冲洗烧杯数次,一并转入容量瓶中,然后用水稀释至刻度,摇匀。
有机酸的测定方法有很多,如酸碱滴定法、酯化法、比色法、液相色谱法、离子色谱法、毛细管电泳法、气相色谱法等。
例如:酸碱滴定法是对有机酸检测常用的方法,对有机酸的溶液进行定量,并使用标准浓度的碱性溶液进行滴定,当酸碱中和达到终点时,通过化学反应的公式来计算出有机酸的浓度。
这个方法对有机酸的计算并不是非常精准,要把握好终点的滴定量,多一滴或少一滴都会影响到有机酸浓度的准确度。
具体使用哪种方法,需要根据实际检测要求和条件来选择。
实验水果、蔬菜中总酸的测定(学号:************,************李欣钰和郎琳)【实验目的】1、利用标准液滴定水果蔬菜,测定不同水果蔬菜中总酸度2、练习利用滴定管滴定溶液3、练习移液管的使用4、练习pH计的使用【实验原理】1、水果和蔬菜中含有各种不同的有机酸,主要为苹果酸,柠檬酸,酒石酸,草酸等。
果树的种类不同,含有机酸的种类和数量也不同。
果汁或菜汁的酸性取决于游离态的酸或酸式盐的存在数量。
这些算都是有机弱酸,所以在测定时,有氢氧化钠标准溶液滴定就能测出酸度。
这样测得的数据是总酸度,包含了未离解酸和已离解酸的浓度。
用下式计算:总酸度(%)=(V样/W样)x(V NaOH xc NaOH x折算系数/V取样)x100式子中V样为样品稀释总体积;V取样为滴定时取样体积;W样为样品的质量。
折算系数为不同有机酸的毫摩尔质量2、食品中的总算度往往根据算韩算的不同,而取其中某种主要有机酸计量。
食品中常见的有机酸及其毫摩尔质量折算系数如下苹果酸——0.067(苹果,梨,西红柿)酒石酸——0.075(葡萄)柠檬酸——0.090(柑橘类)【仪器试剂】烧杯(100ml)(3-5只),洗耳球,移液管(25ml),容量瓶(250ml)(3只),滤纸,铁架台,滴定管夹,碱式滴定管,玻璃棒,胶头滴管,电子天平,研钵,酚酞指示剂,NaOH标准溶液(约为0.2mol/l),西红柿,葡萄,橘子(自备),塑料袋若干(自备),小刀(自备)【实验内容】1.准确称取混合均匀磨碎的样品10g2.转移到250ml容量瓶中,加纯水至刻度线,摇匀3.吸取50ml溶液于锥形瓶中,加入两滴酚酞试剂4.用NaOH标准溶液滴定溶液至淡红色,并且在30s内不退色,即到达终点。
5.记下所用的NaOH体积。
重复测定三次取平均值。
6.利用同样的方法测定剩余的两种水果或蔬菜。
并记录实验数据7.用pH计测出样品稀释液的pH8.处理实验数据,比较所测的西红柿,葡萄,橘子的总酸度的不同实验数据处理表温度:17°C。
有机酸摩尔质量的测定实验报告
我们知道有机酸中的酸性基团有很多,最典型的是羧酸–COOH,–磺酸SO3H,这些属于酸性较强的基团;还有H2N=C=NH、–NH3+(多见于氨基酸中);硼酸–B(OH)3;另外酚羟基(Ar–OH在苯环邻对位有吸电子集团,如–NO2时也表现出较强的酸性),同理还有–SH;有时候还会遇到多聚磷酸基团的滴定(不过多聚磷酸属于无机酸),还有–ClO2H、–ClO3H等。
我们滴定有机酸的一些酸性基团,首先应该查表得到各个基团的pKa。
有机酸的酸性较弱,一般需要在近中性条件下滴定。
如果环境pH过高或过低,都会改变有机酸的存在形态,得到的滴定结果也各不相同。
所以控制pH是非常重要的。
如果测得酸的含量刚好为200%,那么很可能是把二元酸当做了一元酸滴定,或者把四元酸当成了二元酸...依此类推。
这个时候需要重新检查结构,并监测滴定过程中的pH变化。
另外,如果用错了指示剂,也可能造成滴定终点pH过高(碱性过强),较弱的酸根也被滴定,但计算时仍按照滴定一个酸根来计,同样会造成含量测成200%。
我们需要首先计算出滴定终点pH,然后根据这个pH选择合适的指示剂。
最好不要用空气的摩尔质量,空气的摩尔质量受环境影响很大,29是一个参考值。
建议将过量二氧化碳通过乘浓硫酸(或其他酸性干燥剂)后通过已知物质的量的氢氧化钠,尾接一个装碱石灰的干燥瓶,防止空气中的水对氢氧化钠增重测量的干扰。
二氧化碳要过量,氢氧化钠的物质的量要已知。
可以的话可以以甲基橙为指示剂,用稀硫酸滴定氢氧化钠。
算出质量的增量和物质的量就能算摩尔质量了。
反相液相色法谱测定 10 种有机酸
马淑伟 郭亦如 杨定忠
(Agela Technologies 天津 300457)
摘要: 本文建立了一种利用高效液相色谱同时分析 10 种有机酸的方法, Venusil MP C18 (5μm 4.6 在
mm x 250 mm ) 色谱柱上,0.1mol/L K2HPO4(pH2.05 )溶液和乙腈做梯度洗脱,流速为 1.0mL/min,柱温为
30 ℃,紫外检测波长为 210nm 时,可以很较好地分离常见的 10 种有机酸。
关键词:反相液相色谱 有机酸
1
实验部分
1. 1 仪器与试剂
高效液相色谱系统:岛津LC-10A XMTG-8000 型柱温箱 酸度计(PHS-25) 分析纯磷酸、磷酸氢二钾(天津市化学试剂三厂)
1. 2 色谱条件
色谱柱: Venusil MP C18 (5μm,4.6mmi.d. ×250mm) 流 速:1.0mL/min
进样量:20μL 波 柱 长:210nm 温:30 ℃
流动相: 缓冲盐:13.6 克磷酸氢二甲溶解到 1000ml 水中,用磷酸调 pH=2.05,过滤; 梯度条件: 时间(min) 0 18 30 乙腈(%) 0 0 20 缓冲盐(%) 100 100 80
博纳艾杰尔科技
400-6068-099
service@
2 结果与讨论 2. 1 检测波长的选定
用200~350nm (紫外) 光对10种有机酸的标准溶液进行扫描,结果表明10种有机酸均在210nm附近 有较大的吸收,重复性好,不受流动相中其他物质的干扰,故以下实验均采用210nm 波长进行检测。
2. 2 流动相浓度的选择
将流动相分别配成0.05 、0.10 、0.15 和0.20mol/L 的K2HPO4 溶液(用H3PO4 调pH 值为2.05 ) ,对 各有机酸进行分离。
结果表明: 逐步增加流动相中磷酸盐的浓度,有机酸均能得到分离,且不影响分离效 果,但考虑到色谱柱的使用寿命,最终选定0.10 mol/L.
2. 3 流动相pH 值的选择
以不同pH 值(用H3PO4 调节)的0.10mol/L的K2HPO4溶液作流动相,测定各有机酸的保留时间,结果 显示流动相pH值对有机酸的分离影响很大。
综合考虑各有机酸间的分离度和色谱柱的pH范围, 选定2.05.
2. 4 分离条件的优化
以分离的影响因素流动相pH值、乙腈含量、流速和柱温做正交试验对分离条件进行优化,最终得 到优化条件:(1)由于丁酸保留太强所以选用梯度洗脱;(2)流速选用1.0ml/min;(3)柱温为30℃;
图1
10 种有机酸图谱
1 甲酸 2 丙酮酸 3 苹果酸 4 乳酸 5 乙酸 6 柠檬酸 7 琥珀酸 8 延胡索酸 9 丙酸 10 丁酸
2. 5 检测限、标准曲线、回收率
取同一果汁样品2 份,其中一份作本底,另一份添加一定量的10种有机酸标品溶液后测定各成分含量, 每份样品进行5 次平行测定,考察方法的回收率和精密度,以峰高A (mV) 对质量浓度C(mg/L) 求得线性 回归方程,以3 倍信噪比( S/ N ) 计算最小检测出限。
博纳艾杰尔科技
400-6068-099
service@
表1 有机酸 甲酸 丙酮酸 苹果酸 乳酸 乙酸 柠檬酸 琥珀酸 延胡索酸 丙酸 丁酸
10种有机酸的回归方程、回收率和检测限 回归方程 检测限(µg/mL) 1.89 0.11 0.51 0.36 1.08 0.43 1.83 0.65 0.19 0.12 回收率 98.1 99.2 100.3 96.9 99.6 98.2 100.8 101.2 97.4 100.5
C = 3. 904+0. 7499×10-4 A C=0.0142+1.603×10-5A C =-0 .2998+2.983 ×10 -4 A C = 6. 601+0. 2120 ×10-4 A C =0. 2652+0. 9513×10 - 4 A C =0 .0153+4.966 ×10 -4 A C =0 .2320+1.06 ×10 -3 A C=0.1380+1.380×10-4A C=0.0705+1.920×10-3A C=5.1213+1.01×10-4A
3 结论:
经多次实验结果证明: 采用Venusil MP C18 (5μm,4.6mmi.d. ×250mm)色谱柱, 0.1mol/L 流速1.0mL/min, 在210nm 波长下,可以较好地分离果汁中常见 K2HPO4(pH2.05 )溶液和乙腈做梯度洗脱, 的10种有机酸,该方法具有测试组分多、简便等优点,对于鉴别果汁真假、控制果汁质量具有重要的意 义。
参考文献: [1]李小平, 姚浔平, 范建中, 金米聪,果汁中9种有机酸的反相高效液相色谱法测定,中国卫生检验杂志 2008年4月第18卷第4期
博纳艾杰尔科技
400-6068-099
service@
。