高三化学二轮复习五大平衡常数
- 格式:ppt
- 大小:915.50 KB
- 文档页数:28
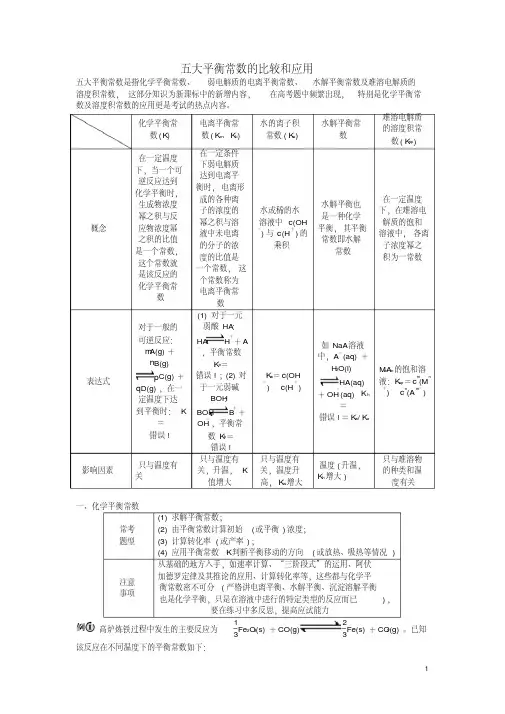
五大平衡常数的比较和应用五大平衡常数是指化学平衡常数、弱电解质的电离平衡常数、水解平衡常数及难溶电解质的溶度积常数,这部分知识为新课标中的新增内容,在高考题中频繁出现,特别是化学平衡常数及溶度积常数的应用更是考试的热点内容。
化学平衡常数(K) 电离平衡常数(K a、K b)水的离子积常数(K w)水解平衡常数难溶电解质的溶度积常数(K sp)概念在一定温度下,当一个可逆反应达到化学平衡时,生成物浓度幂之积与反应物浓度幂之积的比值是一个常数,这个常数就是该反应的化学平衡常数在一定条件下弱电解质达到电离平衡时,电离形成的各种离子的浓度的幂之积与溶液中未电离的分子的浓度的比值是一个常数,这个常数称为电离平衡常数水或稀的水溶液中c(OH-)与c(H+)的乘积水解平衡也是一种化学平衡,其平衡常数即水解常数在一定温度下,在难溶电解质的饱和溶液中,各离子浓度幂之积为一常数表达式对于一般的可逆反应:m A(g)+n B(g)p C(g)+q D(g),在一定温度下达到平衡时:K=错误!(1)对于一元弱酸HA:HA H++A-,平衡常数K a=错误!;(2)对于一元弱碱BOH:BOH B++OH-,平衡常数K b=错误!K w=c(OH-)·c(H+)如NaA溶液中,A-(aq)+H2O(l)HA(aq)+OH-(aq) K h=错误!=K w/K aM m A n的饱和溶液:K sp=c m(M n+)·c n(A m-)影响因素只与温度有关只与温度有关,升温,K值增大只与温度有关,温度升高,K w增大温度(升温,K h增大)只与难溶物的种类和温度有关一、化学平衡常数常考题型(1)求解平衡常数;(2)由平衡常数计算初始(或平衡)浓度;(3)计算转化率(或产率);(4)应用平衡常数K判断平衡移动的方向(或放热、吸热等情况)注意事项从基础的地方入手,如速率计算、“三阶段式”的运用、阿伏加德罗定律及其推论的应用、计算转化率等,这些都与化学平衡常数密不可分(严格讲电离平衡、水解平衡、沉淀溶解平衡也是化学平衡,只是在溶液中进行的特定类型的反应而已),要在练习中多反思,提高应试能力高炉炼铁过程中发生的主要反应为13Fe2O3(s)+CO(g)23Fe(s)+CO2(g)。

高三化学二轮复习—三大平衡常数1、理解化学平衡常数、电离平衡常数、溶度积的含义,会书写相应的表达式。
2、能利用化学平衡常数进行简单的计算。
3、知道平衡常数的应用。
一、自主复习: 1、平衡常数表达式:对于可逆反应:a A(g)+ b B(g) c C(g)+d D(g),其中a 、b 、c 、d 分别表示化学方程式中各反应物和生成物的化学计量数。
当在一定温度下达到化学平衡时,这个反应的平衡常数表达式为: 如CH 3COOH CH 3COO -+ H +,电离平衡常数 。
Fe(OH)3(s) Fe 3+(aq )+ 3OH -(aq ), 溶度积常数 。
2、平衡常数的意义:(1)化学平衡常数K 的大小能说明反应进行的程度(也叫反应的限度)。
K 值越大,表明反应进行得越 ;K 值越小,表示反应进行得越 。
(2)弱酸、弱碱的电离常数能够反映弱酸、弱碱酸碱性的相对强弱。
电离常数越大,弱酸(碱)的酸(碱)性越 , 反之,则越 。
(3)难溶电解质的K sp 的大小反映了难溶电解质在水中的溶解能力。
思考:根据下表的数据可以出什么结论? 结论:Ksp 和S 均可衡量物质在水中的溶解能力,只有相同类型的物质才有Ksp 越大S 越 的结论。
3、平衡常数的影响因素:平衡常数只与 有关。
若正反应是吸热反应,升高温度,K ;若正反应是放热反应,升高温度,K 。
二、平衡常数的应用1、利用K 值判断反应的热效应例1、现代炼锌的方法可分为火法和湿法两大类。
火法炼锌是将闪锌矿(主要含ZnS )通过浮选、焙烧使它转化为氧化锌,再把氧化锌和焦炭混合,在鼓风炉中加热至1373-1573K ,使锌蒸馏出来。
主要反应为:①焙烧炉中:2ZnS+3O 2=2ZnO+2SO 2 ②鼓风炉中:2C+O 2=2CO ③鼓风炉中:ZnO (s )+CO (g ) Zn(g)+CO 2(g )⑴请写出反应③的平衡常数表达式K= ,⑵若在其它条件不变时,在鼓风炉中增大CO 的浓度,平衡将向 移动,此时平衡常数 (填“增大”、“减小”或“不变”)。

【高中化学】15 16高考化学复习化学平衡常数知识点总结【高中化学】15-16高考化学复习化学平衡常数知识点总结平衡常数一般包括浓度平衡常数和压力平衡常数。
以下是化学平衡常数知识的总结。
请及时学习。
1、化学平衡常数(1)化学平衡常数的化学表达式(2)化学平衡常数表示的意义平衡常数的大小可以反映可逆反应的程度。
K值越大,反应越完整,反应物转化率越高,反之亦然。
2、有关化学平衡的基本计算(1)物质浓度的变化关系反应物:平衡浓度=起始浓度-转化浓度产品:平衡浓度=初始浓度+转化浓度其中,各物质的转化浓度之比等于它们在化学方程式中物质的计量数之比。
(2)反应转化率():=100%(3)在密闭容器中有气体参加的可逆反应,在计算时经常用到阿伏加德罗定律的两个推论:恒温恒容:恒温恒压:N1/N2=V1/V2(4)计算模式浓度(或物质量)AA(g)+BB(g)CC(g)+DD(g)起始mnoo转换为axbxcxdx平衡m-axn-bxcxdx(a) =(ax/m)100%(c)=100%(3)化学平衡计算的关键是准确掌握相关的基本概念及其相互关系。
化学平衡的计算步骤通常是写出相关的化学方程式,列出反应开始或平衡时相关物质的浓度或数量,然后通过相关转换计算其他物质的浓度或数量及转化率。
可以概括为:建立问题解决模式,建立平衡状态方程。
解释:①反应起始时,反应物和生成物可能同时存在;② 由于初始浓度是人为控制的,不同物质的初始浓度不一定是化学计量比。
如果反应物的初始浓度呈现化学计量比,则意味着反应物的转化率相等,并且反应物的浓度在平衡时成为化学计量比。
③起始浓度,平衡浓度不一定呈现计量数比,但物质之间是按计量数反应和生成的,故各物质的浓度变化一定成计量数比,这是计算的关键。
这里分享了化学平衡常数知识点的总结。
请注意更多内容高考化学知识点专栏。



五大平衡常数 专题平衡常数影响因素:所有平衡常数K 、K a 、K b 、K w 、K h 、K sp ,都只与温度和本身性 一、化学平衡常数可逆反应达到平衡后的体系中,m A(g)+n B(g)⇌p C(g)+q D(g) 表达式 K =)B ()A ()D ()C (n m q p c c c c ⋅⋅①T 升高,K 增大,则正反应吸热;T 升高,K 减小,正反应放热。
②Q c K ,反应向正方向进行;Q c =K ,反应刚好达到平衡; Q cK,反应向逆方向进行。
③同一个反应,正逆平衡常数乘积为1, K (正)·K (逆)=1 ④化学计量数均扩大n 倍或缩小为,则K '=K n或K '= ⑤几个不同的可逆反应,Ⅲ式=Ⅰ式+Ⅱ式,则K Ⅲ=K Ⅰ·K Ⅱ。
或Ⅲ式=Ⅰ式-Ⅱ式,则K Ⅲ=常考点:(1)化学平衡常数表达式; (2)化学平衡常数的计算;(3)由化学平衡常数计算初始浓度或平衡浓度; (4)计算反应物的平衡转化率或生成物的产率;(5)用化学平衡常数K 判断平衡移动的方向、反应的热效应等。
二、电离平衡常数弱酸的电离平衡中,HA ⇌H ++A -表达式 K a =)HA ()A ()H (c c c —⋅+弱碱的电离平衡中,BOH ⇌B ++OH -表达式 K b =)BOH ()OH ()B (c c c —⋅+①T 升高,K 增大;电离是吸热的;②K 越大,酸的酸性或碱的碱性相对越强;反之,K 越小,酸的酸性或碱的碱性相对越弱。
③多元酸的K a1>>K a2>>K a3。
主要考查点:(1)直接计算电离平衡常数、水解平衡常数;(2)由电离平衡常数、水解平衡常数推断弱酸、弱碱的相对强弱或浓 度;(3)由K a 、K b 或K h 计算pH;(4)K a 、K b 、K h 、K W 之间的定量关系。
三、水的离子积常数(1)纯水以及电解质水溶液中;H 2O ⇌H ++OH —或H 2O+H 2O ⇌H 3O ++OH —表达式K W =c (OH -)·c (H +) (2)拓展应用在液氨、H 2O 2、乙醇等的自偶电离平衡中。

高考化学试题中的五大常数一、考查化学平衡常数1. 考点精析(1)对于一般的可逆反应:mA(g)+ nB(g)pC(g)+qD(g),其中m、n、p、q分别表示化学方程式中个反应物和生成物的化学计量数。
当在一定温度下达到化学平衡时,这个反应的平衡常数公式可以表示为:,各物质的浓度一定是平衡..时的浓度,而不是其他时刻的。
据此可判断反应进行的程度:K值越大,正反应进行的程度越大,反应物的转换率越高;K值越小,正反应进行的程度越下,逆反应进行的程度越大,反应物的转换率越低。
(2)在进行K值的计算时,固体和纯液体的浓度可视为“1”。
例如:Fe3O4(s)+4H2(g)3Fe(s)+4H2O(g),在一定温度下,化学平衡常数。
(3)利用K值可判断某状态是否处于平衡状态。
例如,在某温度下,可逆反应mA(g)+nB(g)pC(g)+qD(g),平衡常数为K。
,在一定的温度下的任意时刻,反应物的浓度和生成物的浓度有如下关系:,叫该反应的浓度商。
则有以下结论:<K,V(正)>V(逆),可逆反应向正反应方向进行;=K,V(正)=V(逆),可逆反应处于化学平衡状态;>K,V(正)<V(逆),可逆反应向逆反应方向进行。
(4)化学平衡常数是指某一具体化学反应的平衡常数,当化学反应方程式的计量数增倍或减倍时,化学平衡常数也相应的发生变化。
(5)当化学反应方程式的计量数一定时,化学平衡常数只与温度有关。
2.考题例析【例1】(2011福建高考题)25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq)Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如下图所示。
下列判断正确的是( )A .往平衡体系中加入金属铅后,c(Pb 2+)增大B .往平衡体系中加入少量Sn(NO 3)2固体后,c(Pb 2+)变小C .升高温度,平衡体系中c(Pb 2+)增大,说明该反应△H >0D .25℃时,该反应的平衡常数K =2.2解析:此题是新情景,考查平衡移动原理以及平衡常数计算等核心知识,只要基础扎实都能顺利作答。

五大平衡常数二轮复习备考策略团风中学一:五大平衡常数①:化学平衡常数②:弱电解质电离平衡常数③:水的离子积常数④:盐类水解平衡常数⑤:难溶电解质的溶度积常数五大平衡常数的两个意义五大平衡常数的考点化学平衡常数考查①判断放热还是吸热反应程度②判断反应的方向平衡状态③平衡常数与速率常数之间的关系概念④平衡常数相互之间转化概念⑤单一化学平衡“三段式”计算平衡状态⑥多平衡体系,平衡常数的计算平衡状态电离平衡常数考查①判断弱酸、弱碱的性质强弱电离程度②电离平衡常数,水的离子积常数,水解平衡常数三者之间的转化概念③根据溶液中粒子浓度计算电离平衡常数平衡状态④根据图象中节点或曲线的交点计算电离平衡常数平衡状态反映程度反映平衡状态水的离子积常数考查计算溶液中C(H+)或C(OH-)大小或水电离出的C(H+)或C(OH-)大小平衡状态水解平衡常数考查①比较酸根或者金属阳离子水解程度大小水解程度②判断溶液的酸碱性程度③比较溶液中离子浓度大小平衡状态溶度积常数考查①判断是否沉淀平衡状态②判断沉淀先后顺序溶解程度③计算溶液的PH平衡状态二:五大平衡常数的高考考情1:五大平衡常数在高考中出现的题型题型1:选择题水溶液离子平衡图像题题型2:大题化工流程题题型3: 大题化学反应原理题2:高考真题案例分析(1)选择题水溶液离子平衡图像题(2021·湖北·统考高考真题)常温下,已知H3PO3溶液中含磷物种的浓度之和为0.1mol·L-1,溶液中各含磷物种的pc—pOH关系如图所示。
图中pc表示各含磷物种的浓度负对数(pc=-lgc),pOH表示OH-的浓度负对数[pOH=-lgc(OH-)];x、y、z三点的坐标:x(7.3,1.3),y(10.0,3.6),z(12.6,1.3)。
下列说法正确的是A .曲线①表示pc(H 3PO 3)随pOH 的变化B .H 3PO 3的结构简式为C .pH=4的溶液中:c (H 2PO 3-)<0.1mol·L -1-2c (HPO 23-) D.H 3PO 3+HPO 23-2H 2PO 3-的平衡常数K >1.0×105(2022·湖北·统考高考真题)下图是亚砷酸3As OH 和酒石酸()2a1a2H T, lgK =-3.04, lgK =-4.37混合体系中部分物种的c-pH 图(浓度:总As 为-4-15.010mol L ⨯,总T 为-3-11.010mol L ⨯)。

五大平衡常数 专题平衡常数影响因素:所有平衡常数K 、K a 、K b 、K w 、K h 、K sp ,都只与温度和本身性 一、化学平衡常数可逆反应达到平衡后的体系中,m A(g)+n B(g)⇌p C(g)+q D(g) 表达式 K =)B ()A ()D ()C (n m q p c c c c ⋅⋅①T 升高,K 增大,则正反应吸热;T 升高,K 减小,正反应放热。
②Q c <K ,反应向正方向进行; Q c =K ,反应刚好达到平衡; Q c >K ,反应向逆方向进行。
③同一个反应,正逆平衡常数乘积为1, K (正)·K (逆)=1 ④化学计量数均扩大n 倍或缩小为1n ,则K '=K n或K '=K 1n⑤几个不同的可逆反应,Ⅲ式=Ⅰ式+Ⅱ式,则K Ⅲ=K Ⅰ·K Ⅱ。
或Ⅲ式=Ⅰ式-Ⅱ式,则K Ⅲ=K IK II常考点:(1)化学平衡常数表达式; (2)化学平衡常数的计算;(3)由化学平衡常数计算初始浓度或平衡浓度; (4)计算反应物的平衡转化率或生成物的产率;(5)用化学平衡常数K 判断平衡移动的方向、反应的热效应等。
二、电离平衡常数弱酸的电离平衡中,HA ⇌H ++A -表达式 K a =)HA ()A ()H (c c c —⋅+弱碱的电离平衡中,BOH ⇌B ++OH -表达式 K b =)BOH ()OH ()B (c c c —⋅+①T 升高,K 增大;电离是吸热的;②K 越大,酸的酸性或碱的碱性相对越强;反之,K 越小,酸的酸性或碱的碱性相对越弱。
③多元酸的K a1>>K a2>>K a3。
主要考查点:(1)直接计算电离平衡常数、水解平衡常数;(2)由电离平衡常数、水解平衡常数推断弱酸、弱碱的相对强弱或浓 度;(3)由K a 、K b 或K h 计算pH;(4)K a 、K b 、K h 、K W 之间的定量关系。

高中化学五大平衡常数高中化学中常见的五大平衡常数是酸碱离子对的离解常数(Ka)、酸碱指数(pKa)、溶解度积常数(Ksp)、物质转化平衡常数(Kc)和气体混合物转化平衡常数(Kp)。
下面将详细介绍这五个平衡常数及其在化学反应中的作用。
一、酸碱离子对的离解常数(Ka):酸碱反应是化学中广泛存在的一种反应类型,它涉及到酸、碱及其离子之间的相互转化。
当酸溶液中的酸分子与水分子发生反应,产生氢离子(H+)时,称为强酸。
而酸溶液中的酸分子与水分子不发生反应,酸分子直接释放H+离子时,称为弱酸。
离解常数Ka表示弱酸分子在溶液中与水发生反应生成H+离子的程度。
Ka越大,说明酸性越强。
二、酸碱指数(pKa):酸碱指数是对弱酸或弱碱的酸碱强度的度量。
pKa与Ka之间的关系为:pKa = -log10(Ka)。
pKa越小,酸性越强。
三、溶解度积常数(Ksp):溶解度是指物质在给定温度和压力下能溶解在溶剂中的最大量。
溶解度积常数Ksp描述了溶质离解为离子的程度。
当溶液中的离子浓度达到溶解度积常数时,溶质已经溶解到了饱和状态。
Ksp越大,溶解度越大。
四、物质转化平衡常数(Kc):物质转化平衡常数描述了化学反应中物质转化的程度。
对于一个化学反应:aA + bB ↔ cC + dD,其平衡常数Kc为:Kc = [C]^c[D]^d / [A]^a[B]^b,其中[]表示浓度。
Kc的大小与反应前后各组分的浓度有关,当Kc>1时,反应倾向于生成产物;当Kc<1时,反应倾向于反应物。
五、气体混合物转化平衡常数(Kp):当化学反应中涉及气体组成时,可以使用气体混合物转化平衡常数Kp来描述反应的平衡状态。
Kp采用的是压强单位(单位为帕斯卡),与Kc之间的关系为:Kp =Kc (RT)^Δn,其中R为气体常数,T为温度,Δn为所生成的气体分子数减去反应物的气体分子数。
Kp与压强相关,与浓度无关。
综上所述,酸碱离子对的离解常数(Ka)、酸碱指数(pKa)、溶解度积常数(Ksp)、物质转化平衡常数(Kc)和气体混合物转化平衡常数(Kp)分别描述了化学反应中酸碱离子对的离解程度、酸碱强度、固体溶解度、物质转化程度和气体反应平衡状态。

2020届高三化学二轮复习知识讲练——化学平衡常数及转化率、产率的相关计算温故知新]1.化学平衡常数(1)意义:化学平衡常数K表示反应进行的程度,K越大,反应进行的程度越大。
K>105时,可以认为该反应已经进行完全。
K的大小只与温度有关。
(2)化学平衡常数表达式:对于可逆化学反应m A(g)+n B(g)⇌p C(g)+q D(g)在一定温度下达到化学平衡时,K=c p(C)·c q(D)c m(A)·c n(B)。
另可用压强平衡常数表示:K p=p p(C)·p q(D)p m(A)·p n(B)[p(C)为平衡时气体C的分压]。
(3)依据化学方程式计算平衡常数①同一可逆反应中,K正·K逆=1。
②同一方程式中的化学计量数等倍扩大或缩小n倍,则新平衡常数K′与原平衡常数K间的关系是K′=K n或K′=n K。
③几个可逆反应方程式相加,得总方程式,则总反应的平衡常数等于各分步反应平衡常数之积。
2.转化率、产率及分压的计算 反应物转化率=反应物的变化量反应物的起始量×100%产物的产率=生成物的实际产量生成物的理论产量×100%分压=总压×物质的量分数 3.常用的气体定律同温同体积:p (前)∶p (后)=n (前)∶n (后) 同温同压强:ρ(前)ρ(后)=M (前)M (后)=V (后)V (前)=n (后)n (前)[真题感悟]1.(2019·海南,14)由γ羟基丁酸生成γ丁内酯的反应如下:在298 K 下,γ羟基丁酸水溶液的初始浓度为0.180 mol·L -1,测得γ丁内酯的浓度随时间变化的数据如表所示。
回答下列问题:(1)该反应在50~80 min 内的平均反应速率为________mol·L -1·min -1。
(2)120 min 时γ羟基丁酸的转化率为________。
2020年高三化学下学期二轮提升训练:——溶液中“四大平衡常数”的理解和应用【知识补漏】1.三大平衡常数对比电离平衡水解平衡沉淀溶解平衡举例NH3·H2O NH+4+OH-NH+4+H2ONH3·H2O+H+PbI2(s)Pb2+(aq)+2I-(aq)平衡表达式Kb=c NH+4·c OH-c NH3·H2OKb=错误!Ksp=c(Pb2+)·c2(I-)影响平衡常数的因素内因:弱电解质的相对强弱外因:温度,温度越高,电离程度越大,平衡常数越大盐的水解程度随温度的升高而增大,K b随温度的升高而增大内因:难溶电解质在水中的溶解能力外因:K sp与温度有关浓度对平衡的影响电离平衡、水解平衡、沉淀溶解平衡同化学平衡一样都为动态平衡,平衡的移动符合平衡移动原理(勒夏特列原理),浓度对平衡常数没影响①加水均能促进三大平衡正向移动;②加入与电解质溶液中相同的微粒,都能使平衡逆向移动;③三大平衡都不受压强的影响。
2.“三大常数”间的两大等式关系(1)CH3COONa、CH3COOH溶液中,K a、K h、K w的关系是K w=K a·K h。
(2)M(OH)n悬浊液中K sp、K w、pH间关系,M(OH)n(s)M n+(aq)+n OH-(aq)Ksp =c(M n+)·c n(OH-)=c OH-n·c n(OH-)=c n+1OH-n=1n⎝⎛⎭⎪⎫K w10-pHn+1。
3.溶液中的“四大常数”使用常见的错误(1)K a、K h、K w、K sp数值不随其离子浓度的变化而变化,只与温度有关,K a、Kh、K w随着温度的升高而增大。
在温度一定时,平衡常数不变,与化学平衡是否移动无关。
(2)K w常误认为是水电离的c(H+)与c(OH-)的乘积。
(3)只有常温下水的离子积K w=1.0×10-14 mol2·L-2(4)误认为只要K sp越大,其溶解度就会越大。
高考化学2019第二轮复习化学平衡常数知识点总结平衡常数一般有浓度平衡常数和压强平衡常数。
以下是化学平衡常数知识点总结,请考生认真学习。
1、化学平衡常数(1)化学平衡常数的化学表达式(2)化学平衡常数表示的意义平衡常数数值的大小可以反映可逆反应进行的程度大小,K 值越大,反应进行越完全,反应物转化率越高,反之则越低。
2、有关化学平衡的基本计算(1)物质浓度的变化关系反应物:平衡浓度=起始浓度-转化浓度生成物:平衡浓度=起始浓度+转化浓度其中,各物质的转化浓度之比等于它们在化学方程式中物质的计量数之比。
(2)反应的转化率():= 100%(3)在密闭容器中有气体参加的可逆反应,在计算时经常用到阿伏加德罗定律的两个推论:恒温、恒容时:恒温、恒压时:n1/n2=V1/V2(4)计算模式浓度(或物质的量) aA(g)+bB(g) cC(g)+dD(g)起始 m n O O转化 ax bx cx dx平衡 m-ax n-bx cx dx(A)=(ax/m)100%(C)= 100%(3)化学平衡计算的关键是准确掌握相关的基本概念及它们相互之间的关系。
化学平衡的计算步骤,通常是先写出有关的化学方程式,列出反应起始时或平衡时有关物质的浓度或物质的量,然后再通过相关的转换,分别求出其他物质的浓度或物质的量和转化率。
概括为:建立解题模式、确立平衡状态方程。
说明:①反应起始时,反应物和生成物可能同时存在;②由于起始浓度是人为控制的,故不同的物质起始浓度不一定是化学计量数比,若反应物起始浓度呈现计量数比,则隐含反应物转化率相等,且平衡时反应物的浓度成计量数比的条件。
③起始浓度,平衡浓度不一定呈现计量数比,但物质之间是按计量数反应和生成的,故各物质的浓度变化一定成计量数比,这是计算的关键。
高考化学2019第二轮复习化学平衡常数知识点总结的内容就是这些,查字典化学网预祝考生可以考上理想的大学。