提分练06 电极反应式书写(解析版)
- 格式:doc
- 大小:864.00 KB
- 文档页数:10

原电池电极反应式的书写一、一次电池1、伏打电池:(负极—Zn,正极—Cu,电解液—H2SO4)负极:正极:总反应离子方程式2、铁碳电池:(负极—Fe,正极—C,电解液——NaCl溶液)负极:正极:总反应化学方程式:, , (铁锈的生成过程) 3.铝镍电池:(负极—Al,正极—Ni,电解液——NaCl溶液)负极:正极:总反应化学方程式:(海洋灯标电池)4、铝–空气–海水(负极--铝,正极--石墨、铂网等能导电的惰性材料,电解液--海水)负极:正极:总反应式为:(铂网增大与氧气的接触面)(海洋灯标电池)5、普通锌锰干电池:(负极——Zn,正极——碳棒,电解液——NH4Cl糊状物)负极:正极:2MnO2+2NH4++2e-==Mn2O3 +2NH3+H2O总反应化学方程式:Zn+2NH4Cl+2MnO2=ZnCl2+Mn2O3+2NH3+H2O6、碱性锌锰干电池:(负极——Zn,正极——碳棒,电解液KOH糊状物)负极:正极:2MnO2 + 2H2O + 2e-==2MnO(OH) +2OH-总反应化学方程式:Zn +2MnO2 +2H2O == Zn(OH)2 + MnO(OH)7、银锌电池:(负极——Zn,正极--Ag2O,电解液NaOH )负极:正极:总反应化学方程式:Zn + Ag2O == ZnO + 2Ag8、镁铝电池:(负极--Al,正极--Mg,电解液KOH)负极(Al):正极(Mg):总反应化学方程式:二、特殊情况电极反应式的书写1、注意电解质溶液的改变会引起电极正负的改变在原电池中,一般较活泼金属作负极,但当电解质溶液发生改变时,较活泼金属就不一定作负极了。
将铜片和铝片用导线相连,分别同时插入稀H2SO4和浓HNO3中,写出两池的电极反应式。
在稀H2SO4作电解质溶液的原电池中负极(Al):;正极(Cu):。
在浓HNO3作电解质溶液的原电池中负极(Cu):;正极(Al):总反应离子方程式2、注意电解质溶液的酸碱性改变会引起电极反应的改变将铜片和铝片用导线相连的原电池,电解质为KOH溶液负极:;正极:。

高中常见的原电池、电解池电极反应式的书写练习一、一次电池1、伏打电池:(负极一Zn,正极一3,电解液一H2SO4)负极:正极:总反应离子方程式Zn + 2H+== Hj+ Zn2+2、铁碳电池(析氢腐蚀):(负极一Fe,正极一酬电解液一酸性)负极:正极:总反应离子方程式Fe+2H+==Hj+Fe2+3、铁碳电池(吸氧腐蚀):(负极一Fe,正极一勒电解液一中性或碱性)负极:正极:总反应化学方程式:2Fe+O2+2H2O==2Fe(OH)2 ;(铁锈的生成过程)4.铝镍电池:(负极一Al,正极一即,电解液一NaCl溶液)负极:正极:总反应化学方程式:4Al+3O2+6H2O==4Al(OH)3(海洋灯标电池)5、普通锌锰干电池:(负极一一Zn,正极一一碳棒,电解液一一NH4cl糊状物)负极:正极:总反应化学方程式:Zn+2NH4cl+2MnO2=ZnCl2+Mn2O3+2NH3+H2O6、碱性锌锰干电池:(负极一一Zn,正极一一碳棒,电解液KOH糊状物)负极:正极:总反应化学方程式:Zn +2MnO2+2H2O == Zn(OH)2 + MnO(OH)7、银锌电池:(负极一一Zn,正极--Ag2O,电解液NaOH )负极:正极:总反应化学方程式:Zn + Ag2O == ZnO + 2Ag8、镁铝电池:(负极--Al,正极--Mg,电解液KOH)负极(Al):正极(Mg):总反应化学方程式:2Al + 2OH- + 6HO = 2 [Al (OH) 1 -+ 3H T 2 429、高铁电池(负极--Zn,正极--碳,电解液KOH和K2FeO4)正极:负极:放电、2 4 2,充电 23 10、镁/乩02酸性燃料电池正极:负极:总反应化学方程式:Mg+ H2sO4+H2O2=MgSO4+2H2O二、充电电池1、铅蓄电池:(负极一Pb正极一PbO2电解液一稀硫酸)负极:正极:总化学方程式Pb+PbO2 + 2H2sO4==2PbsO4+2H2O2、镍镉电池(负极--Cd、正极一400乩电解液:KOH溶液)放电时负极:正极:总化学方程式Cd + 2NiOOH + 2H2O===Cd(OH)2 + 2Ni(OH)2 三、燃料电池1、氢氧燃料电池:总反应方程式:2H2 + O2 === 2H2O(1)电解质是KOH溶液(碱性电解质)负极:正极:(2)电解质是乩504溶液(酸性电解质)负极:正极:(3)电解质是脂。

高中化学高考总复习--电极反应式的书写知识讲解及巩固练习题(含答案解析)【考纲要求】1.理解原电池的工作原理并正确书写各种化学电源的电极反应和总反应方程式;2.理解电解池的工作原理并正确书写电极反应和总反应方程式。
【考点梳理】【高清课堂:399199电极反应式的书写】考点一:正确书写原电池的电极反应式1.先确定原电池的正负极,列出正、负电极上的反应物质,在等式的两边分别写出反应物和生成物。
要点诠释:一般来说,较活泼的金属失去电子,为原电池的负极,但不是绝对的。
如镁片和铝片插入氢氧化钠溶液中组成的原电池虽然镁比铝活泼,但由于铝和氢氧化钠溶液反应失去电子被氧化,因而铝是负极,此时的电极反应为:负极:2Al-6e-===2Al3+正极:6H2O+6e-==6OH-+3H2↑或2Al3++2H2O+6e-+2OH-==2AlO2-+3H2↑再如,将铜片和铝片同时插入浓硝酸中组成原电池时,由于铝在浓硝酸中发生了钝化,铜则失去电子、作原电池的负极被氧化,此时的电极反应为:负极:Cu-2e-===Cu2+正极:2NO3-+4H++2e-===2NO2↑+2H2O2.要注意电解质溶液的酸碱性:要点诠释:在正负极上发生的电极反应不是孤立的,它往往与电解质溶液紧密联系。
如氢-氧燃料电池就分酸式和碱式两种, 如果是在碱性溶液中,则不可能有H+出现,同样在酸性溶液中,也不能出现OH-。
在酸性溶液中: 负极:2H2-4e-===4H+; 正极:O2+4H++4e-===2H2O 在碱性溶液中: 负极:2H2-4e-+4OH—===4H2O; 正极:O2+2H2O+4e-=4OH—。
3.要注意电子转移的数目要点诠释:在同一个原电池中,负极失去电子的总数一定等于正极得到电子的总数,所以在书写电极反应式时,要注意正负极得失电子相等。
这样可避免在由电极反应式写总反应方程式或由总方程式改写电极反应式时所带来的失误。
4.电极反应式的书写必须遵循离子方程式的书写要求:要点诠释:①电极反应式等式的两边原子数目及电荷必须守恒。

电极反应式书写练习童建军1、若以熔融K2CO3与CO2为反应的环境,依据反应2CO(g)+O2(g)==2CO2(g)设计成一个原电池,请写出该原电池的负极反应:_______________________。
【解题指导】(1)由原电池构成基本原理确定电极反应物:原电池负极还原剂放电,发生氧化反应,由方程式可知,还原剂CO在负极放电,氧化剂O2在正极放电。
(2)由介质确定电极反应生成物:电解质为熔融K2CO3,放电过程中移动的离子为K+和CO32—,由此可确定负极反应式为:CO-2e-+CO2-3===2CO2,正极反应式为:O2+4 e-+2CO2===2 CO2-3。
2、人工光合作用能够借助太阳能使CO2和H2O制备有机物。
如图是人工光合作用制备HCOOH的原理示意图,在催化剂a表面的电极反应是;催化剂b表面的电极反应是。
【解题指导】(1)由原电池的离子迁移方向定电极反应物:在原电池中阳离子向正极移动、阴离子向负极移动、电子由负极向正极移动。
由图电子或H+移动方向可知,a为负极,b为正极。
(2)由题设信息确定电极反应生成物:由CO2→HCOOH可知,C元素化合价由+4降低到+2,CO2做氧化剂在正极放电,那么H2O应该在负极失去电子发生氧化反应生成氧气。
由题给图示可知这是一个酸性电池,电荷守恒及原子个数守恒应该由H+和H2O维持。
由此可确定负极反应式为:2H2O-4e—=O2↑+4H+,正极反应式为:CO2+2H++2e-=HCOOH。
3、镁-过氧化氢酸性燃料电池的正极反应式为;镁-次氯酸盐燃料电池工作原理如图所示。
电池的总反应式为。
【解题指导】(1)由物质本性定原电池电极反应物:由物质本性可知Mg为还原剂,做负极,氧化氢和次氯酸盐分别在正极放电生成水和氯离子。
(2)由介质及共存关系定电极反应生成物:镁-过氧化氢酸性燃料电池是酸性介质,Mg放电生成Mg2+,镁-次氯酸盐燃料电池是碱性介质,在碱性条件下Mg2+与OH—反应生成Mg(OH)2沉淀。
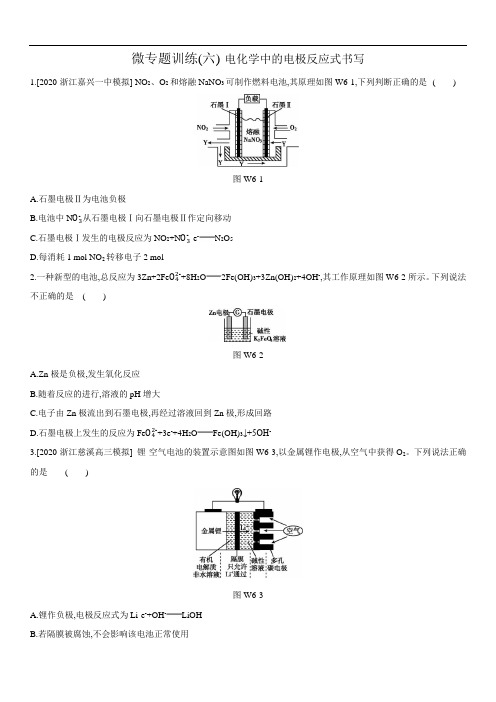
微专题训练(六)电化学中的电极反应式书写1.[2020·浙江嘉兴一中模拟] NO2、O2和熔融NaNO3可制作燃料电池,其原理如图W6-1,下列判断正确的是()图W6-1A.石墨电极Ⅱ为电池负极B.电池中N O3-从石墨电极Ⅰ向石墨电极Ⅱ作定向移动C.石墨电极Ⅰ发生的电极反应为NO2+N O3--e-N2O5D.每消耗1 mol NO2转移电子2 mol2.一种新型的电池,总反应为3Zn+2Fe O42-+8H2O2Fe(OH)3+3Zn(OH)2+4OH-,其工作原理如图W6-2所示。
下列说法不正确的是()图W6-2A.Zn极是负极,发生氧化反应B.随着反应的进行,溶液的pH增大C.电子由Zn极流出到石墨电极,再经过溶液回到Zn极,形成回路D.石墨电极上发生的反应为Fe O42-+3e-+4H2O Fe(OH)3↓+5OH-3.[2020·浙江慈溪高三模拟] 锂-空气电池的装置示意图如图W6-3,以金属锂作电极,从空气中获得O2。
下列说法正确的是()图W6-3A.锂作负极,电极反应式为Li-e-+OH-LiOHB.若隔膜被腐蚀,不会影响该电池正常使用C.多孔碳电极上发生的电极反应为O2+2H2O+4e-4OH-D.应用该电池电镀铜,若析出64 g Cu,理论上消耗11.2 L O24.2019年诺贝尔化学奖授予在锂电池发展上做出贡献的三位科学家。
某可连续工作的液流锂离子储能电池放电时工作原理如图W6-4所示,下列说法正确的是()图W6-4A.放电时,储罐中发生反应:S2O82-+2Fe2+2Fe3++2S O42-B.放电时,Li电极发生了还原反应C.放电时,Ti电极发生的电极反应式为Fe2+-e-Fe3+D.Li+选择性透过膜可以通过Li+和H2O5.将CH4设计成燃料电池,其利用率更高,装置如图W6-5所示(A、B为多孔性碳棒),持续通入甲烷,在标准状况下,消耗甲烷体积为V L。

——陌生非氧化还原反应方程式的书写【提分训练】1.Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备,工艺流程如下:回答下列问题:“酸浸”后,钛主要以TiOCl2-4形式存在,写出相应反应的离子方程式:__________________________________________________________ _________。
[解题思路]第一步:依据题意写出主要反应物及生成物。
用盐酸溶解FeTiO3,反应后钛主要以TiOCl2-4形式存在,则Fe+2Ti+4O3―→Ti+4 OCl2-4。
第二步:依据质量守恒和电荷守恒完成方程式。
①经分析,反应物中有氯元素,产物中有铁元素,且钛元素的价态未变化,可知左边应加上Cl-右边生成Fe2+:FeTiO3+Cl-―→TiOCl2-4+Fe2+。
②左边比右边多两个氧原子,且左边电荷数为-1,右边电荷数为0,题中加了盐酸,可知左边还应补充H+,右边生成H2O:FeTiO3+H++Cl-―→Fe2++TiOCl2-4+H2O。
依据右边有4个氯原子,可知左边Cl-前的系数为4,铁原子与钛原子个数相等,右边电荷数为0,可知H+的系数为4,H2O前的系数为2。
[答案] FeTiO3+4H++4Cl-===Fe2++TiOCl2-4+2H2O2.(1)下图所示为提纯白磷样品(含惰性杂质)的工艺流程。
过程Ⅰ中,被还原的元素是________(填元素符号),过程Ⅲ的化学方程式为__________________________________________________________ __________。
(2)磷酸钒锂/碳复合材料[Li3V2(PO4)3/C]是常用的电极材料,其制备流程如下:①复合材料中V的化合价为________,C的作用是__________________________________________________________ __________________________________。
原电池电极反应式的书写专题训练1、伏打电池:(负极—Zn,正极—Cu,电解液—H2SO4)负极:正极:总反应离子方程式Zn + 2H+ == H2↑+ Zn2+负极:Zn–2e-==Zn2+正极:2H++2e-==H2↑2、铁碳电池(析氢腐蚀):(负极—Fe,正极—C,电解液——酸性)负极:正极:总反应离子方程式Fe+2H+==H2↑+Fe2+负极:Fe–2e-==Fe2+正极:2H++2e-==H2↑3、铁碳电池(吸氧腐蚀):(负极—Fe,正极—C,电解液——中性或碱性)负极:正极:总反应化学方程式:2Fe+O2+2H2O==2Fe(OH)2;(铁锈的生成过程) 负极:2Fe–4e-==2Fe2+正极:O2+2H2O+4e-==4-OH4Fe(OH)2+O2+2H2O==4Fe(OH)3 ;2Fe(OH)3==Fe2O3 +3 H2O4.铝镍电池:(负极—Al,正极—Ni,电解液——NaCl溶液)负极:正极:总反应化学方程式:4Al+3O2+6H2O==4Al(OH)3 (海洋灯标电池)负极:4Al–12e-==4Al3+正极:3O2+6H2O+12e-==12-OH5、普通锌锰干电池:(负极——Zn,正极——碳棒,电解液——NH4Cl糊状物)负极:正极:总反应化学方程式:Zn+2NH4Cl+2MnO2=ZnCl2+Mn2O3+2NH3+H2O负极:Zn–2e-==Zn2+正极:2MnO2+2NH4++2e-==Mn2O3 +2NH3+H2O6、碱性锌锰干电池:(负极——Zn,正极——碳棒,电解液KOH糊状物)负极:正极:总反应化学方程式:Zn +2MnO2 +2H2O == Zn(OH)2 + MnO(OH)负极:Zn + 2OH– 2e-== Zn(OH)2 正极:2MnO2 + 2H2O + 2e-==2MnO(OH) +2OH-7、银锌电池:(负极——Zn,正极--Ag2O,电解液NaOH )负极:正极:总反应化学方程式:Zn + Ag2O == ZnO + 2Ag负极:Zn+2OH-–2e-== ZnO+H2O 正极:Ag2O + H2O + 2e-== 2Ag + 2OH-8、镁铝电池:(负极--Al ,正极--Mg ,电解液KOH )负极(Al): 正极(Mg ):总反应化学方程式: 2Al + 2OH - + 6H 2O = 2【Al (OH )4】-+ 3H 2↑ 负极(Al): 2Al + 8OH -+6e - = 2【Al (OH )4】- 正极(Mg ): 6H 2O + 6e -= 3H 2↑+6OH – 9、高铁电池 (负极--Zn ,正极--碳,电解液KOH 和K 2FeO 4)正极: 负极:总反应化学方程式:3Zn + 2K 2FeO 4 + 8H 2O 3Zn(OH)2 + 2Fe(OH)3 + 4KOH正极:2FeO 42- + 8H 2O +6e -==2Fe(OH)3 + 4OH – 负极: 3Zn + 6OH – 6e -== 3Zn(OH)2 10、镁/H 2O 2酸性燃料电池正极: 负极:总反应化学方程式:Mg+ H 2SO 4+H 2O 2=MgSO 4+2H 2O镁/H 2O 2酸性燃料电池 正极:2H ++H 2O 2=2H 2O 负极:Mg –2e -== Mg 2+ 11、铅蓄电池:(负极—Pb 正极—PbO 2 电解液— 稀硫酸)负极: 正极:总化学方程式 Pb +PbO 2 + 2H 2SO 4==2PbSO 4+2H 2O负极: Pb -2e -+SO 42-==PbSO 4 正极: PbO 2+2e -+4H ++SO 42-==PbSO 4+2H 2O 12、镍镉电池(负极--Cd 、正极—NiOOH 、电解液: KOH 溶液)放电时负极: 正极:总化学方程式 Cd + 2NiOOH + 2H 2O===Cd(OH)2 + 2Ni(OH)2负极: Cd -2e — + 2 OH – == Cd(OH)2 正极: 2NiOOH + 2e — + 2H 2O == 2Ni(OH)2+ 2OH –13、氢氧燃料电池:总反应方程式: 2H 2 + O 2 === 2H 2O(1)电解质是KOH 溶液(碱性电解质)负极: 正极:2H 2 – 4e - + 4OH — === 4H 2O 正极:O 2 + 2H 2O + 4e -=== 4OH — (2)电解质是H 2SO 4溶液(酸性电解质)负极: 正极:负极:2H 2 –4e - === 4H + 正极:O 2 + 4H + + 4e -=== 2H 2O (3)电解质是NaCl 溶液(中性电解质)负极: 正极:放电充电负极:2H2– 4e-=== 4H+正极:O2 + 2H2O + 4e-=== 4OH—14、甲醇燃料电池(注:乙醇燃料电池与甲醇相似)(1)碱性电解质(铂为两极、电解液KOH溶液)正极:负极:总反应化学方程式:2CH3OH + 3O2 + 4KOH=== 2K2CO3 + 6H2O正极:3O2 + 12e-+ 6H2O=== 12OH-负极:2CH3OH – 12e-+ 16OH—=== 2CO32-+12H2O (2)酸性电解质(铂为两极、电解液H2SO4溶液)正极:负极:总反应式2CH3OH + 3O2 === 2CO2 + 4H2O正极:3O2 + 12e-+ 12H+ == 6H2O 负极:2CH3OH –12e-+2H2O==12H++2CO215、CO燃料电池(铂为两极、电解液H2SO4溶液)总反应方程式为:2CO +O2 =2CO2正极:负极:正极:O2 + 4e-+ 4H+ == 2H2O 负极:2CO – 4e-+ 2H2O== 2CO2 +4H+16、甲烷燃料电池(1)碱性电解质(铂为两极、电解液KOH溶液)正极:负极:总反应方程式:CH4 + 2KOH+ 2O2 === K2CO3 + 3H2O正极:2O2 + 4H2O + 8e-== 8OH- 负极:CH4 + 10OH—-8e-== CO32-+ 7H2O(2)酸性电解质(铂为两极、电解液H2SO4溶液)总反应方程式:CH4 + 2O2 === CO2 + 2H2O 正极:负极:正极:2O2 + 8e-+ 8H+ == 4H2O 负极:CH4-8e-+ 2H2O == 8H+ + CO217、肼(N2H4)燃料电池(电解质溶液是20%~30%的KOH溶液)总反应方程式:N2H4+ O2 === N2 +2H2O正极:负极:正极:O2 + 2H2O + 4e-== 4OH- 负极:N2H4+ 4OH—– 4e-=== N2 +2H2O18、H2、Cl2电池(铂为两极,一极为H2,另一极为Cl2,电解质溶液是20%~30%的KOH溶液)正极:负极:总反应方程式:正极:Cl2+ 2e-== 2 Cl-负极:H2+ 2OH—– 2e-===2H2O总反应方程式:Cl2+ H2+ 2OH—==2 Cl-+2H2O19、Ag、Cl2电池(负极—Ag 、正极—铂,通入Cl2,电解液: 1 mol·L-1盐酸)正极:负极:总反应方程式:2Ag+ Cl2==2 Ag Cl正极:Cl2+ 2e-== 2 Cl-负极:2Ag+2 Cl-– 2e ==2 Ag Cl20、H2、N2电池(铂为两极,一极为H2,另一极为N2,电解质溶液是盐酸、氯化铵溶液)正极:负极:总反应方程式:3H2 + N2 +2HCl==2 NH4Cl正极:N2 +8H++ 6e-== 2 NH4+ 负极:3H2– 6e ==6H+21、氢氧电池:一极为H2,另一极为空气与CO2的混合气,电解质为熔融K2CO3(盐)负极:正极:总反应方程式2H2 + O2 === 2H2O负极:2H2– 4e-+2CO32-=== 2CO2↑+2H2O 正极:O2 + 4e-+2CO2 === 2CO32—22、固体酸燃料电池(一极通入空气,另一极通入H2;电解质是CsHSO4固体传递H+)负极:正极:总反应方程式2H2 + O2 === 2H2O负极:2H2–4e-=== 4H+正极:O2 + 4H+ + 4e-=== 2H2O23、新型燃料电池(一极通入空气,另一极通入丁烷气体;电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体)正极:负极:总反应方程式:2C4H10+13O2=8CO2+10H2O正极:13O2+ 52e-==26O2- 负极:2C4H10+26O2- – 52e-==8CO2+10H2O24、CO电池(一极为CO,另一极为空气与CO2的混合气,Li2CO3和Na2CO3的熔融盐作电解质)正极:负极:总反应方程式O2 +2CO==4CO2正极:O2 +4e-+2CO2 =2CO32-负极:2CO+2CO32-– 4e-==4CO225、Li-Al/FeS电池(一级是Li-Al合金,一极是粘有FeS的石墨,电解质是Li2CO3熔融盐)正极:负极:总反应方程式:2Li+FeS=Li2S+Fe正极:2Li++FeS+2e—=Li2S+Fe负极:2Li-2e-=2Li +[练习1] Al和Cu作电极所构成的原电池(1)电解质溶液为稀硫酸:Al作______极, Cu作______极.负极反应____________ 正极反应___________总反应式_____________________(2)电解质溶液为浓硝酸:Al作______极, ②Cu作______极.负极反应____________ 正极反应___________总反应式_____________________(3)电解质溶液为NaOH溶液:①Al作______极, ②Cu作______极,负极反应____________ 正极反应___________总反应式_____________________(4)电解质溶液为NaCl溶液:①Al作______极, ②作Cu ______极.负极反应____________ 正极反应___________总反应式_________________________(5)Al和Mg作电极所构成的原电池, 电解质溶液为NaOH溶液①Al作___极, ②Mg作___极,负极反应____________ 正极反应___________总反应式_________________________[练习2] 丙烷燃料电池(铂为两极、正极通入O2和CO2、负极通入丙烷、电解液有三种)1.电解质是熔融碳酸盐(K2CO3或Na2CO3)负极反应________________ 正极反应________________总电池反应式为2.酸性电解质(电解液H2SO4溶液)负极反应________________ 正极反应________________总电池反应式为3.碱性电解质(铂为两极、电解液KOH溶液)负极反应________________ 正极反应________________总电池反应式为[练习3]乙醇燃料电池(铂为两极、正极通入O2和CO2、负极通入丙烷、电解液有三种)1.酸性电解质(电解液H2SO4溶液)负极反应___________ 正极反应________总电池反应式为2.碱性电解质(铂为两极、电解液KOH溶液)负极反应________________ 正极反应________________总电池反应式为[练习5]铁碳电池(析氢腐蚀):(负极—Fe,正极—C,电解液——酸性)负极反应________________ 正极反应________________总电池反应式为[练习6]铝镍电池:(负极—Al,正极—Ni,电解液——NaCl溶液)负极反应________________ 正极反应________________总电池反应式为[练习7]普通锌锰干电池:(负极——Zn,正极——碳棒,电解液——NH4Cl糊状物)负极反应________________ 正极反应________________总电池反应式为[练习8]肼(N2H4)燃料电池(电解质溶液是硫酸)总反应方程式:N2H4+ O2 === N2 +2H2O 正极:负极:[练习9]H2、N2电池(铂为两极,一极为H2,另一极为N2,电解质溶液是KOH溶液)正极:负极:。
2020届高考化学专项提分练习电化学(含答案)1.针对右图装置的说法中,正确是()A.溶液中pH值明显下降B.铁片为正极,镀锌铁片为负极C.阴极的电极反应式:Fe-2e → Fe2+D.电子由锌经溶液流向铁【答案】B2.以石墨为电极分别电解水和饱和食盐水,关于两个电解池反应的说法正确的是()A.阳极反应式相同B.电解结束后所得液体的pH相同C.阴极反应式相同D.通过相同电量时生成的气体总体积相等(同温同压)【答案】C3.某原电池反应的离子方程式为:Zn + 2H+→ Zn2+ + H2↑,关于此原电池下列说法正确的是()A.HNO3可作电解质溶液B.在电解质溶液中电子从正极流向负极C.锌极质量不变D.该原电池的正极材料可以为铁【答案】D4.如图用石墨电极电解CuCl2溶液。
下列分析正确的是()A.a极发生还原反应B.每生成6.4 g Cu,转移电子0.2 mol++→C.阳极反应式:2Cu2e CuD.在直流电源中电流从b流向a【答案】B5.用石墨电极电解CuCl2溶液(见右图)。
下列分析正确的是()直流电源A.通电使CuCl2发生电离B.a端是直流电源的负极C.阳极上发生的反应:Cu2++2e-→CuD.通电一段时间后,在阴极附近观察到黄绿色气体【答案】B6.将碳棒和铁棒平行插入NaCl溶液,两棒的液面以上部分用铜丝相联并接入电流计,电流计指针偏转。
以下说法正确的是()A.电子自碳棒通过溶液流向铁棒B.电子自铁棒通过铜丝流向碳棒C.溶液中的H+得到电子放出H2D.铜丝失去电子发生氧化反应【答案】B7.石墨作电极电解氯化铜溶液,(右图),下列分析正确的是() A .a 端是直流电源的负极 B .通电使氯化铜发生电离C .阳极上发生的反应:Cu 2++2e→CuD .通电一段时间,在阴极附近观察到有黄绿色气体产生 【答案】A8.右图为阳离子交换膜法电解饱和食盐水原理示意图,其中的阳离子交换膜仅允 许Na +通过。
微专题四步敲定高考新情景电池电极反应式的书写1(2023·全国·统考高考真题)一种以V2O5和Zn为电极、Zn CF3SO32水溶液为电解质的电池,其示意图如下所示。
放电时,Zn2+可插入V2O5层间形成Zn x V2O5⋅nH2O。
下列说法错误的是A.放电时V2O5为正极B.放电时Zn2+由负极向正极迁移C.充电总反应:xZn+V2O5+nH2O=Zn x V2O5⋅nH2OD.充电阳极反应:Zn x V2O5⋅nH2O-2xe-=xZn2++V2O5+nH2O【答案】C【解析】由题中信息可知,该电池中Zn为负极、V2O5为正极,电池的总反应为xZn+V2O5+nH2O=Zn x V2 O5⋅nH2O。
A.由题信息可知,放电时,Zn2+可插入V2O5层间形成Zn x V2O5⋅nH2O,V2O5发生了还原反应,则放电时V2 O5为正极,A说法正确;B.Zn为负极,放电时Zn失去电子变为Zn2+,阳离子向正极迁移,则放电时Zn2+由负极向正极迁移,B说法正确;C .电池在放电时的总反应为xZn +V 2O 5+nH 2O =Zn x V 2O 5⋅nH 2O ,则其在充电时的总反应为Zn x V 2O 5⋅nH 2Ox =Zn +V 2O 5+nH 2O ,C 说法不正确;D .充电阳极上Zn x V 2O 5⋅nH 2O 被氧化为V 2O 5,则阳极的电极反应为Zn x V 2O 5⋅nH 2O -2xe -=xZn 2++V 2O 5+nH 2O ,D 说法正确;综上所述,本题选C 。
2(2023·辽宁·统考高考真题)某低成本储能电池原理如下图所示。
下列说法正确的是A.放电时负极质量减小B.储能过程中电能转变为化学能C.放电时右侧H +通过质子交换膜移向左侧D.充电总反应:Pb +SO 2-4+2Fe 3+=PbSO 4+2Fe2+【答案】B【解析】该储能电池放电时,Pb 为负极,失电子结合硫酸根离子生成PbSO 4,则多孔碳电极为正极,正极上Fe 3+得电子转化为Fe 2+,充电时,多孔碳电极为阳极,Fe 2+失电子生成Fe 3+,PbSO 4电极为阴极,PbSO 4得电子生成Pb 和硫酸。
提分练06电极反应式的书写1.一种利用电化学变色的装置如图所示,其工作原理为:在外接电源下,通过在膜材料内部Li+定向迁移,实现对器件的光透过率进行多级可逆性调节。
已知:WO3和Li4Fe4[Fe(CN)6]3均为无色透明晶体,LiWO3和Fe4[Fe(CN)6]3均为蓝色晶体。
下列有关说法错误的是A.当a接外接电源负极时,电致变色层、离子储存层都显蓝色,可减小光的透过率B.当b接外接电源负极时,离子储存层发生的反应为Fe4[Fe(CN)6]3+4Li++4e-=Li4Fe4[Fe(CN)6]3 C.切换电源正负极使得蓝色变为无色时,Li+通过离子导体层由离子储存层向电致变色层迁移D.该装置可用于汽车的玻璃变色调光【答案】C【解析】A.当a接外接电源负极时,电致变色层为阴极,发生电极反应WO3+Li++e-===LiWO3,LiWO3为蓝色晶体,b极接正极,离子储存层为阳极,发生电极反应Li4Fe4[Fe(CN)6]3-4e-===Fe4[Fe(CN)6]3+4Li+,Fe4[Fe(CN)6]3为蓝色晶体,蓝色与无色相比,可减小光的透过率,A选项正确;B.当b接外接电源负极时,离子储存层为阴极,发生的电极反应为Fe4[Fe(CN)6]3+4Li++4e-=Li4Fe4[Fe(CN)6]3,B选项正确;C.切换电源正负极使得蓝色变为无色时,即LiWO3变为WO3,Fe4[Fe(CN)6]3变为Li4Fe4[Fe(CN)6]3,电致变色层为阳极,离子储存层为阴极,则Li+通过离子导体层由电致变色层移向离子储存层,C选项错误;D.该装置可实现变色,可用于汽车的玻璃变色调光,D选项正确;答案选C。
2.某锂离子电池充电时的工作原理如图所示,LiCoO2中的Li+穿过聚内烯微孔薄膜向左迁移并嵌入石墨(C6表示)中。
下列说法错误的是A.充电时,阳极电极反应式为LiCoO2-xe-=xLi++Li l-x CoO2B.放电时,该电池将化学能转化为电能C.放电时,b端为负极,发生氧化反应D.电池总反应为Li x C6+Li l-x CoO2C6+LiCoO2【答案】C【解析】充电时相当于电解池,电解池在工作时,阳离子移向阴极,因此石墨极是阴极,含钴的是阳极,据此来分析各选项即可。
【详解】A.充电时,阳离子(+Li)从阳极脱嵌,穿过薄膜进入阴极,嵌入石墨中,A项正确;B.放电时相当于原电池,原电池是一类将化学能转化为电能的装置,B项正确;C.根据分析,b为电源正极,发生还原反应,C项错误;D.根据分析,整个锂电池相当于+Li在正极和负极之间不断嵌入-脱嵌的过程,D项正确;答案选C。
【点睛】锂电池正极一般选用过渡金属化合物来制作,例如本题中的钴,过渡金属一般具有多种可变的化合价,方便+LiLi脱嵌时,过渡金属化合价升高,因此无论+ Li的嵌入和脱嵌(+Li嵌入时,过渡金属化合价降低,+嵌入还是脱嵌,正极材料整体仍然显电中性)。
3.最近我国科学家对“液流电池”的研究取得新进展,一种新型的高比能量锌-碘溴液流电池工作原理如下图所示。
下列有关叙述错误的是A.放电时,a 极电势高于b 极B.充电时,a 极电极反应为I2Br-+2e-=2I-+Br-C.图中贮液器可储存电解质溶液,提高电池的容量D.导线中有N A个电子转移,就有0.5 mol Zn2+通过隔膜【答案】B【解析】在a电极上,I2Br-得电子生成I-和Br-,a电极为正极;在b电极上,Zn失电子生成Zn2+进入溶液,b电极为负极。
A.放电时,a 极为正极,电势高于作负极的b 极,A正确;B.充电时,a 极应为阳极,电极反应为2I-+Br--2e-== I2Br-,B错误;C.图中贮液器中的溶液组成与电极区的溶液组成相同,相当于电极区的电解质溶液,可提高电池的容量,C正确;D.导线中有N A个电子转移,依据关系式Zn—2e-,就有0.5 mol Zn2+生成并通过隔膜(保持溶液的电中性),D正确;故选B。
4.某新型水系钠离子电池工作原理如下图所示。
TiO2光电极能使电池在太阳光照下充电,充电时Na2S4还原为Na2S。
下列说法错误的是A.充电时,太阳能转化为电能,又转化为化学能B.放电时,a极的电极反应式为:4S2--6e-=S42-C.充电时,阳极的电极反应式为:3I--2e-=I3-D .M 是阴离子交换膜 【答案】D 【解析】TiO 2光电极能使电池在太阳光照下充电,所以充电时,太阳能转化为电能,电能又能转化为化学能,充电时Na 2S 4还原为Na 2S ,放电和充电互为逆过程,所以a 是负极,b 是正极,在充电时,阳极失电子发生氧化反应,3I --2e -=I 3-,据此回答。
A.TiO 2光电极能使电池在太阳光照下充电,所以充电时,太阳能转化为电能,电能又能转化为化学能,A 正确;B.充电时Na 2S 4还原为Na 2S ,放电和充电互为逆过程,所以a 是负极,a 极的电极反应式为:4S 2--6e -=S 42-,B 正确;C.在充电时,阳极I -失电子发生氧化反应,极反应为3I --2e -=I 3-,C 正确;D.通过图示可知,交换膜只允许钠离子自由通过,所以M 是阳离子交换膜,D 错误;答案选D 。
5.“太阳水”电池装置如图所示,该电池由三个电极组成,其中 a 为TiO 2电极,b 为Pt 电极,c 为 WO 3 电极,电解质溶液为 pH=3 的 Li 2SO 4-H 2SO 4 溶液。
锂离子交换膜将电池分为 A 、B 两个区,A 区与大气相通,B 区为封闭体系并有 N 2 保护。
下列关于该电池的说法错误的是A .若用导线连接a 、c ,则 a 为负极,该电极附近 pH 减小B .若用导线连接 a 、c ,则 c 电极的电极反应式为H x WO 3-xe -=WO 3+ xH +C .若用导线连接 b 、c ,b 电极的电极反应式为 O 2+4H ++4e -=2H 2OD .利用该装置,可实现太阳能向电能转化 【答案】B 【解析】A .根据示意图可知,a 与c 相连后,a 电极发生失电子的氧化反应所以作负极,考虑到电解质溶液为pH=3的Li 2SO 4-H 2SO 4溶液,所以a 极的电极反应式为:222H O 4e O 4H -+-=+;由于生成H +,所以a极附近的pH 下降;A 项正确;B .根据示意图可知,a 与c 相连后,c 为正极,发生得电子的还原反应,电极反应式应写作:3x 3WO xH xe =H WO +-++;B 项错误;C .根据示意图,b 与c 若相连,b 极为正极发生氧气的还原反应,考虑到电解质溶液为pH=3的Li 2SO 4-H 2SO 4溶液,所以电极反应式为:22O 4H 4e =2H O +-++;C 项正确;D .连接a 与c 后,将太阳能转变成B 中的化学能,再连接b ,c 后,就可将化学能再转变成电能,最终实现了太阳能向电能的转化,D 项正确;答案选B 。
6.某新型水系钠离子电池工作原理如下图所示。
TiO 2光电极能使电池在太阳光照下充电,充电时Na 2S 4还原为Na 2S 。
下列说法错误的是A .充电时,太阳能转化为电能,又转化为化学能B .放电时,a 极的电极反应式为:4S 2--6e -=S 42-C .充电时,阳极的电极反应式为:3I --2e -=I 3-D .M 是阴离子交换膜 【答案】D 【解析】TiO 2光电极能使电池在太阳光照下充电,所以充电时,太阳能转化为电能,电能又能转化为化学能,充电时Na 2S 4还原为Na 2S ,放电和充电互为逆过程,所以a 是负极,b 是正极,在充电时,阳极失电子发生氧化反应,3I --2e -=I 3-,据此回答。
A.TiO 2光电极能使电池在太阳光照下充电,所以充电时,太阳能转化为电能,电能又能转化为化学能,A 正确;B.充电时Na 2S 4还原为Na 2S ,放电和充电互为逆过程,所以a 是负极,a 极的电极反应式为:4S 2--6e -=S 42-,B 正确;C.在充电时,阳极I-失电子发生氧化反应,极反应为3I--2e-=I3-,C正确;D.通过图示可知,交换膜只允许钠离子自由通过,所以M是阳离子交换膜,D错误;答案选D。
7.“还原”用的Sb可由以下方法制得:用Na 2S—NaOH溶液浸取辉锑精矿(Sb2S3),将其转化为Na2SbS3(硫代亚锑酸钠)—NaOH溶液。
按如图所示装置电解后,阴极上得到Sb,阴极区溶液重新返回浸取作业,阴极的电极反应式为________。
【答案】SbS3-3+3e-===Sb+3S2-【解析】在电解池中阴极上发生还原反应,其电极反应式为:SbS3-3+3e-===Sb+3S2-。
8.直接电解吸收也是脱硝的一种方法,用6%的稀硝酸吸收NO x生成HNO2(一元弱酸),再将吸收液导入电解槽电解,使之转化为硝酸。
电解装置如下图所示。
①图中b应连接电源的________(填“正极”或“负极”)。
②阳极的电极反应式为_______________________________。
【答案】①负②HNO2-2e-+H2O===3H++NO-3【解析】由实验目的知,a极上HNO2转化为HNO3,N元素化合价升高,发生氧化反应,则a极为阳极,电极反应式为HNO2-2e-+H2O===3H++NO-3。
b极为阴极,电极反应式为2H++2e-===H2↑,应接外加电源的负极。
9.《Journal of Energy Chemistry》报道我国科学家设计CO2熔盐捕获与转化的装置如图,电源负极为________(填“a”或“b”),d极的电极反应式为______________________。
【答案】b CO2-3+4e-===C+3O2-【解析】由题图所示,c电极上发生失电子的氧化反应,故c做阳极,则a为电源正极,b为电源负极;d极得电子,电极反应式为CO2-3+4e-===C+3O2-。
10.镁—间二硝基苯电池对含有NO-3的工业废水进行降解的示意图如图2所示。
已知:电池放电时,镁转化为氢氧化镁,间二硝基苯()则转化为间苯二胺()。
则镁电极反应式为________________________。
石墨电极上发生的反应为____________________________,降解NO-3的电极反应式为___________________________。
理论上每消耗1 mol 间二硝基苯,有________mol NO-3被降解。
【答案】Mg-2e-+2H2O===Mg(OH)2+2H+2NO-3+6H2O+10e-===N2↑+12OH- 2.4【解析】由图可知左池为原电池,Mg为负极,石墨为正极;右池为电解池,Pt为阳极、Ag-Pt为阴极。