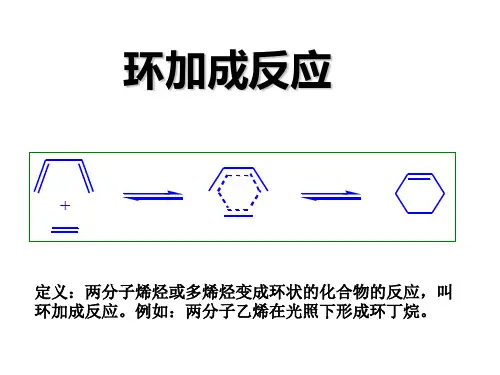
环加成反应和机理
- 格式:ppt
- 大小:821.50 KB
- 文档页数:11

环加成反应摘要:环加成反应在有机合成中有非常重要的应用,其基础理论前线轨道理论也是有机化学中非常重要的理论。
本文主要简介环加成反应和前线轨道理论,并对前线轨道在环加成反应中的应用做简要介绍。
关键词:环加成反应前线轨道理论 Diels-Alder反应环加成反应(Cycloaddition Reaction)是两个共轭体系结合成环状分子的一种双分子反应, 它是由两个或多个不饱和化合物(或同一化合物的不同部分)结合生成环状加合物,并伴随有系统总键级数减少的化学反应。
这类反应是合成单环及多环化合物的一种重要方法。
有关环加成反应最早是德国化学家Diels与其学生Alder等在1928年通过环戊二烯与顺丁烯二酸酐发生[4+2]环加成实现的。
常见的环加成反应类型除[4+2]外,还包括[3+2], [2+2+2], [3+2+2], [4+2+2]等。
环加成反应的主要特点是可以将不饱和链状化合物直接转变成环状化合物,包括三元、四元到九元、十元环等,且原子利用率高。
在天然产物的全合成、药物化学等领域有着广泛的应用。
1、前线轨道理论简介前线轨道是由日本理论化学家福井谦一提出的,他指出化合物分子的许多性质主要出最高占据分子轨道相最低未占分子轨道所决定的。
凡是处于前线轨道的电子,可优先配对。
这对选择有机合成反应路线起决定性作用。
鉴于前线轨道理论对于有机化学发展的重要性,他获得了1981年的诺贝尔化学奖。
1.1 前线轨道的几个基本概念分子周围的电子云,根据能量的不同,可以分为不同的能级轨道,根据能量最低原理,电子优先排入能量低的轨道。
前线轨道理论中,将用HOMO表示;未占有电子的能量最低的轨道称之为最低占有轨道,用LUMO表示(如图1-1)。
有的共轭轨道中含有奇数个电子,它的最高已占有轨道只有一个电子,这种单电子占有的轨道称之为单占轨道,用SOMO表示。
在分子中,HOMO轨道对于电子的束缚最为薄弱,LUMO轨道对电子的吸引力最强,因而前线轨道认为,分子加发生化学反应,本质上就是HOMO轨道与LUMO轨道的相互作用,形成新的化学键的过程。

有机化学中的环状反应与环加成反应有机化学是研究和描述碳元素及其化合物的科学领域。
其中,环状反应和环加成反应是有机化学中两个重要的反应类型。
本文将详细介绍这两种反应的定义、机理和应用。
一、环状反应环状反应是指在有机化合物中发生碳骨架内部原子间的键重组,形成一个稳定的环结构。
环状反应是有机化学中广泛研究的领域之一,可以应用于新型化合物的合成和现有化合物的转化。
1.1 环状反应的定义和示例:环状反应主要通过构建和打破碳-碳键来实现。
根据反应机理和所需的在环初始和末端上活化基团的类型,环状反应可以分为多种类型,如环合反应、环断裂反应、环转移反应等。
环合反应是最常见的环状反应之一,它通过两个或多个分子中的原子间形成新的碳-碳键和碳-异原子键,并形成一个稳定的环结构。
例如,迈克尔加成反应、多米诺反应等都属于环合反应。
这些反应可以合成具有复杂碳骨架的化合物,为药物合成和天然产物的合成提供了重要的方法。
1.2 环状反应的机理和应用:环状反应的机理多样,常见的有自由基机理、电子转移机理和质子转移机理等。
不同的机理涉及到不同的中间物和过渡态,通过控制反应条件和反应物的选择,可以实现不同类型的环状反应。
环状反应在有机化学中的应用广泛。
例如,它可以用于天然产物和药物的合成,如青霉素的合成就包括一系列的环状反应。
此外,环状反应还可以用于材料科学领域,如合成多孔材料、配位聚合物等。
二、环加成反应环加成反应是指在有机化合物中,一个或多个官能团与化学反应物中的另一个官能团发生加成反应,生成环状产物。
环加成反应在有机合成和天然产物的合成中具有重要的应用价值。
2.1 环加成反应的定义和示例:环加成反应主要通过不同官能团间的加成反应来实现。
常见的环加成反应有氧杂环的形成、环氮的形成等。
例如,环加成反应中的Diels-Alder反应是一种重要的环加成反应,通过共轭二烯与烯丙基等共轭化合物发生热力学控制的[4+2]加成反应,生成新的环状产物。
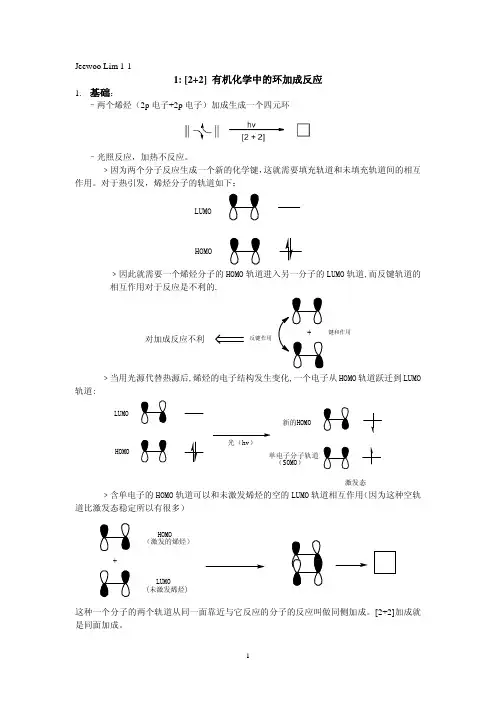
1: [2+2] 有机化学中的环加成反应1.基础:–两个烯烃(2p电子+2p电子)加成生成一个四元环–光照反应,加热不反应。
﹥因为两个分子反应生成一个新的化学键,这就需要填充轨道和未填充轨道间的相互作用。
对于热引发,烯烃分子的轨道如下:LUMOHOMO﹥因此就需要一个烯烃分子的HOMO轨道进入另一分子的LUMO轨道,而反键轨道的相互作用对于反应是不利的.+键和作用反键作用对加成反应不利﹥当用光源代替热源后,烯烃的电子结构发生变化,一个电子从HOMO轨道跃迁到LUMO 轨道:LUMOHOMO光(hv)新的HOMO单电子分子轨道(SOMO)激发态﹥含单电子的HOMO轨道可以和未激发烯烃的空的LUMO轨道相互作用(因为这种空轨道比激发态稳定所以有很多)+HOMO(激发的烯烃)LUMO(未激发烯烃)这种一个分子的两个轨道从同一面靠近与它反应的分子的反应叫做同侧加成。
[2+2]加成就是同面加成。
–为什么异测进攻不利?﹥反式进攻是一个分子的轨道加到与之相护作用的另一个分子的异侧。
顶部反式进攻﹥对于2+2加成反应反式进攻是最不可能的(如果这种反式进攻是可行的,那么对于热引发的[2+2]反应也是可行的。
但是由于垂直键不可能作用,这种跨环进攻是严重受阻的)2. 反应物和产物之间的结构关系–让我们看一下反-丁烯的二聚:“上”“上”“下”“下”–反-丁烯和顺-丁烯的反应:反式顺式“上”“下”“下”“下”–当有一个烯烃是环状时,顺式加成。
顺式 加成物3.例子!!!–第一个关于[2+2]环加成反应的报道G. Ciamician, P. Silber (1908):OO1年!香芹酮 香芹酮樟脑O –Paterno-Buchi反应。

有机合成中的环加成反应机理探究有机合成是化学领域中的一项重要研究领域,它涵盖了许多不同的反应类型和机理。
其中,环加成反应是有机合成中一种常见且有广泛应用的反应类型。
本文将探究有机合成中的环加成反应机理,深入了解其原理和应用。
环加成反应是指通过两个或多个不饱和化合物之间的化学反应形成一个环状产物。
这种反应常常发生在不饱和键(如双键或三键)周围,通过断裂和形成化学键的方式构建新的化合物结构。
环加成反应可以分为三类:1,2-环加成,1,4-环加成和1,5-环加成。
其中,最常见的是1,4-环加成,即两个反应物之间的烯醇和烯酮之间的反应。
研究环加成反应的一个关键问题是了解其机理。
在1,4-环加成反应中,首先烯醇通过质子化生成带有正电荷的间质体。
接下来,烯酮中的羰基氧化钯络合物通过插入间质体中的质子,打开了一个环。
这个产物含有一个新的碳-碳键和一个新的环。
在环加成反应中,催化剂起着至关重要的作用。
常见的催化剂有钯和铂等贵金属催化剂。
钯催化剂通常由钯络合物和配体组成,配体可以提供对亲核试剂的辅助。
铂催化剂则具有更广泛的反应适应性。
这些催化剂通过与反应物中的特定官能团发生配位,并提供一个合适的反应环境来促进环加成反应的进行。
环加成反应在有机合成中有着广泛的应用。
例如,它可以用于合成天然产物、药物和功能材料等。
通过合成新的环状化合物,我们可以改变其物理性质和化学性质,从而为我们提供更多的合成选择。
此外,环加成反应还可以提供新的立体中心,并能够选择性地形成特定的异构体。
这为有机合成提供了更多的控制手段。
除了1,4-环加成反应,还有其他类型的环加成反应,如1,2-环加成和1,5-环加成。
这些反应具有不同的机理和应用。
例如,1,2-环加成反应常常涉及到亲电试剂和环状芳香化合物的反应,形成螺型产物。
而1,5-环加成反应则常常通过使反应物中的官能团发生取代,形成五元环。
总结而言,有机合成中的环加成反应是一类重要且广泛应用的有机反应。

丁二烯与乙烯环加成的反应机理嘿,朋友们!今天咱们来唠唠丁二烯和乙烯环加成这个超有趣的化学反应。
你可以把丁二烯想象成一个长着四个手臂的小怪物,而乙烯呢,就像是个只有两只手臂的小不点。
当它们俩要发生反应的时候,就像是一场奇特的舞蹈。
反应方程式是这样的:CH₂=CH - CH=CH₂ + CH₂=CH₂ → 。
这就好比是两个不同的小生物要组合在一起啦。
丁二烯这个四臂小怪物啊,它的手臂可灵活了。
乙烯呢,虽然手臂少,但也不甘示弱。
它们开始靠近的时候,就像两个性格迥异但又充满好奇的家伙。
这个反应的机理啊,就像是一场精心编排的魔术。
首先,丁二烯和乙烯要找到彼此合适的位置,就像两个舞者在舞台上寻找最佳的站位。
它们的双键就像是魔法的连接点。
丁二烯的双键像是两把小钩子,乙烯的双键也是个小钩子。
当它们靠近时,这些钩子就开始互相勾连。
这时候,电子就像是一群调皮的小精灵,在双键之间跳来跳去,重新排列组合。
你看啊,丁二烯的四个手臂和乙烯的两个手臂纠缠在一起,就像编织一个超级复杂的麻花辫。
电子们在其中穿梭,就像一群小蚂蚁在麻花辫里忙碌着。
随着反应的进行,它们逐渐形成一个新的环状结构。
这就好比是两个原本独立的小积木,通过特殊的方式拼接成了一个新的、独特的大积木。
而且这个反应还特别讲究时机,就像两个杂技演员在空中接力,必须在恰到好处的时刻完成动作,电子的转移也是如此,一步都不能错。
最后,它们成功地完成了环加成反应,变成了一个全新的分子。
这个新分子就像是丁二烯和乙烯融合后的“后代”,有着两者的特征。
这整个反应机理就像是一场奇妙的化学魔法秀,让人大开眼界!。

环加成反应、环合反应、电环化反应与环化反应的区别
环加成反应、环合反应、电环化反应与环化反应都是有机化学中常见的反应类型,它们的区别如下:
1. 环加成反应:是指两个或多个分子中的一个分子中的双键与另一个分子中的原子或官能团形成新的碳-碳键,从而形成环状结构的反应。
如环丙烯和丙烯酸酯反应得到环戊酮。
2. 环合反应:指两个或多个分子中的官能团在分子内部相互反应,形成环状结构的反应。
如羧酸和醛或酮反应生成内酯或内酰胺。
3. 电环化反应:是指通过电子转移或质子转移,使分子中的一个双键或三键环化为环状结构的反应。
如苯环化反应。
4. 环化反应:是指分子中的某个部分发生内部反应形成环状结构的反应。
如酮的烷基迁移环化反应。
总的来说,这些反应都是通过形成环状结构来改变分子结构和性质的。
它们的区别主要在于反应的起始物质和反应机理。
- 1 -。

有机化学中的环加成反应有机化学中的环加成反应是一类重要的化学反应,其在合成有机分子以及药物研发、材料科学等领域有着广泛的应用。
本文将介绍环加成反应的概念、机理以及几个常见的反应类型。
一、概念和机理环加成反应是指将两个或多个反应物中的π键与其他化合物中的电荷或自由基发生加成反应,形成新的环状结构的化学反应。
这种反应的机理取决于反应物和催化剂的性质,可以通过热力学或动力学控制反应过程。
常见的环加成反应包括[1]:1. Diels-Alder反应:它是一种将1,3-二烯和烯丙基复合物合成环状产物的反应。
该反应是通过共轭体系的反应中间体来实现的。
2. 2+2环加成:这种反应通过两个烯烃分子的双键与烯丙基复合物中的两个π键发生加成,生成环状产物。
3. 3+2环加成:这是一类重要的环加成反应,通过一个烯烃和一个亲电子特征的分子发生加成反应,形成五元环产物。
二、Diels-Alder反应Diels-Alder反应是环加成反应中最常见的一种类型。
它是一种经典的烯丙基复合物与1,3-二烯反应,生成六元环状产物的反应。
这种反应的应用广泛,可以构建复杂的环状结构[2]。
该反应的具体机理如下图所示:[插入机理示意图]三、2+2环加成反应2+2环加成反应是一种将两个烯烃分子的双键与烯丙基复合物中的两个π键发生加成,生成环状产物的反应[3]。
这种反应在有机合成中具有重要的应用价值,可以构建类似光敏材料等化合物。
该反应的机理如下图所示:[插入机理示意图]四、3+2环加成反应3+2环加成反应是有机化学中最重要的环加成反应之一,通过一个烯烃和一个具有亲电子特征的分子(如酮、醛等)的加成反应,生成五元环产物[4]。
这种反应具有高度的化学选择性和立体选择性,被广泛应用于药物合成和天然产物的合成等领域。
该反应的机理如下图所示:[插入机理示意图]总结:有机化学中的环加成反应是一类重要的合成方法,通过在π键和电荷或自由基之间发生加成反应,构建新的环状结构。

环烯烃的开环加成规则
环烯烃是一类重要的有机化合物,其在许多有机合成反应中都扮演着重要的角色。
其中,环烯烃的开环加成反应是一种常见且重要的反应类型。
在这种反应中,可以在环烯烃的烯双键上发生加成反应,形成新的化学键。
环烯烃的开环加成规则主要包括以下几个方面:
1. 选择适当的加成试剂:环烯烃的开环加成反应需要选择适当
的加成试剂,通常选择的试剂包括醇、醛、酮、羧酸、胺等。
2. 反应机理:环烯烃的开环加成反应通常分为电子亲和性加成
和亲核加成两种机理。
电子亲和性加成是指加成试剂中的亲电子向环烯烃的烯双键上攻击,形成新的化学键。
亲核加成是指环烯烃中的π电子向加成试剂中的亲核子攻击,形成新的化学键。
3. 反应条件:环烯烃的开环加成反应需要一定的反应条件,通
常包括适当的温度、反应时间、反应物的摩尔比等因素。
4. 反应产物:环烯烃的开环加成反应可以得到不同类型的产物,包括环烷基化物、醛、酮、醇等。
具体产物类型取决于加成试剂的选择以及反应条件的控制。
总之,环烯烃的开环加成反应是有机合成中的一种重要反应类型,其反应规律与机理需要合理的选择反应条件和加成试剂,以得到所需的产物。
- 1 -。


吡喃成环反应机理
吡喃成环反应是一种有机合成反应,它指的是在吡喃环上进行的环加成反应。
吡喃环是由一个五碳环和一个六碳环组成的环系,它具有多种多样的生物活性,如抗病毒、抗肿瘤、抗菌等。
吡喃成环反应的机理可以分为两个步骤:首先,烯烃或烯丙基化合物与醛在酸性条件下发生缩合反应,形成一个六元环的吡喃酮中间体。
然后,吡喃酮中间体经过分子内氢转移、脱水等过程,最终形成一个稳定的吡喃环。
吡喃成环反应的反应机理比较复杂,需要涉及到多个中间体和过渡态。
在反应过程中,酸性条件下的质子(H+)和路易斯酸(如BF3)的协同作用有助于提高反应速率。
此外,反应的立体化学和立体化学控制也是该领域的研究热点,通过对反应条件、反应物结构和反应机理的深入研究,可以实现对反应立体化学的控制,从而合成具有特定结构和高生物活性的吡喃化合物。
总之,吡喃成环反应是一种重要的有机合成反应,它涉及到复杂的反应机理和多个中间体,需要深入研究和理解。
同时,吡喃化合物在药物和天然产物等领域具有广泛的应用,因此,吡喃成环反应在化学和生物领域都具有重要的意义。
有机化学中的环加成反应与环开开反应有机化学中的环加成反应与环开裂反应一、引言有机化学中的环加成反应与环开裂反应是两种重要的反应类型。
环加成反应是指在有机分子中有两个或多个反应中心,形成一个或多个新的环结构,同时伴随着键的形成。
环开裂反应则相反,是指在有机分子中破坏一个或多个环结构,同时伴随着键的断裂。
本文将对这两种反应进行详细介绍。
二、环加成反应1. 环加成反应的概念环加成反应是指在有机分子中存在的两个或多个不同的反应中心以及共轭系统,通过移动π电子或自由基的方式,形成一个新的环结构,同时伴随着键的形成的化学反应。
2. 环加成反应的机理环加成反应的机理主要分为两种:电子推动机理和自由基机理。
电子推动机理主要发生在共轭体系存在的有机分子中,其过程中通过共轭π电子的运动实现键的形成。
自由基机理主要发生在存在自由基的有机分子中,其过程中通过自由基的加成实现键的形成。
3. 环加成反应的应用环加成反应在有机合成中具有广泛的应用,可以用于构建含有新的环结构的化合物,制备具有生物活性的化合物等。
三、环开裂反应1. 环开裂反应的概念环开裂反应是指在有机分子中存在的一个或多个环结构,在特定条件下发生键的断裂,并形成一个或多个新的分子。
2. 环开裂反应的机理环开裂反应的机理主要有热开裂、光解和酸碱催化等不同类型。
热开裂是指在高温下,环结构中的键发生断裂,并形成新的分子。
光解是指在紫外光或可见光的照射下,环结构中的键发生断裂,并形成新的分子。
酸碱催化是指在酸性或碱性条件下,环结构中的键发生断裂,并形成新的分子。
3. 环开裂反应的应用环开裂反应在有机合成中也具有广泛的应用,可以用于制备含有特定官能团的化合物,合成药物等。
四、环加成反应与环开裂反应的比较与总结环加成反应与环开裂反应虽然是两种相反的反应类型,但在有机化学的研究与应用中都具有重要的地位。
在机理上,环加成反应主要通过形成新键实现反应,而环开裂反应则是通过断裂原有键实现反应。
光气反应机理光气是一种重要的有机化合物,其反应机理涉及多种类型的反应,包括亲电取代反应、离子型反应、自由基反应、电子转移反应和环加成反应等。
这些反应机理在光气的合成和应用中起着重要作用。
1.亲电取代反应亲电取代反应是光气的一种重要反应机理,通常涉及到C酰化反应。
在光气中,C=O双键的一侧具有电子云密度较低的碳原子,使得该碳原子容易被带有正电荷的亲电试剂所攻击。
例如,当光气与醇反应时,C酰化反应发生,生成相应的碳酸酯。
2.离子型反应离子型反应也是光气的一种重要反应机理。
在离子型反应中,光气可以通过C酰化和C酰氧化的方式参与反应。
例如,当光气与羧酸盐发生反应时,C酰化反应发生,生成相应的羧酸和醇。
另一方面,当光气与酚钠发生反应时,C酰氧化反应发生,生成相应的酚和碳酸酯。
3.自由基反应自由基反应在光气的合成和降解过程中也起着重要作用。
在自由基反应中,光气可以通过光解或热解的方式生成自由基。
这些自由基可以与其他化合物发生加成或氧化还原反应,从而形成新的化合物。
例如,当光气与烯烃发生反应时,自由基加成反应发生,生成相应的碳酸酯和烯烃。
4.电子转移反应电子转移反应也是光气的一种重要反应机理。
在电子转移反应中,光气可以接受或给出电子,与其他化合物发生氧化还原反应。
例如,当光气与硫醇发生反应时,电子转移反应发生,生成相应的硫代碳酸酯和醇。
5.环加成反应环加成反应是光气的一种特殊反应机理。
在环加成反应中,光气可以与环状化合物发生加成反应,形成新的环状化合物。
例如,当光气与烯烃发生环加成反应时,可以生成相应的环状碳酸酯和烯烃。
内容:学习目标:掌握DA 反应在合成中应用Diels-Alder 反应烯烃结构对DA 反应的影响二烯烃DA 反应的立体化学特征河豚毒素的制备——Diels-Alder反应[4+2]加成——共轭双烯与含有烯键或炔键的化合物相互作用,生成六元环状化合物的反应!!!Otto Diels(1876-1954)德国1950年获奖Kurt Alder,(1902—1958)德国1950年获奖O. Diels, K. Alder, Justus Liebigs Ann. Chem. 1928, 460, 98.J. G. Martin, et.al.Chem. Rev. 1961, 61, 537.E.J. Corey, Angew. Chem., Int. Ed., 2002,41, 1651.1Diels-Alder反应——[4+2]环加成(1928)1) D-A反应实验事实concerted mechanismtwo-step mechanism副产物的检测未检测到立体化学D-A([4+2])反应机理2烯烃结构对DA反应的影响1) 双烯体上有给电子基团,亲双烯体上有吸电子基团有利于反应给电子基团吸电子基团102)只有s-cis-烯烃才有D-A反应s-cis-烯烃3二烯烃DA反应的立体化学特征1)D-A反应是顺式加成内式(endo)外式Exo 2) D-A反应遵循内式规则主要产物Diels-Alder反应可用于制备双环化合物3) 不对称D-A反应主要生成1,2或1,4-产物1,4-加成产物(主)静电催化Diels-Alder反应小结双烯体上有给电子基团,亲双烯体上有吸电子基团有利于反应[4+2]环加成可生成六元环状化合物D-A 反应是顺式加成下节课内容周环反应简介。
实验D-13 呋喃与马来酸酐的环加成【实验目的】1.学习狄尔斯-阿尔德(Diels-Alder)反应原理,利用马来酸酐与呋喃的环加成合成相应的多环化合物。
2.进一步掌握固体化合物的分离提纯技术。
【实验原理】呋喃与马来酸酐以协同机理进行反应,得到六元环结构的加成产物。
OOO O+OO该反应的特点是:(1)可逆反应;(2)加成时得到立体专一的顺式加成产物;(3)双烯合成总是生成内型(endo)加合物,而不生成外型(exo)加合物。
【试剂规格与用量】呋喃 1.4 g (1.5 ml, 0.02 mol)顺丁烯二酸酐 2 g (0.02 mol)乙醚20 ml【实验步骤】1.在50 mL圆底瓶中依次加入研细的顺丁烯二酸酐(马来酸酐)和乙醚。
摇动烧瓶使顺丁烯二酸酐悬浮在乙醚中[1]。
2.加入呋喃,装上回流冷凝管,震荡。
将混合物在室温下[2]放置2-3 h,并间歇震荡之,反应渐趋完全并有晶体析出。
3. 抽滤。
4. 滤液在热水浴上蒸出乙醚,得淡黄色固体。
产量3-3.3 g,为纯7-内氧桥-双环[2.2.1]-5-庚烯-2,3-二甲酸酐,该化合物为结晶固体,熔点118℃。
【注解】1.顺丁烯二酸酐在室温下不易溶解于乙醚中。
2.Diels-Alder反应速度快,产率高。
该反应在高温下是可逆的,所以应尽可能在较低的温度下进行反应。
呋喃和乙醚的沸点都较低,故在室温下反应即可。
【思考题】1. 呋喃与马来酸酐的加合物,为什么只有内型?2.写出马来酸酐与反,反-2,4-己二烯反应所得产物结构式。
3.指出Diels-Alder反应的主要副反应是什么?。
胺环加成反应胺环加成反应(Amide-Imine Cyclization)是一种重要的有机合成方法,常用于合成含有环状酰胺和亚胺结构的化合物。
这种反应通常包括一个胺和一个碳酸酯、酸酐、酰氯或酰胺等底物,通过不同机制下的加成、缩合、脱水等步骤,得到目标产物。
这篇文章将对该反应的机理、条件和应用进行详细介绍,希望能为有机化学领域的研究人员提供参考。
一、反应机理1.1 加成反应胺环加成的第一步是胺与碳酸酯或酰胺之间的加成反应。
碳酸酯或酰胺中的羰基与胺中的氨基发生亲核加成反应,形成一个中间体。
这个中间体可以是一个新的胺基酰胺或亚胺结构,具体取决于反应条件和底物的结构。
1.2 缩合反应接下来的步骤是缩合反应,也称为酰胺的合成。
在这一步骤中,中间体内的碳酸酯或酰胺部分与胺中的氨基发生缩合反应,生成一个含有环状酰胺或亚胺结构的产物。
1.3 脱水反应最后一步是脱水反应,也称为亚胺的合成。
在这一步骤中,缩合产物中的羟基或酰胺基与周围的羰基发生脱水反应,生成一个含有亚胺结构的产物。
二、反应条件2.1 反应溶剂胺环加成反应通常在常见的有机溶剂中进行,例如氯仿、二甲基甲酰胺、乙醚等。
溶剂的选择取决于底物的性质和反应条件的要求。
2.2 反应温度反应温度一般在室温至80C之间,取决于底物的性质和反应条件的要求。
通常情况下,直接加热或者加入催化剂都能够促进反应的进行。
2.3 反应催化剂在一些情况下,反应可能需要使用催化剂来促进反应的进行,例如氮碱或酸性催化剂等。
催化剂的选择取决于底物的性质和反应条件的要求。
2.4 其他条件除了上述条件外,还可能需要考虑到氧气、湿度和光照等因素对反应的影响。
在一些情况下,需要特别注意反应过程中的干燥和惰性气氛等条件。
三、反应应用3.1 药物合成胺环加成反应在药物合成领域有着广泛的应用。
通过这种反应可以高效合成含有环状酰胺或亚胺结构的化合物,这些化合物往往具有重要的生物活性,例如抗癌药物、抗生素等。
卡宾与2-丁烯环加成反应机理的MNDO法研究1. 研究背景在有机化学领域中,卡宾与烯烃的加成反应一直是一个备受关注的研究课题。
通过研究卡宾与2-丁烯的环加成反应机理,可以更深入地了解这类反应的发生机制,为有机合成方法的优化和新反应的设计提供理论依据。
2. MNDO法介绍MNDO法是一种半经验的量子化学方法,适用于研究有机分子的结构和反应机理。
该方法采用简化的分子轨道理论,通过数学模型对分子的构型和反应进行计算,是理论化学研究中常用的手段之一。
3. 实验设计本研究选择了卡宾和2-丁烯为反应物,采用MNDO法对其环加成反应进行模拟计算。
首先建立了反应物的分子模型,然后模拟了反应过程中的活化态、过渡态和生成物的结构,以及反应的能量变化。
4. 结果分析通过MNDO法计算得到了卡宾与2-丁烯环加成反应的能垒、活化态和生成物的结构和稳定性,从而揭示了反应的机理。
结果表明,该反应是一个放热反应,生成物的结构和稳定性优于反应物。
5. 结论通过MNDO法的研究,我们深入探讨了卡宾与2-丁烯环加成反应的机理,为这类反应的理论基础和实际应用提供了重要参考。
本研究还展现了MNDO法在有机反应研究中的应用前景和价值。
6. 展望基于本研究的结果,我们将进一步探索卡宾与其他烯烃的环加成反应机理,以及MNDO法在有机反应机理研究中的推广和应用。
我们相信,这一领域的深入研究将为有机合成化学提供更多理论指导和实践应用的可能性。
在此,我们期望通过本研究的成果,为有机化学领域的理论研究和实践应用做出更多贡献,推动有机合成的发展和创新,为人类社会的发展进步贡献力量。
文章总结本文通过介绍了卡宾与2-丁烯环加成反应机理的MNDO法研究,从研究背景、MNDO法介绍、实验设计、结果分析、结论和展望等方面展开论述。
通过文章的逻辑结构清晰,层次分明,对于读者能够更深入地了解卡宾与2-丁烯环加成反应机理的研究过程和结果,是一篇高质量、流畅易读、结构合理的文章。