胺烯加成反应机理
- 格式:docx
- 大小:11.05 KB
- 文档页数:1
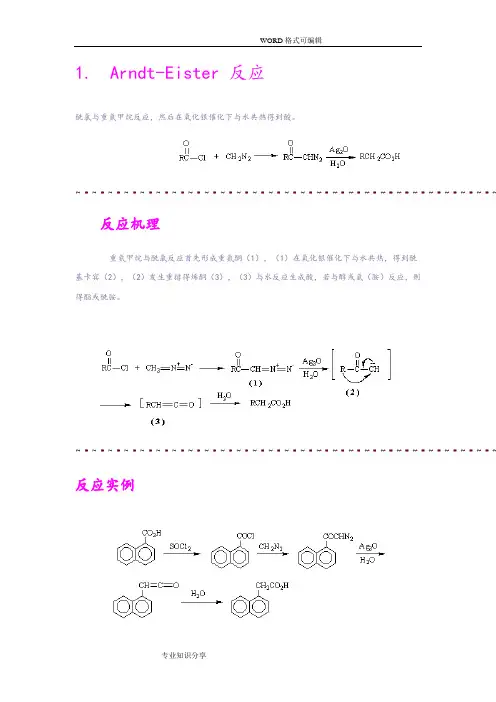
1.Arndt-Eister 反应酰氯与重氮甲烷反应,然后在氧化银催化下与水共热得到酸。
反应机理重氮甲烷与酰氯反应首先形成重氮酮(1),(1)在氧化银催化下与水共热,得到酰基卡宾(2),(2)发生重排得烯酮(3),(3)与水反应生成酸,若与醇或氨(胺)反应,则得酯或酰胺。
反应实例2.Baeyer----Villiger 反应反应机理过酸先与羰基进行亲核加成,然后酮羰基上的一个烃基带着一对电子迁移到-O-O-基团中与羰基碳原子直接相连的氧原子上,同时发生O-O键异裂。
因此,这是一个重排反应具有光学活性的3---苯基丁酮和过酸反应,重排产物手性碳原子的枸型保持不变,说明反应属于分子内重排:不对称的酮氧化时,在重排步骤中,两个基团均可迁移,但是还是有一定的选择性,按迁移能力其顺序为:醛氧化的机理与此相似,但迁移的是氢负离子,得到羧酸。
反应实例酮类化合物用过酸如过氧乙酸、过氧苯甲酸、间氯过氧苯甲酸或三氟过氧乙酸等氧化,可在羰基旁边插入一个氧原子生成相应的酯,其中三氟过氧乙酸是最好的氧化剂。
这类氧化剂的特点是反应速率快,反应温度一般在10~40℃之间,产率高。
3.Beckmann 重排肟在酸如硫酸、多聚磷酸以及能产生强酸的五氯化磷、三氯化磷、苯磺酰氯、亚硫酰氯等作用下发生重排,生成相应的取代酰胺,如环己酮肟在硫酸作用下重排生成己内酰胺:反应机理在酸作用下,肟首先发生质子化,然后脱去一分子水,同时与羟基处于反位的基团迁移到缺电子的氮原子上,所形成的碳正离子与水反应得到酰胺。
迁移基团如果是手性碳原子,则在迁移前后其构型不变,例如:反应实例4.Birch还原芳香化合物用碱金属(钠、钾或锂)在液氨与醇(乙醇、异丙醇或仲丁醇)的混合液中还原,苯环可被还原成非共轭的1,4-环己二烯化合物。
反应机理首先是钠和液氨作用生成溶剂化点子,然后苯得到一个电子生成自由基负离子(Ⅰ),这是苯环的л电子体系中有7个电子,加到苯环上那个电子处在苯环分子轨道的反键轨道上,自由基负离子仍是个环状共轭体系,(Ⅰ)表示的是部分共振式。

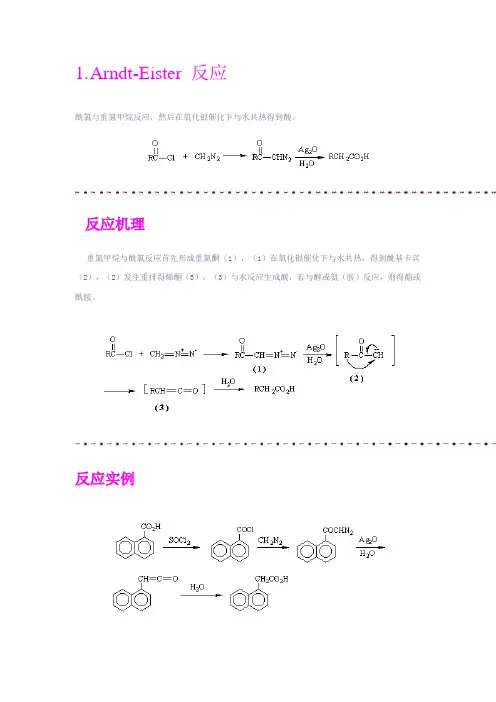
1.A rndt-Eister 反应酰氯与重氮甲烷反应,然后在氧化银催化下与水共热得到酸。
反应机理重氮甲烷与酰氯反应首先形成重氮酮(1),(1)在氧化银催化下与水共热,得到酰基卡宾(2),(2)发生重排得烯酮(3),(3)与水反应生成酸,若与醇或氨(胺)反应,则得酯或酰胺。
反应实例2.Baeyer----Villiger 反应反应机理过酸先与羰基进行亲核加成,然后酮羰基上的一个烃基带着一对电子迁移到-O-O-基团中与羰基碳原子直接相连的氧原子上,同时发生O-O键异裂。
因此,这是一个重排反应具有光学活性的3---苯基丁酮和过酸反应,重排产物手性碳原子的枸型保持不变,说明反应属于分子内重排:不对称的酮氧化时,在重排步骤中,两个基团均可迁移,但是还是有一定的选择性,按迁移能力其顺序为:醛氧化的机理与此相似,但迁移的是氢负离子,得到羧酸。
反应实例酮类化合物用过酸如过氧乙酸、过氧苯甲酸、间氯过氧苯甲酸或三氟过氧乙酸等氧化,可在羰基旁边插入一个氧原子生成相应的酯,其中三氟过氧乙酸是最好的氧化剂。
这类氧化剂的特点是反应速率快,反应温度一般在10~40℃之间,产率高。
3.Beckmann 重排肟在酸如硫酸、多聚磷酸以及能产生强酸的五氯化磷、三氯化磷、苯磺酰氯、亚硫酰氯等作用下发生重排,生成相应的取代酰胺,如环己酮肟在硫酸作用下重排生成己内酰胺:反应机理在酸作用下,肟首先发生质子化,然后脱去一分子水,同时与羟基处于反位的基团迁移到缺电子的氮原子上,所形成的碳正离子与水反应得到酰胺。
迁移基团如果是手性碳原子,则在迁移前后其构型不变,例如:反应实例4.Birch还原芳香化合物用碱金属(钠、钾或锂)在液氨与醇(乙醇、异丙醇或仲丁醇)的混合液中还原,苯环可被还原成非共轭的1,4-环己二烯化合物。
反应机理首先是钠和液氨作用生成溶剂化点子,然后苯得到一个电子生成自由基负离子(Ⅰ),这是苯环的л电子体系中有7个电子,加到苯环上那个电子处在苯环分子轨道的反键轨道上,自由基负离子仍是个环状共轭体系,(Ⅰ)表示的是部分共振式。

1.Arbuzov 反应亚磷酸三烷基酯作为亲核试剂与卤代烷作用,生成烷基膦酸二烷基酯和一个新的卤代烷:卤代烷反应时,其活性次序为:R'I >R'Br >R'Cl。
除了卤代烷外,烯丙型或炔丙型卤化物、a-卤代醚、a- 或 b-卤代酸酯、对甲苯磺酸酯等也可以进行反应。
当亚酸三烷基酯中三个烷基各不相同时,总是先脱除含碳原子数最少的基团。
本反应是由醇制备卤代烷的很好方法,因为亚磷酸三烷基酯可以由醇与三氯化磷反应制得:如果反应所用的卤代烷 R'X 的烷基和亚磷酸三烷基酯 (RO)3P 的烷基相同(即 R' = R),则 Arbuzov 反应如下:这是制备烷基膦酸酯的常用方法。
除了亚磷酸三烷基酯外,亚膦酸酯 RP(OR')2和次亚膦酸酯 R2POR' 也能发生该类反应,例如:反应机理一般认为是按 S N2 进行的分子内重排反应:反应实例2.Arndt-Eister 反应酰氯与重氮甲烷反应,然后在氧化银催化下与水共热得到酸。
重氮甲烷与酰氯反应首先形成重氮酮(1),(1)在氧化银催化下与水共热,得到酰基卡宾(2),(2)发生重排得烯酮(3),(3)与水反应生成酸,若与醇或氨(胺)反应,则得酯或酰胺。
反应实例3.Baeyer----Villiger 反应反应机理过酸先与羰基进行亲核加成,然后酮羰基上的一个烃基带着一对电子迁移到-O-O-基团中与羰基碳原子直接相连的氧原子上,同时发生O-O键异裂。
因此,这是一个重排反应具有光学活性的3---苯基丁酮和过酸反应,重排产物手性碳原子的枸型保持不变,说明反应属于分子内重排:不对称的酮氧化时,在重排步骤中,两个基团均可迁移,但是还是有一定的选择性,按迁移能力其顺序为:醛氧化的机理与此相似,但迁移的是氢负离子,得到羧酸。
酮类化合物用过酸如过氧乙酸、过氧苯甲酸、间氯过氧苯甲酸或三氟过氧乙酸等氧化,可在羰基旁边插入一个氧原子生成相应的酯,其中三氟过氧乙酸是最好的氧化剂。

robinson-gabriel反应机理
Robinson-Gabriel反应是一种有机合成反应,是通过将苯乙烯与丙烯酸酯进行加成反应,生成α,β-不饱和羧酸的方法。
该反应是由英国化学家Robert Robinson和Gabriel于1930年发现的。
反应机理如下:
首先,苯乙烯与丙烯酸酯在存在碱催化剂的条件下发生加成反应,生成一个间歇性的共轭烯烃中间体。
这个中间体是一个具有α,β-不饱和键的羧酸酯。
接下来,这个中间体会在碱的作用下发生内酰胺化反应,生成一个环状的酰胺中间体。
这个酰胺中间体是一个四元环结构,其上有两个羰基和一个双键。
最后,这个酰胺中间体会在酸的作用下发生水解反应,生成α,β-不饱和羧酸。
这个反应会在酸性条件下进行,生成的产物是一种具有α,β-不饱和键的羧酸。
总的来说,Robinson-Gabriel反应是一种通过加成反应生成α,β-不饱和羧酸的方法,其反应机理包括加成反应、内酰胺化反应和水解反应三个步骤。

有机物反应机理引言有机化学是研究碳原子及其化合物的化学性质和反应机理的科学。
有机物反应机理是指有机化合物在进行化学反应时,分子间键的形成、断裂和转移的过程。
了解有机物反应机理对于预测和控制有机化合物的合成、性质和反应具有重要意义。
本文将介绍有机物反应的一般性质、常见类型以及一些典型的反应机理。
一般性质反应速率有机化学反应速率受多种因素影响,包括温度、浓度、溶剂、催化剂等。
其中,温度是影响反应速率最为重要的因素。
通常情况下,随着温度升高,分子动力学活性增加,反应速率也随之增加。
势能面在有机物反应中,势能面描述了各个原子之间键的形成和断裂过程中势能变化的路径。
势能面可以通过构建分子轨道图来描述。
中间体在许多有机物反应中,会产生中间体。
中间体是指在一个或多个步骤中生成,并在反应的后续步骤中被消耗的物质。
中间体的形成和消耗是有机物反应机理中重要的环节。
反应类型取代反应取代反应是有机化学中最常见的一类反应。
它涉及到一个原子或官能团被另一个原子或官能团替代的过程。
取代反应可以分为三个主要类型:亲核取代、电子取代和自由基取代。
亲核取代亲核取代是指通过亲核试剂攻击电子丰富区域,将其替换为另一个官能团。
典型的例子包括酯水解和氨解。
电子取代电子取代是指通过电子丰富试剂攻击电子贫瘠区域,将其替换为另一个官能团。
典型的例子包括芳香族亲电取代和醇脱水。
自由基取代自由基取代是指通过自由基试剂攻击碳原子上的氢,将其替换为另一个官能团。
典型的例子包括卤代烷与氯气反应生成卤仿。
加成反应加成反应是指两个或多个分子结合形成一个新的分子的过程。
加成反应可以分为电子亲和性加成和亲核性加成两种类型。
电子亲和性加成电子亲和性加成是指通过电子丰富试剂攻击电子贫瘠区域,形成一个新的化学键。
典型的例子包括烯烃与卤素反应生成卤代烷。
亲核性加成亲核性加成是指通过亲核试剂攻击电子丰富区域,形成一个新的化学键。
典型的例子包括酮与氢氨酯反应生成胺。
消除反应消除反应是指一个分子中两个官能团之间或两个不同分子之间发生共价键断裂,形成双键或三键的过程。


氨基与烯烃加成反应催化剂-概述说明以及解释1.引言1.1 概述概述在有机化学领域中,氨基与烯烃加成反应是一种重要的反应类型,它可以有效地构建碳-氮键和碳-碳键。
这一类反应不仅在合成有机化合物的过程中具有广泛的应用,还在药物合成、材料科学和生物化学等领域中扮演着重要的角色。
氨基与烯烃加成反应的机理复杂而多样,常涉及中间体的生成和转化。
根据反应条件的不同,包括催化剂、溶剂和温度等因素的影响,这一类型反应的路径也会发生变化。
因此,理解和研究氨基与烯烃加成反应催化剂的性质和反应机理对于相关领域的发展具有重要意义。
近年来,许多研究人员致力于开发高效、选择性和环境友好的氨基与烯烃加成反应催化剂。
通过设计和合成新型催化剂,优化反应条件,并结合先进的表征手段和计算方法,许多新颖的催化剂已经成功应用于氨基与烯烃加成反应中。
这些催化剂不仅能够加速反应速率,还能够提高产率和产物的选择性。
本文将系统地总结氨基与烯烃加成反应催化剂的研究进展。
通过文献综述和实验结果的分析,我们将重点关注不同类型的催化剂,包括过渡金属催化剂、有机催化剂和生物催化剂等。
同时,我们将讨论这些催化剂在氨基与烯烃加成反应中的应用及其在相关领域的发展前景。
通过对氨基与烯烃加成反应催化剂的详细研究和探索,我们期望能够为有机合成领域的研究人员提供有价值的参考和指导,为开发更高效和环保的合成方法和工艺提供理论指导和技术支持。
同时,推动氨基与烯烃加成反应催化剂的进一步发展,将为新型功能材料和生物分子的合成提供新的思路和方法。
1.2 文章结构文章结构:本文将从以下几个方面来介绍氨基与烯烃加成反应催化剂的相关内容。
首先,在引言部分,将对本文涉及的氨基与烯烃加成反应进行概述,包括其在有机合成中的重要性和应用领域。
其次,将介绍本文的结构和内容安排,使读者对接下来的内容有一个清晰的概念。
接着,在正文部分,将详细探讨氨基与烯烃加成反应的重要性,包括其在制药、材料科学等领域的应用。

精心整理Mannich反应在本学期的《药物合成反应》中,我学到了许多单元反应,了解了这些反应的机理,还学到了这些反应在实际药物合成中的应用,在这些反应中,我对Mannich反应印象最深。
下面,我就Mannich反应详细的说说我所学到的。
摘要:本文简单的概述了曼尼希反应的发现历史,反应的机理,在药物合成中的应用。
很多生物碱都是通过曼尼希反应合成的,它具有很强的反应性,可以使很多在通常条件下难以进行的反应得以顺利进行。
正是Mannich反应反应原料的多变性,以及它在药物合成中的广泛应用,使我对它产生了浓厚的兴趣。
关键词0引言Mannich早在L.Henry0.75%。
90%。
2.1反应是仲胺、伯胺及氨。
胺/氨的作用是活化另一个反应物醛。
2.2反应条件我对Mannich反应感兴趣的一大原因是:Mannich反应在酸或碱催化下都可以进行,但是反应机理却差别很大。
不过,曼尼希反应虽然在酸碱性条件下都能进行,但是更为常见的是酸催化。
酸性条件下,路易斯酸和质子酸都可以,反应一般在水、乙酸或醇中进行,加入少量盐酸以保证酸性。
在Mannich反应过程中,酸对反应的作用有三点:1)作为反应中的介质;2)提供氢离子,并对反应起倦化作用;3)对于不以游离态存在的曼尼希碱,可通过直接生成其盐类而使产物得到分离和纯化。
曼尼希反应通常需在高温下和质子溶剂中进行,反应时间长,容易生成副产物。
2.3反应机理1)酸催化的反应亲核性较强的胺与甲醛反应,生成N-羟甲加成物,并在酸催化下脱水生成亚甲胺离子,进而向烯醇式的酮作亲电进攻而得到产物。
2)碱催化的反应由甲醛和胺的加成物N-羟甲基胺在碱性条件下,与酮的碳负离子进行缩合而得。
2.4反应产物反应产物成为曼尼希碱,可分为β-氨基酮、β-氨基醛等,β-氨基酮是有机合成的重要中间体,可由它进一步制的腈、γ-酮酸、α,β-不饱和醛酮。
如:或许,正是曼尼希碱能进一步制成其他产物的性质导致了它在药物合成中的广泛应用。

双烯加成反应一、前言双烯加成反应是有机化学中的一种重要反应,广泛应用于制备有机化合物。
本文将从以下几个方面详细介绍双烯加成反应。
二、双烯加成反应的概念双烯加成反应是指两个不饱和化合物中的双键发生加成反应,形成新的化合物。
该反应通常需要催化剂存在,并且常常伴随着环化或者开环等过程。
三、双烯加成反应的分类1. 电子不对称性双烯加成反应:指两个不饱和化合物中一个具有电子亲和性,一个具有电子供给性,或者两者同时具备。
典型的例子包括迈克尔加成反应和迪尔斯-阿尔德反应。
2. 电荷对称性双烯加成反应:指两个不饱和化合物中都具有相同的电荷性质,即均为亲电性或均为亲核性。
典型的例子包括环氧化-开环和卡宾-卡宾偶联等。
3. 立体选择性双烯加成反应:指在两个不饱和化合物中,反应发生时需要考虑它们的立体结构,通常需要特定的催化剂存在。
典型的例子包括锁骨烯加成反应和不对称二烯加成反应等。
四、双烯加成反应的机理双烯加成反应的机理多种多样,但是通常都涉及到中间体或者过渡态的形成。
下面以迈克尔加成反应为例进行讲解。
1. 迈克尔加成反应机理迈克尔加成反应是一种电子不对称性双烯加成反应,其机理如下:(1)亲核试剂进攻:亲核试剂(如胺、硫醇等)进攻α-位上的羰基碳,形成一个负离子中间体。
(2)负离子中间体:负离子中间体与具有电子供给性的不饱和化合物发生Michael加成,形成一个新的碳-碳键,并且还原负离子中间体。
(3)脱水:在碱催化条件下进行脱水,生成α,β-不饱和羰基化合物。
五、双烯加成反应在有机合成中的应用1. 迈克尔加成反应:迈克尔加成反应广泛应用于药物合成、天然产物合成等领域,例如合成心脏病药物普萘洛尔、抗癌药物多柔比星等。
2. 迪尔斯-阿尔德反应:迪尔斯-阿尔德反应是一种重要的环化反应,可以制备出具有多种不同环结构的化合物,例如制备苯并环己烷、环戊二烯基丙酮等。
3. 环氧化-开环反应:环氧化-开环反应可以制备出具有羟基或羧基官能团的化合物,例如制备马来酸二乙酯、丁二酸二甲酯等。

一、Arbuzow反应(重排)亚磷酸三烷基酯作为亲核试剂与卤代烷作用,生成烷基膦酸二烷基酯和一个新的卤代烷:卤代烷反应时,其活性次序为:R'I >R'Br >R'Cl。
除了卤代烷外,烯丙型或炔丙型卤化物、a-卤代醚、a- 或 b-卤代酸酯、对甲苯磺酸酯等也可以进行反应。
当亚酸三烷基酯中三个烷基各不相同时,总是先脱除含碳原子数最少的基团。
本反应是由醇制备卤代烷的很好方法,因为亚磷酸三烷基酯可以由醇与三氯化磷反应制得:如果反应所用的卤代烷 R'X 的烷基和亚磷酸三烷基酯 (RO)3P 的烷基相同(即 R' = R),则 Arbuzow反应如下:这是制备烷基膦酸酯的常用方法。
除了亚磷酸三烷基酯外,亚膦酸酯 RP(OR')2和次亚膦酸酯 R2POR' 也能发生该类反应,例如:反应机理一般认为是按 S N2 进行的分子重排反应:反应实例二、Arndt-Eister 反应酰氯与重氮甲烷反应,然后在氧化银催化下与水共热得到酸。
反应机理重氮甲烷与酰氯反应首先形成重氮酮(1),(1)在氧化银催化下与水共热,得到酰基卡宾(2),(2)发生重排得烯酮(3),(3)与水反应生成酸,若与醇或氨(胺)反应,则得酯或酰胺。
反应实例三、Baeyer----Villiger 反应反应机理过酸先与羰基进行亲核加成,然后酮羰基上的一个烃基带着一对电子迁移到-O-O-基团中与羰基碳原子直接相连的氧原子上,同时发生O-O键异裂。
因此,这是一个重排反应具有光学活性的3---苯基丁酮和过酸反应,重排产物手性碳原子的枸型保持不变,说明反应属于分子重排:不对称的酮氧化时,在重排步骤中,两个基团均可迁移,但是还是有一定的选择性,按迁移能力其顺序为:醛氧化的机理与此相似,但迁移的是氢负离子,得到羧酸。
反应实例酮类化合物用过酸如过氧乙酸、过氧苯甲酸、间氯过氧苯甲酸或三氟过氧乙酸等氧化,可在羰基旁边插入一个氧原子生成相应的酯,其中三氟过氧乙酸是最好的氧化剂。
一、Arbuzow反应(重排)亚磷酸三烷基酯作为亲核试剂与卤代烷作用,生成烷基膦酸二烷基酯和一个新的卤代烷:卤代烷反应时,其活性次序为:R'I >R'Br >R'Cl。
除了卤代烷外,烯丙型或炔丙型卤化物、a-卤代醚、a- 或 b-卤代酸酯、对甲苯磺酸酯等也可以进行反应。
当亚酸三烷基酯中三个烷基各不相同时,总是先脱除含碳原子数最少的基团。
本反应是由醇制备卤代烷的很好方法,因为亚磷酸三烷基酯可以由醇与三氯化磷反应制得:如果反应所用的卤代烷 R'X 的烷基和亚磷酸三烷基酯 (RO)3P 的烷基相同(即 R' = R),则Arbuzow反应如下:这是制备烷基膦酸酯的常用方法。
除了亚磷酸三烷基酯外,亚膦酸酯 RP(OR')2和次亚膦酸酯 R2POR' 也能发生该类反应,例如:反应机理一般认为是按 S N2 进行的分子内重排反应:反应实例二、Arndt-Eister 反应酰氯与重氮甲烷反应,然后在氧化银催化下与水共热得到酸。
反应机理重氮甲烷与酰氯反应首先形成重氮酮(1),(1)在氧化银催化下与水共热,得到酰基卡宾(2),(2)发生重排得烯酮(3),(3)与水反应生成酸,若与醇或氨(胺)反应,则得酯或酰胺。
反应实例三、Baeyer----Villiger 反应反应机理过酸先与羰基进行亲核加成,然后酮羰基上的一个烃基带着一对电子迁移到-O-O-基团中与羰基碳原子直接相连的氧原子上,同时发生O-O键异裂。
因此,这是一个重排反应具有光学活性的3---苯基丁酮和过酸反应,重排产物手性碳原子的枸型保持不变,说明反应属于分子内重排:不对称的酮氧化时,在重排步骤中,两个基团均可迁移,但是还是有一定的选择性,按迁移能力其顺序为:醛氧化的机理与此相似,但迁移的是氢负离子,得到羧酸。
反应实例酮类化合物用过酸如过氧乙酸、过氧苯甲酸、间氯过氧苯甲酸或三氟过氧乙酸等氧化,可在羰基旁边插入一个氧原子生成相应的酯,其中三氟过氧乙酸是最好的氧化剂。
1. 烯烃的分类:累积二烯烃(H 2C=C=CH 2)、孤立二烯烃、共轭二烯烃2. 烯烃的结构特征:未参与杂化的p 轨道与烯烃平面垂直。
如果吸收一定的能量,克服了p 轨道的结合力,顺式或反式可以互转。
C=C 键的平均键能为610.9kJ ·mol -1,C-C σ键的平均键能为347.3 kJ ·mol -1,因此 键的键能大约为263.6 kJ ·mol -1。
二元取代烯烃比一元取代烯烃稳定8.3~12.5 kJ ·mol -1。
所以烯烃取代越多越稳定。
1,3-丁二烯是一个平面型分子。
键长均匀化是共轭烯烃的共性。
3. 烯烃的物理性质含2~4个碳原子的烯烃是气体,含5~15个碳原子的烯烃为液体,高级烯烃为固体。
所有烯烃都不溶于水,所有烃(C 、H )都不溶于水。
燃烧时,火焰明亮。
在sp n 杂化轨道中,n 数值越小,s 性质越强。
由于s 电子靠近原子核,它比p电子与原子核结合得更紧,轨道的电负性越大,所以电负性大小次序为s>sp>sp 2>sp 3>p 。
即碳原子的电负性随杂化时s 成分的增大而增大。
烯烃由 于sp 2碳原子的电负性比sp 3碳原子的大,比烷烃容易极化,成为有偶极矩的分子。
以丙烯为例,甲基与双键碳原子相连的键易于极化,键电子偏向于sp 2碳原子,形成偶极,负极指向双键,正极位于甲基一边。
因此当烷烃和不饱和碳原子相连时,由于诱导效应与超共轭效应成为给电子基团。
第八章 烯烃 亲核加成 自由基加成 共轭加成①在abC=Cab类型的烯烃中,顺型异构体总是偶极分子,而且沸点较高。
这对于识别顺反异构体是很有用的。
②也可以通过X射线衍射的方法测定相同基团之间的距离,以确定顺反异构体。
③核磁共振也是测定顺反异构体的有效方法。
共轭烯烃物理性质的特点:①紫外(电子)吸收光谱——向长波方向移动②易极化——折射率增高③趋于稳定——氢化热(烯烃催化加氢生成烷烃放出的热)降低。
常见人名反应及机理 Document number:NOCG-YUNOO-BUYTT-UU986-1986UTBeckmann重排肟在酸如硫酸、多聚磷酸以及能产生强酸的五氯化磷、三氯化磷、苯磺酰氯、亚硫酰氯等作用下发生重排,生成相应的取代酰胺,如环己酮肟在硫酸作用下重排生成己内酰胺:反应机理在酸作用下,肟首先发生质子化,然后脱去一分子水,同时与羟基处于反位的基团迁移到缺电子的氮原子上,所形成的碳正离子与水反应得到酰胺。
迁移基团如果是手性碳原子,则在迁移前后其构型不变,例如:Birch还原反应机理Cannizzaro反应反应机理Claisen酯缩合含有α-氢的酯在醇钠等碱性缩合剂作用下发生缩合作用,失去一分子醇得到β-酮酸酯。
如2分子乙酸乙酯在金属钠和少量乙醇作用下发生缩合得到乙酰乙酸乙酯。
二元羧酸酯的分子内酯缩合见反应机理乙酸乙酯的α-氢酸性很弱(,而乙醇钠又是一个相对较弱的碱(乙醇的pKa~),因此,乙酸乙酯与乙醇钠作用所形成的负离子在平衡体系是很少的。
但由于最后产物乙酰乙酸乙酯是一个比较强的酸,能与乙醇钠作用形成稳定的负离子,从而使平衡朝产物方向移动。
所以,尽管反应体系中的乙酸乙酯负离子浓度很低,但一形成后,就不断地反应,结果反应还是可以顺利完成。
Claisen_Schmidt反应一个无α-氢原子的醛与一个带有α-氢原子的脂肪族醛或酮在稀氢氧化钠水溶液或醇溶液存在下发生缩合反应,并失水得到α,β-不饱和醛或酮:反应机理Clemmensen还原醛类或酮类分子中的羰基被锌汞齐和浓盐酸还原为亚甲基:此法只适用于对酸稳定的化合物。
对酸不稳定而对碱稳定的化合物可用还原。
Cope重排1,5-二烯类化合物受热时发生类似于O-烯丙基重排为C-烯丙基的重排反应()反应称为Cope 重排。
这个反应30多年来引起人们的广泛注意。
1,5-二烯在150—200℃单独加热短时间就容易发生重排,并且产率非常好。
Cope重排属于周环反应,它和其它周环反应的特点一样,具有高度的立体选择性。
烯醇和烯胺衍生物的卤取代反应烯醇的卤取代反应烯醇是由酮或醛与强碱反应生成的,其反应性较高,可与卤素发生加成反应,形成卤代烯醇。
反应机理如下:烯醇中的烯醇负离子进攻卤素分子,形成四面体加成物。
四面体加成物发生离去基团离去,生成卤代烯醇。
卤代烯醇可以进一步转化为其他衍生物,如醛、酮和环丙烷。
烯胺的卤取代反应烯胺是由胺与醛或酮反应生成的,其反应性类似于烯醇。
它可以与卤素反应,形成卤代烯胺。
反应机理如下:烯胺中的氨基氮进攻卤素分子,形成四面体加成物。
四面体加成物发生离去基团离去,生成卤代烯胺。
卤代烯胺也可以进一步转化为其他衍生物,如胺、亚胺和环丙胺。
卤取代反应的区域选择性烯醇和烯胺的卤取代反应通常具有区域选择性,主要取决于亲核亲电性质和位阻效应。
当卤素为亲电试剂时,反应倾向于发生在烯醇或烯胺中正电荷密度最大的碳原子上。
当卤素为亲核试剂时,反应倾向于发生在烯醇或烯胺中负电荷密度最大的碳原子上。
位阻效应也会影响反应的区域选择性,卤素优先进攻空间位阻最小的碳原子。
反应条件烯醇和烯胺的卤取代反应通常在溶剂中进行,如二氯甲烷或乙腈。
反应温度和催化剂的选择取决于卤素的亲核亲电性质和反应物本身的反应性。
当卤素为亲电试剂时,反应通常在低温下进行,以避免副反应。
当卤素为亲核试剂时,反应需要在高温下进行,以促进反应的进行。
催化剂的使用可以提高反应的速率和选择性,常用的催化剂包括路易斯酸和碱。
应用烯醇和烯胺的卤取代反应在有机合成中有着广泛的应用,包括:碳碳键的形成官能团的引入环状化合物的合成天然产物的合成。
胺烯加成反应机理
胺烯加成反应是一种重要的有机合成反应,其能够生成含有环且具有生物活性的化合物。
其中,胺烯化合物是指胺基和烯基在同一个分子中的化合物,这些化合物可以通过与另一个有机分子发生加成反应。
1. 形成亲电性间体
在胺烯加成反应中,基本的前提条件是烯烃分子必须具有一个不饱和键,以提供反应所需的亲电性中间体。
首先,烯烃分子吸引胺基分子的亲电性中心,从而形成一个亲电性间体。
这个过程可以在光照、加热或使用催化剂的条件下实现。
2. 亲核加成
接下来,作为亲核试剂的胺基分子进攻亲电性间体,形成Carbocation中间体。
这是一个高能状态的分子,因为它带有正电荷,因此它需要寻找更稳定的状态。
3. 消除质子
由于Carbocation中间体是非常不稳定的,它会尝试通过消除质子来降低其能量。
这可能导致新的双键形成,并与烯烃原子形成一个碳-碳单键,从而形成了一个新的C-N键。
4. 闭合环
此后,在反应中形成了一个C-N键,胺烯加成反应还有一个步骤,就是环化的过程。
在此步骤中,生成的分子会自我组装,使它们具有对称的几何结构。
5. 生成产物
在完成环化过程后,分子中多余的分子或基团可能会被去除,以生成最终产物。
这个新的有机分子可以具有生物活性,例如可用于药物制备。
6. 反应机理总结
综上所述,胺烯加成反应机理是一个多步反应。
其中,最重要的步骤是在亲核加成中形成Carbocation中间体,这是反应能量最高的步骤。
该反应的特点是需要烯烃分子在反应中提供亲电性,这是实现反应的最基本的条件。
通过这个反应机理,可以生成具有生物活性的化合物,为合成新的药物和抗生素提供了很好的基础。