醛酮总结
- 格式:doc
- 大小:147.00 KB
- 文档页数:6

学习必备精品知识点知识归纳:醇类、醛酮、羧酸、酯类的性质 1、醇类:饱和一元脂肪醇:C n H 2n+2O 2 ① 醇与活泼金属反应生成醇钠和氢气: 2 R —CH 2—OH + 2 Na ---------- - 2 R-CH 2—ONa + H 2 t ② 醇催化氧化生成(伯醇、仲醇)醛或酮(叔醇,季醇不能发生这种反应 ): H O 1 △ II H C OH + C U O — H 1 — C —H + C U + H 2O H H O 1 AII R —C —OH 1 + C U O -R- -C —H + C U + H2Ol HOH O 1 AIIR i — C ——+ C U O —Ri —C — R 2 + C U + H 2I H 2、醛酮:饱和一元脂肪醛酮:C n H 2n O ①醛氧化成羧酸(酮不能发生这种反应):O O II △ II R —C — H + 2C U (OH )2 R — C —OH + Cu 2O + H 2O O O II △ II R —C 一H + 2[Ag(NH 3)2]OH R —C —OH + 2Ag + 4NH 3 + H 2O ②醛加氢还原成伯醇或仲醇,酮加氢还原成叔醇: O 催化剂 R —C —H + H 2 R —CH 2 — OH 3、羧酸:饱和一元脂肪酸:C n H 2n O 2 ① 羧酸与醇发生酯化反应生成酯:O 浓硫酸 R L C —OH + R i —CH 2—OH — ' A ②高级脂肪酸与甘油发生酯化反应生成油脂: O OH催化剂 丨 R 1—C —R 2+ H 2 Ri —CH —R 2 A. O II R —C —O ° CH^ R 1 + H 2O II H 2C —OH O 浓硫酸 3 R —C — OH + HC —OH - A H 2C -OH R —C —O — CH 2 O II R —C —O — CH + 3H 2O O II R —C —O —CH 2 4、饱和一兀脂肪酯: C n H 2n O 2 ①酯在酸催化、碱催化下水解:学习必备精品知识点OIIR — C — 0—CH?—R i + H 2O 0IIR—C—0 — CH2 - R i + NaOHIIR i — C — 0H + R i—CH 2—0H 0IIR i — C—ONa + R i — CH2— 0H②油脂在酸催化、酶催化和碱催化下水解:IIR—C —0—CH2IIR—C — 0—CH + 3H 20 H+或酶0 II3 R—C —0HH2C — 0H+ HC —0HIIR —C — 0 —CH 2 H2c — 0HIIR — C — 0 —CH 2 0IIR—C — 0—CH + 3Na0H 0 IIR—C—0 —C H 2H2C —0H4 II3 R — C—0Na + HC — 0HH2C — 0H0 0 00H 0202 II 浓硫酸R CH2 X R—CH2—0H —R—C_H —-R —C—0H R —C —0- CH2 — RH2 △注意转化关系:。

醛酮知识要点—邢其毅基础有机化学醛酮是有机化合物中常见的一类官能团,具有广泛的应用和重要的地位。
在邢其毅基础有机化学中,我们需要掌握醛酮的结构与性质、合成方法以及相关反应等知识要点。
本文将从这几个方面进行详细的阐述。
一、醛酮的结构与性质:醛酮是一类含有羰基的化合物,其中醛代表羰基的碳原子上连接有至少一个氢原子,而酮代表羰基的碳原子上连接有两个有机基团。
醛酮的羰基碳原子上还可以有其他取代基,这使得醛酮的结构多样性较高。
醛酮的羰基碳原子具有亲电性,因此容易受到亲核试剂的攻击。
此外,醛酮的羰基碳原子还可以通过质子转移反应,参与有机合成中的重要步骤。
二、醛酮的合成方法:1. 醛酮的氧化还原反应:醛酮可以通过将醛或酮经过氧化还原反应来合成。
例如,醛可以被氧化成相应的羧酸,然后再还原成醛酮。
此外,酮也可以通过还原成醇,然后再氧化成醛酮。
2. 反应的亲核试剂攻击:醛酮的羰基碳原子可以被亲核试剂攻击,形成加成产物,然后通过质子转移反应生成醛酮。
常见的亲核试剂包括水、醇、胺等。
3. 氰化反应:醛酮可以和氰化物反应生成氰醇盐,然后再发生质子转移反应生成醛酮。
这是一种常用的合成醛酮的方法。
三、醛酮的相关反应:1. 氧化反应:醛酮可以被氧化成相应的羧酸。
常用的氧化剂包括KMnO4、CrO3等。
2. 质子转移反应:醛酮的羰基碳原子上的氢可以通过质子转移反应发生变化,生成醇或羧酸。
3. 加成反应:醛酮的羰基碳原子可以被亲核试剂攻击,形成加成产物。
例如,水的加成反应生成醇,胺的加成反应生成亚胺等。
4. 消除反应:醛酮的羰基碳原子与邻位或相邻的碳原子发生消除反应,生成不饱和化合物。
四、醛酮在有机合成中的应用:醛酮是有机合成中常用的中间体,广泛应用于各个领域。
例如,在药物合成中,醛酮作为重要的中间体参与多步合成反应,构建复杂的有机结构。
此外,醛酮的还原反应也可以用于合成醇化合物。
结论:醛酮作为基础有机化学中的重要内容,掌握其结构与性质、合成方法以及相关反应是我们在有机化学学习中的基础要点。

初中化学知识点归纳醛和酮的结构和性质初中化学知识点归纳:醛和酮的结构和性质醛和酮是有机化合物中常见的两类功能团。
它们的结构和性质对于理解有机化学的基础知识具有重要意义。
本文将对醛和酮的结构和性质进行归纳总结,以帮助初中化学学习者更好地理解和掌握这两类化合物。
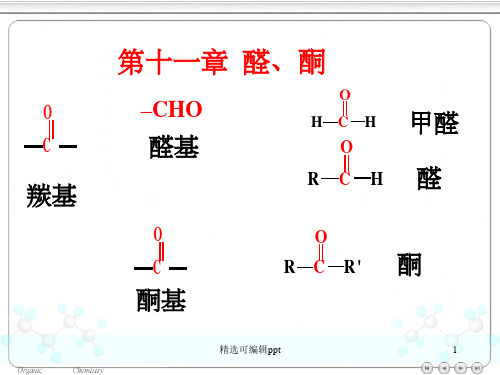
一、醛的结构和性质1. 结构特点:醛分子中含有一个碳氧双键和一个与之相连的氢原子,通常以-CHO作为官能团,表示为RCHO。
醛的通用结构式为R-CHO。
2. 命名规则:醛的命名以碳原子所在的主链为基础,以-al结尾。
例如,甲醛(HCHO)、乙醛(CH3CHO)等。
3. 性质特点:醛具有以下性质:(1)醛可以发生醛缩反应,即与具有活性氢的化合物反应生成醇。
(2)醛在氧化条件下可以被氧气氧化为相应的酸。
(3)醛可以被氢气还原为相应的醇。
二、酮的结构和性质1. 结构特点:酮分子中含有一个碳氧双键,但没有与之相连的氢原子,通常以-CO-R作为官能团表示,表示为R-CO-R'。
酮的通用结构式为R-CO-R'。
2. 命名规则:酮的命名以碳原子所在的主链为基础,以-one结尾。
例如,丙酮(CH3COCH3)、己酮(CH3CO(CH2)4COCH3)等。
3. 性质特点:酮具有以下性质:(1)酮无法发生醛缩反应,因为酮分子中没有活性氢原子。
(2)酮可以被氧气氧化为相应的酸。
(3)酮可以被氢气还原为相应的醇。
三、醛和酮的区别与联系1. 结构区别:醛分子中有一个与碳氧双键相连的氢原子,而酮分子中没有与碳氧双键相连的氢原子。
2. 化学性质区别:醛与具有活性氢的化合物发生醛缩反应,而酮无法进行这种反应。
醛和酮都可以被氧气氧化为相应的酸。
醛和酮都可以被氢气还原为相应的醇。
3. 化学性质联系:醛和酮都可以发生氧化还原反应,参与一些有机合成的反应。
醛和酮都具有碳氧双键,因此在化学试剂中易受到亲电试剂的攻击。
总结:醛和酮是有机化合物中常见的两类功能团。
醛分子中含有一个与碳氧双键相连的氢原子,而酮分子中没有与碳氧双键相连的氢原子。

醛与酮知识点总结一、醛和酮的性质醛和酮都是含有羰基的有机化合物。
醛的通式为RCHO,酮的通式为RCOR',其中R和R'分别代表有机基团。
醛中的碳原子上含有一个羰基,而酮中的碳原子上同时连有两个有机基团。
醛和酮的结构式如下:醛和酮的存在形式是平行极性化合物,它们通常都是无色、易挥发的液体,具有特殊的刺激性气味。
醛和酮在水中能够发生氢键作用,因此它们有一定程度的溶解性,但溶解度并不高。
在物理性质上,醛和酮在常温常压下的沸点和熔点相对较低,而其密度通常较小。
这些性质为醛和酮的分离和纯化提供了一定的便利。
二、醛和酮的命名正式命名:根据IUPAC的命名规则,醛的命名以羰基所在的碳原子为起点,加上-AL的后缀,例如甲醛和丙醛。
酮的命名则以含有羰基的两个碳原子之间的主链为基础,并在主链两端进行编号,以表示羰基的位置。
酮的命名则以-ONE为后缀,例如丙酮。
通用命名:通用命名系统则根据它的名称和结构,例如甲醛可以通用地称为(甲醛)或(甲基醛)。
这种命名方法通常适用于一些小分子的醛和酮。
三、醛和酮的合成1. 氧化醛和酮:氧化醛或酮可用氧化剂氧化相应的醇得到。
2. 加成反应:双键在加成反应中会发生开裂,生成醛和酮。
例如,过氧化氢对双键的加成的产物是醛;双键的高效对映选择性氢氧化产物是酮。
3. 酸碱催化的羰基化反应:更常见的有机合成方法是通过酸或碱对羟基的酸碱催化下,进行醛和酮的羰基化反应。
四、醛和酮的反应1. 还原反应:醛和酮均可通过还原反应生成相应的醇。
常见的还原剂包括金属碱金属、醛酮类还原剂和其他有机金属还原剂。
2. 条件反应:醛和酮在适当的条件下可以发生亲核加成反应、亲电取代反应、氧化反应、缩合反应、酰基化反应等多种有机反应。
3. 氧化反应:醛可以被氧化成酸,而酮则不易被氧化。
常见的氧化剂有氧气、高锰酸钾、过氧化氢等。
五、醛和酮的生物学作用醛和酮在人体内有着重要的生物学作用。
它们是生物体内糖类和脂肪酸代谢的中间产物,也是许多生物体内的代谢产物。

CH 3C OH C O HCH 3CHCNOH 第三节 醛 酮一、乙醛(一)组成和结构分子式:C 2H 4O 结构简式: 或CH 3CHO 结构式:官能团:醛基:-CHO 或(二)物理性质:无色、有刺激性气味的液体,密度比水小,沸点20.8℃,易挥发,易燃烧,能与水、乙醇等互溶。
(三)化学性质:具有醛基的性质1、加成反应(还原反应):与H2、HCN 反应,体现乙醛的氧化性 (1)催化加氢:CH 3CHO +H 2催化剂 △CH 3CH 2OH(2)与HCN 反应:在醛基的碳氧双键中,由于氧原子的电负性较大,碳氧双键中的电子偏向氧原子,使氧原子带部分负电荷,碳原子带部分正电荷,从而使醛基具有较强的极性。
CH 3CHO +HCN催化剂 △(2-羟基丙腈)实质:注:当极性分子与醛基发生加成反应时,带正电荷的原子或原子团连接在氧原子上,带负电荷的原子或原子团连接在碳原子上。
2、氧化反应:体现乙醛的还原性 (1)可燃性:2C 2H 4O+O 2−−→−点燃 4CO 2+H 2O(2)被强氧化剂氧化:遇到酸性高锰酸钾溶液和溴水使其褪色注:必须是溴水,溴的CCl 4溶液不会氧化醛基,因为其中不含氧 (3)催化氧化(加氧):2CH 3CHO+O 2催化剂 △2CH 3COOH(4)被弱氧化剂氧化:①银镜反应:CH 3CHO +2Ag(NH 3)2OH ――→△2Ag ↓+CH 3COONH 4+3NH 3+H 2O说明:a 、银氨溶液必须现用现配,氨水不能太浓,银氨溶液不能久置,否则会生成易爆炸的物质(Ag 3N 和Ag 2NH )b 、配制方法:向AgNO 3溶液中滴加稀氨水至产生的沉淀恰好溶解c 、加热时采用水浴加热d 、若反应试管不洁净,或加热时振荡,或醛的用量不当,均可能生成黑色疏松的小颗粒(Ag )H C H Oe 、反应所用试管应先用热碱(NaOH )清洁,再用蒸馏水洗f 、除杂:用稀[]⎩⎨⎧+=++↑+=+++++423233322)(2g 343NH Ag H NH Ag OH NO NO A HNO Ag Ag HNO 除银氨溶液::除g 、用途:用来检验醛基,工业上用于制镜或保温瓶胆②与新制的Cu(OH)2反应:CH 3CHO+2Cu(OH)2+NaOH ――→△CH 3COONa+Cu 2O ↓(砖红色)+3H 2O说明:a 、必须用新制的Cu(OH)2:一方面,新制的Cu(OH)2为絮状物,跟醛的接触面积大另一方面,久置的Cu(OH)2,易被氧化成Cu 2(OH)2CO 3b 、制备Cu(OH)2时,NaOH 必须过量,且质量分数要大些,这样形成的Cu(OH)2能加快乙醛的氧化使现象明显c 、该反应必须加热到沸腾,才有明显的红色沉淀产生,但不能太久,否则会有黑色的沉淀CuO 生成d 、用途:检验醛基,医疗上检测尿糖注:RCH 2OH 22u O C H ∆∆−−−−−→←−−−−−、、、催化剂、 RCHO 3222()()Ag NH OH Cu OH O ∆∆−−−−−−−−−→、、或、催化剂、 RCOOH 二、醛(一)定义:由烃基(或氢)与醛基相连而构成的化合物(二)分类:醛基的个数:一元醛、二元醛、多元醛烃基的种类:脂肪醛、脂环醛、芳香醛 烃基是否饱和:饱和醛、不饱和醛(三)通式:醛的通式:R-CHO (R 为烃基);饱和一元醛的通式:C n H 2n O(n≥1) (四)物理性质:1、随着碳原子数的增多,熔沸点逐渐升高2、随着碳原子数的增多,在水中的溶解度逐渐减小,低级醛易溶于水(CH 3CHO 、HCHO )3、饱和一元醛中只有甲醛为气态(五)化学性质:1、加成反应(还原反应):与H2、HCN 反应; 2、氧化反应: (1)燃烧 (2)被高锰酸钾、溴水等强氧化剂氧化(3)被银氨溶液、新制氢氧化铜等若氧化剂氧化(六)常见醛——甲醛、丙醛、苯甲醛1、甲醛(1)组成和结构:分子式:CH 2O 结构式: (两个醛基,相当于二元醛) 四个原子共面, 结构简式:HCHO(2)物理性质:是最简单的醛。
一.醛酮羰基上的亲核加成反应影响因素:电子效应、空间效应和亲核试剂的亲核能力1. 与氢氰酸的加成反应条件:碱催化,醛、脂肪族甲基酮和8个碳以下的环酮。
应用:制备多一个C 的 -羟基酸2.与NaHSO3 加成产物:白色结晶物反应物条件:醛(芳香醛、脂肪醛)脂肪族甲基酮8个碳以下的环酮。
应用:醛或甲基酮的分析醛或甲基酮的纯化鉴别醛脂肪族甲基酮8个碳以下的环酮3. 与醇和水的加成(1) 与醇的加成注意:可逆反应条件:干燥HCl常用于:保护醛基,抗氧化、抗还原、抗碱(2)与醛的加成与醛相比,酮与醇反应生成缩酮的反应比较困难。
但醇易于乙二醇作用,生成具有五元环状结构的缩酮。
条件:干燥HCl应用:保护酮基或连二醇结构4. 与Grignard试剂的加成条件:乙醚应用:制备各种醇(碳链增长)5. 醛酮与胺类化合物的缩合(1)与2, 4-二硝基苯肼反应(羰基化试剂)生成2, 4-二硝基苯腙(黄色固体)注意:可逆反应条件:所有醛类,酮类物质酸性条件应用:鉴别醛酮类物质(2)羰基化合物与伯胺加成产生希夫碱注意:可逆反应可从羰基的正电性、试剂的亲核性、反应物的空间位阻分析亲核反应二、α-碳和α-氢的反应醛、酮分子中,与羰基直接相连的碳原子称α-碳,α-碳上的氢成为α-氢。
含α-H的醛、酮,其α-H受C=O影响,可发生离解。
(①羰基的吸电子作用增大了C-H键的极性,α-氢易离去②α-氢离去后,醛,酮可通过形成负电荷离域化氧原子和α-碳上,趋于稳定)α-H 的反应主要有两种:卤代(醛酮合成羧酸)、缩合(醛酮合成醇)Ⅰ.卤代(卤仿)反应物:α-C 上有三个活泼氢的醛、酮,含有结构的醇。
(先被次碘酸盐氧化成甲基酮和乙醛) 条件:碱催化现象:淡黄色晶体,有特殊气味 应用:合成少一个C 的羧酸鉴别乙醛、甲基酮及Ⅱ.缩合反应(醇醛缩合)反应物 :含有α-H 的醛(酮较难) 条件:稀碱应用:两分子相同的醛(或酮)加成,C 原子数成倍增加 Ⅲ.酮、醇烯互变含有两个羰基的醛或酮既能发生碘仿反应,又能使溴水褪色、与三氯化铁发生显色反应、跟金属钠反应放出氢气。
大学有机化学复习总结醛酮与羧酸的性质与反应一、醛酮的性质与反应1. 结构与物理性质醛酮是含有羰基(C=O)官能团的有机化合物,在结构上可以分为醛和酮两类。
由于羰基的存在,醛酮具有许多特殊的物理性质,如较高的沸点、溶解性较好等。
2. 醛酮的还原反应醛酮具有被还原为醇的反应性质。
在还原反应中,醛酮可以和还原剂如氢气、金属还原剂等发生反应,生成相应的醇。
这种反应常用于制备醇类化合物。
3. 醛酮的氧化反应醛酮也可以发生氧化反应。
在氧化反应中,醛可以被氧化成为羧酸,而酮则不易发生氧化。
常用的氧化剂有酸性高锰酸钾(KMnO4)、过氧化氢(H2O2)等。
4. 醛酮的加成反应醛酮具有多种加成反应,其中包括亲核加成和亲电加成。
亲核加成指的是醛酮中的羰基受到亲核试剂的进攻,生成产物;亲电加成则是亲电试剂攻击醛酮中的羰基,形成新的化学键。
5. 醛酮的缩合反应醛酮通过缩合反应可以形成α,β-不饱和醛和酮。
这种反应可以通过存在碱性条件下进行,如使用极性溶剂催化的aldol缩合反应。
二、羧酸的性质与反应1. 结构与物理性质羧酸是含有羧基(-COOH)官能团的有机化合物。
羧酸在结构上可分为脂肪族羧酸和芳香族羧酸两类。
由于羧基的存在,羧酸具有特殊的物理性质,如较高的沸点、溶解性较好等。
2. 羧酸的酸碱特性羧酸具有明显的酸性,其酸碱性主要表现在羧基的质子化,生成共轭碱。
当羧酸溶于水中时,会产生酸性溶液,如乙酸的水溶液呈现酸性。
3. 羧酸的酯化反应羧酸可以发生与醇的酯化反应。
在酯化反应中,羧酸与醇经酯键的形成生成相应的酯。
酯化反应常以强酸或酸催化下进行。
4. 羧酸的氨解反应羧酸可以与氨或氨的衍生物发生反应,生成相应的酰胺。
这种反应称为氨解反应,可由酸催化或碱催化完成。
5. 羧酸的酰卤化反应羧酸可以与卤素(如氯、溴等)反应,生成相应的酰卤。
这种反应通常以无水物质存在下进行,如使用磷酰氯(POCl3)或羰基二氯化钛(TiCl2)催化。
十醛、酮知识点[知识要点]一、醛酮的结构和命名二、醛酮结构、光谱性质(羰基的特征吸收峰)三、化学性质(重点)1.亲核加成反应1.与HCN的加成,产物为丙烯腈,在水解产物为羧酸。
2.与NaHSO3加成3.与H2O的加成,生成偕二醇,但不稳定。
只有当羰基碳上连有吸电子基时,产物才稳定。
4.与ROH加成,发生醛缩反应,产物为缩醛或缩酮。
反应可逆,可以用来保护羰基。
5.与金属有机物加成,主要与格氏试剂,有机锂试剂反应,水解最终产物为醇。
6.与氨及其衍生物的加成反应。
7.Wittig 试剂加成:即与磷叶立徳的加成反应,此反应也叫维西蒂反应。
2.还原反应1.金属氢化物的还原(LiAlH4 NaBH4);2.催化加氢(氢化):分子中的双键、三键、羰基、氰基、硝基也一并被还原。
3.麦尔外因—庞多夫—维尔莱还原:醛酮在异丙醇和异丙醇铝的作用下,被还原为醇的反应。
4.克莱门森还原:醛酮在Zn/Hg +HCl的条件下被直接还原为烃的反应。
5.凯希尔—伍尔夫—黄鸣龙还原:醛酮与NH2-NH2在强OH-的条件下还原为烃的反应。
该方法与上述克莱门森还原法互补使用,一个适用于耐酸醛酮,一个适用于耐碱醛酮。
3. 氧化反应1.O2氧化。
2.高锰酸钾、重铬酸钾法氧化:高锰酸钾的氧化性通常强于重铬酸钾,高锰酸钾的还原产物复杂,如果是二氧化锰将很难从反应体系中分离出来。
3.醛的托伦试剂(新制的银氨溶液)和斐林试剂(新制的斐林试剂)氧化反应,氧化产物为羧酸,或羧酸盐。
4.酮与过氧酸发生贝耶尔—维林格反应:产物为酯。
4.歧化反应康尼查罗反应:无α-H的醛与强OH-共热时,会歧化,其中一分子被还原为醇,另一分子被氧化为羧酸。
5.α-H 的酸性1.互变异构:酮式与烯醇式的互变异构2.α-H 的卤代反应:醛酮分子中有多少个α-H,就可以被多少个卤原子取代。
如果分子中有3个α-H是被I取代,生成物叫“碘仿”,发生碘仿反应,而碘仿是黄色晶体,水溶性极小。
一.醛酮羰基上的亲核加成反应
影响因素:电子效应、空间效应和亲核试剂的亲核能力
1. 与氢氰酸的加成
反应条件:碱催化,醛、脂肪族甲基酮和8个碳以下的环酮。
应用:制备多一个C 的-羟基酸
2.与NaHSO3 加成
产物:白色结晶物
反应物条件:醛(芳香醛、脂肪醛)脂肪族甲基酮8个碳以下的环酮。
应用:醛或甲基酮的分析
醛或甲基酮的纯化
鉴别醛脂肪族甲基酮8个碳以下的环酮
3. 与醇和水的加成
(1) 与醇的加成
注意:可逆反应
条件:干燥HCl
常用于:保护醛基,抗氧化、抗还原、抗碱
(2)与醛的加成
与醛相比,酮与醇反应生成缩酮的反应比较困难。
但醇易于乙二醇作用,生成具有五元环状结构的缩酮。
条件:干燥HCl
应用:保护酮基或连二醇结构
4. 与Grignard试剂的加成
条件:乙醚
应用:制备各种醇(碳链增长)
5. 醛酮与胺类化合物的缩合
(1)与2, 4-二硝基苯肼反应(羰基化试剂)生成2, 4-二硝基苯腙(黄色固体)
注意:可逆反应
条件:所有醛类,酮类物质
酸性条件
应用:鉴别醛酮类物质
(2)羰基化合物与伯胺加成产生希夫碱
注意:可逆反应
可从羰基的正电性、试剂的亲核性、反应物的空间位阻分析亲核反应二、α-碳和α-氢的反应
醛、酮分子中,与羰基直接相连的碳原子称α-碳,α-碳上的氢成为α-氢。
含α-H的醛、酮,其α-H受C=O影响,可发生离解。
(①羰基的吸电子作用增大了C-H键的极性,α-氢易离去②α-氢离去后,醛,酮可通过形成负电荷离域化氧原子和α-碳上,趋于稳定)α-H 的反应主要有两种:卤代(醛酮合成羧酸)、缩合(醛酮合成醇)Ⅰ.卤代(卤仿)
反应物:-C 上有三个活泼氢的醛、酮,含有CH 3
CH OH
R(H)
结构的醇。
(先被次碘酸盐氧化成甲基酮和乙醛) 条件:碱催化
现象:淡黄色晶体,有特殊气味 应用:合成少一个C 的羧酸
鉴别乙醛、甲基酮及CH 3
CH OH
R(H)
Ⅱ.缩合反应(醇醛缩合) 反应物 :含有-H 的醛(酮较难)
条件:稀碱
应用:两分子相同的醛(或酮)加成,C 原子数成倍增加 Ⅲ.酮、醇烯互变
含有两个羰基的醛或酮既能发生碘仿反应,又能使溴水褪色、与三氯化铁发生显色反应、跟金属钠反应放出氢气。
(炔烃和水反应也生成醇烯) 三、氧化还原反应 (一) 氧化反应
通常,醛容易被氧化成羧酸,酮则难被氧化,实验室中课利用弱氧化剂能氧化醛而不氧化酮的特性,方便地鉴别醛与酮。
如:
硝酸银的氨溶液(即Tollens 试剂)与醛作用时,32()Ag NH 被还原成金属银沉积在试管壁上形成银镜,故称银镜反应。
Tollens 试剂不氧化碳碳双键。
Fehling 试剂(由硫酸铜与酒石酸钾钠的碱性溶液混合而成)与醛一起加热,2Cu 被还原成转红色的氧化亚铜沉淀析出。
Fehling 试剂不与芳香醛反应,故可用来鉴别脂肪醛与芳香醛。
RCHO + 2 [Ag(NH 3)2]OH
RCOONH 4
+ 2 Ag + 3 NH 3+ H 2O
RCHO + 2 Cu(OH)2+ NaOH
RCOONa + Cu 2O + 3 H 2O
CHO
CH 2CHO
Fehling 试剂
(—)
Cu 2O (砖红)
常见的弱氧化剂
名称Tollens 试剂
Fehling 试剂Benedict 试剂AgNO 3的氨水溶液CuSO 4、NaOH 和酒石酸钾钠的混合液CuSO 4、Na 2CO 3和柠檬酸钠的混合液
组成Ag (银镜)Cu 2O (砖红)
现象适用范围
所有醛
脂肪醛
脂肪醛
Cu 2O (砖红)
(二) 还原反应
Zn-Hg, HCl (锌汞齐加浓盐酸)—— Clemmensen 反应(羰基被还原成亚甲基)。
C O CH 2
在金属催化剂铂、镍等存在下,以2H 为还原剂使醛和酮还原
成相应的伯醇和仲醇。
氧化铝锂、氢化硼钠等金属氢化物可将醛、酮的羰基还原为伯醇和仲醇。
不还原碳碳双键。
C O
CH OH
CH 2CH 3
+
H 2O
C CH 3
O Zn H g ,H Cl
CH 3CH CHCH 2OH
CH 3CH CHCHO
①NaBH 4
②H 2O
Ni
H 2CH 3CH 2CH 2CH 2OH
(三). Cannizzaro 反应:(歧化反应)
反应物:不含 -H 的醛
反应条件:浓碱
HCHO
CHO +
浓NaOH
HCOONa
+
CH 2OH
H 2
/ Pt (Ni 、 Pd) R C H O RCH 2
OH
C O R
R ' R C H O H
R '
C H 2 C H 2
C
C
交叉歧化反应中HCHO
HCOOH
浓NaOH
CH 3OH HCOONa
+
2CH 2OH
+
COONa
(资料由官格,顾玉洁,潘鑫总结)。