醛,酮的反应与制备
- 格式:docx
- 大小:37.62 KB
- 文档页数:2


经典化学合成反应标准操作醛酮的经典合成目录1.前言 (4)2.由醇合成醛酮 (4)2.1铬(VI)试剂 (4)2.1.1 Jones氧化(Cr2O3/H2SO4/acetone) (4)2.1.2 Collins氧化(Cr2O3.2Py) (5)2.1.3 PCC(Pyrindium Chlorochromate)氧化 (8)2.1.4 PDC(Pyrindium Dichromate)氧化 (9)2.2 用活性MnO2氧化 (10)2.2.1 用活性MnO2氧化示例一: (10)2.3用DMSO氧化 (11)2.3.1 DMSO-(COCl)2氧化(Swern Oxidation) (11)2.3.2 DMSO-SO3-Pyridine (12)2.4 用氧铵盐氧化 (13)2.4.1 用氧铵盐氧化示例: (13)2.5 用高价碘试剂氧化 (14)2.5 .1 Dess-Martin氧化反应示例: (14)2.5.2 IBX氧化反应示例: (15)2.6 亚硝酸钠和醋酐氧化 (15)2.6.1 亚硝酸钠和醋酐氧化示例 (15)2.6 TPAP-NMO 氧化 (16)2.6.1 TPAP-NMO 氧化示例 (16)2.7 1,2-二醇的氧化 (16)2.7.1 1,2-二醇的氧化示例一: (17)2.7.1 其他1,2-二醇的氧化相关文献: (18)3.由卤化物合成醛酮 (18)3.1 由伯卤甲基和仲卤甲基的氧化合成醛酮 (18)3.1.1 用DMSO氧化(Kornblum反应) (18)3.1.2用硝基化合物氧化(Hass反应) (20)3.1.3用乌洛托品氧化(Sommelet反应) (21)3.1.4用对亚硝基二甲苯胺氧化吡啶翁盐氧化(Kröhnke反应) (22)3.1.5用胺氧化物氧化 (22)3.2 由二卤甲基或二卤亚甲基合成醛酮 (23)3.2.1 由二卤甲基合成醛反应示例: (23)3.3 由有机金属化合物的酰化合成醛酮 (24)3.3.1 由有机金属化合物的酰化合成醛酮示例 (25)3.4 由Pd催化反应合成醛 (25)4.由活泼甲基或活泼亚甲基烷烃合成醛酮 (25)4.1 用SeO2氧化合成醛酮 (26)4.1.1 用SeO2氧化合成醛酮示例 (26)4.2用空气氧化合成酮 (26)4.2.1用空气氧化合成酮反应示例: (27)4.3 用铬酸氧化合成酮 (27)4.3.1 用铬酸氧化合成酮示例 (27)4.4用高锰酸盐氧化合成酮 (29)4.5 用醌氧化合成酮 (29)5.由羧酸及其衍生物合成醛酮 (30)5.1由羧酸合成醛 (30)5.1.1用金属氢化物还原 (30)5.1.2由脱CO2合成醛 (31)5.1.3由羧酸合成酮 (31)5.2由酰氯及酸酐合成醛酮 (33)5.2.1用Rosenmund法合成 (33)5.2.2用金属氢化物还原 (34)5.3由酯及内酯合成醛 (35)5.3.1 酯通过DIBAL还原为醛示例: (36)5.4由酰胺合成醛酮 (36)5.4.1 由酰胺合成醛酮 (37)5.4.2 McFadyen-Stevens Reaction (38)5.5由酯或酰氯经Weinreb酰胺合成醛酮 (39)5.5.1 由Weinreb酰胺还原合成醛反应示例一 (40)5.5.2由Weinreb酰胺还原合成酮反应示例: (41)5.6由氰合成醛酮 (41)5.6.1DIBAL 还原腈到醛示例(最重要的方法) (42)5.6.2Li(EtO)3AlH 还原腈到醛示例(较重要的方法) (43)5.6.3Ranney Ni 加氢还原氰到合成醛示例 (43)5.6.4有机金属试剂对腈加成合成酮示例 (44)6. 由烯烃、芳环合成醛酮 (46)6.1 由烯烃臭氧氧化合成醛 (46)6.2 烯烃用OsO4/NaIO4氧化合成醛 (47)6.3 烯烃经由有机硼化合物中间体的烯烃甲酰化合成醛 (47)6.5 由烯烃的甲酰化合成醛 (48)6.5.1 Vilsmeyer反应 (48)6.5.2 Duff’s 甲酰化 (51)6.5.3 Reimer-Tiemann 甲酰化 (52)6.5.4 Gattermann甲酰化 (53)6.5.5 多聚甲醛/甲醇镁苯酚甲酰化 (53)6.5.6氯化锡/多聚甲醛苯酚甲酰化 (54)6.5.7重氮化后甲酰化 (54)6.6烯烃经加成-氧化反应合成酮 (56)6.6.1 烯烃经加成-氧化反应合成酮示例 (56)7. 由炔烃合成醛酮 (57)7.1 由加成-氧化反应合成醛酮 (57)7.2 由氧化反应合成酮 (57)7.3 由加成-水解反应合成酮 (58)7.4 由加成-还原反应合成酮 (59)7.5 由加成-烷基化,酰化等反应合成酮 (59)8. 由醚及环氧化合物合成醛酮 (59)8.1 Claisen重排 (59)8.2酸催化下环氧化物重排 (61)8.2.1 酸催化下环氧化物重排合成醛酮示例一 (61)8.3氧化法 (61)8.4 水解法缩醛或酮合成醛酮 (61)9. 由胺合成醛 (62)9.1胺的氧化 (62)9.1.1 胺的氧化合成醛反应示例: (63)9.2 由胺经由西佛碱的方法 (64)9.2.1 由胺经由西佛碱合成醛示例 (64)9.3 自苯胺衍生物合成 (64)10. 由硝基化合物合成醛酮 (64)11. 由Friedel-Crafts反应合成芳基酮 (65)11.1 由Friedel-Crafts反应合成芳基酮示例 (68)12. Dieckmann 缩合脱酸 (69)13. 由合成子合成醛酮 (71)14. 由砜合成醛酮 (71)15. Michael 反应和类似反应(Addition, Condensation) (71)1.前言醛和酮是一类重要的有机化合物,其合成在有机合成中占有非常重要的地位。




原创——醛、酮化学反应归纳醛、酮化学反应归纳一、与RMgX加成甲醛产生一级醇,其他的醛生成二级醇。
酮生成三级醇。
羰基两旁的基团太大时,酮不能正常地反应。
会发生烯醇化反应或还原反应:烯醇化反应:还原反应:当格式试剂反应结果不好时,用烷基锂反应可以得到较好的结果。
Cram规则一:大基团L与R呈重叠型,两个较小的基团在羰基两旁呈邻交叉型,与格式试剂(包括氢化铝锂等)反应时,试剂从羰基旁空间位阻较小的基团S一边接近分子,故(i)是主要产物,(ii)为副产物。
R与L处于重叠型为最有利的反应时的构象。
二、与HCN反应(碱性条件下)生成的,—羟基腈可用于制备,—羟基酸,羟基酸可进一步失水变为,,,—不饱和酸(如有机玻璃)。
氢氧根可以增加氰离子的浓度,但碱性不能太强。
该反应符合Cram规则一。
Cram规则二:当醛、酮的,—C上有—OH,—NHR时,由于它们能与羰基氧形成氢键,反应物主要为重叠型构象,发生亲核加成反应时,亲核试剂主要从S基团的一侧进攻。
Strecker(斯瑞克)反应:羰基化合物与氯化铵、氰化钠生成,—氨基腈、再水解制备,—氨基酸的反应三、与炔化物的反应四、与含氮亲核试剂的加成A、与NH或RNH反应(与一级胺生成亚胺,又称西弗碱)(弱酸性条件) 32亚胺在稀酸中水解,可得原羰基化合物与胺:故该反应可用来保护羰基。
B、与RNH反应(生成烯胺) 2要使反应完全,需将水除去。
在稀酸水溶液中烯胺可水解得到羰基化合物与二级胺。
可发生氮烷基化与碳烷基化反应。
C、与氨衍生物的反应a.与羟胺的反应(生成肟)肟与亚硝基化合物发生互变异构。
亚硝基化合物与酮肟的互变异构:亚硝基化合物与醛肟的互变异构:亚硝基化合物在没有,氢时是稳定的,有,氢时有利于平衡肟。
肟的Z构型一般不稳定。
Beckmann(贝克曼)重排反应:酮肟在酸性催化剂中重排生成酰胺的反应催化剂:HSO、多聚磷酸、PCl、PhSOCl(苯磺酰氯)、SOCl (亚硫酰氯)24532 反应特点:离去与迁移基团处于反式;基团的离去与迁移是同步的;迁移基团在迁移前后构型不变。

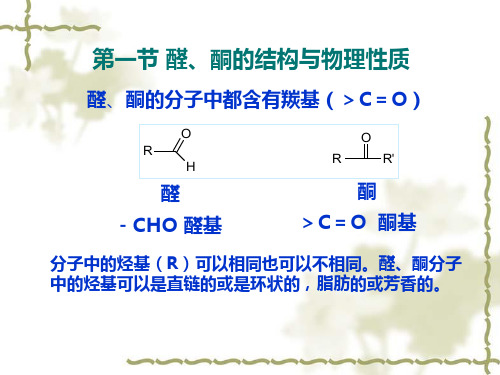
醛和酮亲核加成反应附加答案醛和酮亲核加成反应⼀、基本要求1.掌握醛酮的命名、结构、性质;醛酮的鉴别反应;不饱和醛酮的性质 2.熟悉亲核加成反应历程及其反应活性规律;醛酮的制备⼆、知识要点(⼀)醛酮的分类和命名(⼆)醛酮的结构:醛酮的官能团是羰基,所以要了解醛酮必须先了解羰基的结构。
C=O 双键中氧原⼦的电负性⽐碳原⼦⼤,所以π电⼦云的分布偏向氧原⼦,故羰基是极化的,氧原⼦上带部分负电荷,碳原⼦上带部分正电荷。
(三)醛酮的化学性质醛酮中的羰基由于π键的极化,使得氧原⼦上带部分负电荷,碳原⼦上带部分正电荷。
氧原⼦可以形成⽐较稳定的氧负离⼦,它较带正电荷的碳原⼦要稳定得多,因此反应中⼼是羰基中带正电荷的碳。
所以羰基易与亲核试剂进⾏加成反应(亲核加成反应)。
此外,受羰基的影响,与羰基直接相连的α-碳原⼦上的氢原⼦(α-H )较活泼,能发⽣⼀系列反应。
亲核加成反应和α-H 的反应是醛、酮的两类主要化学性质。
1.羰基上的亲核加成反应醛,酮亲核加成反应的影响因素:羰基碳上正电性的多少有关,羰基碳上所连的烃基结构有关,亲核试剂的亲核性⼤⼩有关。
(1)与含碳的亲核试剂的加成○1氰氢酸:○2 炔化物O 116.5。
杂化键键近平⾯三⾓形结构πσC CO δδ酸和亲电试剂进攻富电⼦的氧碱和亲核试剂进攻缺电⼦的碳涉及醛的反应氧化反应()αH 的反应羟醛缩合反应卤代反应C OHCN 羟基睛○3 有机⾦属化合物:(2)与含氮的亲核试剂的加成○11o 胺○2 2o 胺○3氨的多种衍⽣物:(3)与含硫的亲核试剂的加成-------亚硫酸氢钠产物α-羟基磺酸盐为⽩⾊结晶,不溶于饱和的亚硫酸氢钠溶液中,容易分离出来;与酸或碱共热,⼜可得原来的醛、酮。
故此反应可⽤以提纯醛、酮。
反应围:醛、甲基酮、⼋元环以下的脂环酮。
反应的应⽤:鉴别化合物,分离和提纯醛、酮。
(4)与含氧的亲核试剂的加成○1⽔○2醇醛较易形成缩醛,酮在⼀般条件下形成缩酮较困难,⽤12⼆醇或13-⼆醇则易⽣成缩酮。

醛与酮的反应规律与化学合成醛和酮是有机化合物中常见的官能团。
它们在化学反应中具有独特的特性和反应规律,这为有机合成提供了广泛的应用。
在本文中,我们将讨论醛和酮的反应规律以及它们的化学合成方法。
一、醛与酮的反应规律1. 加成反应:醛和酮可以与亲电试剂进行加成反应,形成新的官能团或化合物。
常见的加成反应有羟醛和酮的羟醛反应、醛和酮的氨基反应、醛和酮的亚胺反应等。
2. 氧化反应:醛可以被氧化剂氧化为羧酸,而酮则稳定,不容易被氧化剂氧化。
常用的氧化剂有高锰酸钾(KMnO4)、过氧化氢(H2O2)等。
3. 还原反应:醛和酮可以被还原剂还原为醇。
常用的还原剂有氢气(H2)、亚磷酸盐(H3PO2)等。
4. 缩合反应:酮可以和醛发生缩合反应,生成β-羟醛。
二、醛与酮的化学合成1. 直接氧化法:一些醛可以通过直接氧化法进行合成。
例如,甲醛可以通过甲烷的催化氧化得到。
2. 羰基化合物的还原:一些醛和酮可以通过还原羰基化合物得到。
例如,醛可以通过还原酮得到。
3. 羧酸的还原:一些羧酸可以通过还原得到醛。
例如,乙酸可以通过还原得到乙醛。
4. 醇的氧化:一些醇可以通过氧化反应得到醛。
例如,乙醇可以通过氧化得到乙醛。
5. 羟醛的羰基还原:一些羟醛可以通过羰基还原反应得到醛。
例如,葡萄糖可以通过羰基还原反应得到葡萄糖醛。
总结起来,醛和酮具有丰富的反应规律和化学合成方法。
通过选择合适的试剂和反应条件,可以实现对醛和酮的控制合成,得到目标化合物。
这为有机合成提供了重要工具和方法。
在工业生产和实验室合成中,醛和酮的合成方法广泛应用于药物合成、有机合成、材料合成等领域。
研究醛和酮的反应规律和化学合成方法,对于新化合物的发现和合成具有重要意义。
结论本文讨论了醛和酮的反应规律以及化学合成方法。
通过加成反应、氧化反应、还原反应和缩合反应,可以实现对醛和酮的控制合成。
选择合适的试剂和反应条件,可以得到目标化合物,为有机合成提供了重要工具和方法。


有机化学方程式汇总醛和酮的酸催化加成反应在有机化学中,醛和酮是两种常见的官能团。
它们参与了许多重要的反应,其中一种是酸催化加成反应。
本文将介绍醛和酮的酸催化加成反应,并对常见的方程式进行汇总。
醛和酮的酸催化加成反应是一种通过酸催化来使醛和酮与其他化学物质发生加成反应的方法。
这种反应通常在强酸的催化下进行,可以使用多种强酸,包括硫酸、氢氯酸和甲酸等。
下面是几个常见的酸催化加成反应方程式:1. 醇的加成反应:醛或酮可以与醇反应,生成缩醛或缩酮。
方程式如下:RCHO + ROH → RCH(OR)OH2. 胺的加成反应:醛或酮可以与胺反应,生成胺加成产物。
方程式如下:RCHO + NH3 → RCH=NH23. 腈的加成反应:醛或酮可以与腈反应,生成氯腈或酮腈。
方程式如下:RCHO + HCN → RCH(CN)OH4. 胺的缩合反应:醛或酮可以与胺反应,生成胺缩合产物。
方程式如下:RCHO + NH2-R' → RCH=NR'5. 第二次加成反应:醛或酮可以先与一种化合物反应生成中间产物,再与另一种化合物进行第二次加成反应。
方程式如下:RCHO + X → R CH(X)OHRCH(X)OH + Y → RCH(X)Y以上只是醛和酮的酸催化加成反应中的一部分方程式,还有许多其他反应也可以通过酸催化实现。
在实际应用中,根据具体的实验条件和需求,可以选择不同的酸催化剂和反应条件。
需要注意的是,酸催化加成反应通常需要在适当的溶剂中进行,常用的溶剂包括二甲基亚砜(DMSO)、氯仿和醇等。
此外,反应温度和反应时间也是影响反应结果的重要因素,需要根据实验要求进行优化。
总结起来,醛和酮的酸催化加成反应是有机化学中常见的反应类型之一。
通过酸催化,醛和酮可以与其他化合物进行加成反应,生成各种有机产物。
在实际应用中,需要根据具体要求选择合适的酸催化剂、反应条件和溶剂,以获得理想的反应产物。
参考文献:1. Clayden J, Greeves N, Warren S. Organic chemistry. 2nd ed. Oxford: Oxford University Press; 2012.2. Mohrig JR, Hammond CN, Schatz PF. Techniques in organic chemistry. 4th ed. New York: W.H. Freeman and Company; 2017.。

醛和酮的生物合成与代谢在生物体内,醛和酮是一类重要的有机化合物,它们广泛存在于生物代谢过程中,并参与了许多生物功能的调控。
本文将就醛和酮的生物合成与代谢进行探讨,希望能够对读者加深对这一领域的理解。
一、醛的生物合成与代谢1. 醛的生物合成醛的生物合成通常通过氧化作用实现。
在细胞内,醛的生物合成过程一般是由脂肪酸代谢、酶促反应以及某些细胞器的参与完成的。
其中,醛合成酶是参与醛生物合成的关键酶,它能够将脂肪酸在线程式C端上氧化成为醛。
2. 醛的代谢途径醛在生物体内主要通过三个代谢途径进行消除:醛脱氢酶(ALDH)系统、醛氧化酶(ADH)系统和酮醇酸途径。
其中,ALDH系统是醛消除的主要途径,它通过酶催化将有毒的醛转化为相对稳定的羧酸。
ADH系统则是将醛氧化为相应的酮。
至于酮醇酸途径,主要是利用酮醇酸脱羧酶将α-酮醇酸转化为醛酸。
二、酮的生物合成与代谢1. 酮的生物合成酮的生物合成是通过酮脱氢酶催化反应实现的。
当生物体内的脂肪酸供应过剩时,脂肪酸代谢途径将会产生大量的乙酰辅酶A(Acetyl-CoA),并经过酮合成途径被转化为酮体。
2. 酮的代谢途径酮的代谢主要通过三个途径进行,即酮基酸途径、α-酮酸途径和酮-糖转化途径。
在酮基酸途径中,乙酰辅酶A将会与胺基酸生成酮基酸;α-酮酸途径中,乙酰辅酶A转化为内源性酮体具体化合物;酮-糖转化途径中,酮体将被转化为葡萄糖,供能物质。
三、醛和酮的生物功能1. 醛的生物功能醛在生物体内具有多种重要生物功能。
首先,醛可作为信号分子参与细胞内的信号传导,如通过醛调控细胞的增殖和凋亡;其次,醛具有抗氧化功能,能够清除自由基,起到抗氧化作用;最后,醛还参与了脂肪酸代谢、糖代谢和蛋白质合成等生物过程。
2. 酮的生物功能酮在人体内具有多种生物功能。
首先,酮能够作为能量分子供给细胞代谢的需要,一般在体内葡萄糖供应不足时启动;其次,酮还具有抗炎和抗肿瘤作用,能够减少炎症反应和抑制肿瘤细胞生长;最后,酮还被用作药物治疗癫痫等疾病,是一种重要的治疗手段。

醛和酮的实验报告醛和酮的实验报告引言:醛和酮是有机化学中常见的官能团,它们在生物学、医学、化工等领域中都有着广泛的应用。
为了更好地理解和研究醛和酮的性质和反应特点,本实验通过一系列的实验操作和观察,对醛和酮进行了深入的研究。
实验一:醛的制备与性质研究在这个实验中,我们首先选择了乙醛作为研究对象。
通过将乙醇与酸性高锰酸钾溶液反应,我们成功地制备了乙醛。
实验过程中,我们观察到了高锰酸钾溶液逐渐变浅,同时产生了一种刺激性气味的物质。
这表明乙醇在酸性条件下被氧化成了乙醛。
接下来,我们对乙醛进行了一系列的性质研究。
首先,我们进行了醛的还原反应。
将乙醛与氢气在催化剂的存在下反应,我们观察到了乙醇的生成。
这表明乙醛具有还原性质,可以被还原成醇。
然后,我们对乙醛进行了醛的氧化反应。
将乙醛与氧气在催化剂的存在下反应,我们观察到了乙酸的生成。
这表明乙醛具有氧化性质,可以被氧化成酸。
实验二:酮的制备与性质研究在这个实验中,我们选择了丙酮作为研究对象。
通过将丙醇与酸性高锰酸钾溶液反应,我们成功地制备了丙酮。
实验过程中,我们观察到了高锰酸钾溶液逐渐变浅,同时产生了一种具有刺激性气味的物质。
这表明丙醇在酸性条件下被氧化成了丙酮。
接下来,我们对丙酮进行了一系列的性质研究。
首先,我们进行了酮的还原反应。
将丙酮与氢气在催化剂的存在下反应,我们观察到了丙醇的生成。
这表明丙酮具有还原性质,可以被还原成醇。
然后,我们对丙酮进行了酮的氧化反应。
将丙酮与氧气在催化剂的存在下反应,我们观察到了丙酸的生成。
这表明丙酮具有氧化性质,可以被氧化成酸。
实验三:醛和酮的加成反应在这个实验中,我们研究了醛和酮的加成反应。
我们选择了乙醛和丙酮作为研究对象。
首先,我们将乙醛与氰化钠反应,观察到了产物乙醇腈的生成。
这表明醛可以与氰化物加成生成腈。
接着,我们将丙酮与丙胺反应,观察到了产物N,N-二丙基乙酰胺的生成。
这表明酮可以与胺加成生成酰胺。
实验四:醛和酮的亲核加成反应在这个实验中,我们研究了醛和酮的亲核加成反应。


醛与酮的合成与反应醛和酮是有机化合物中常见的一类功能团,它们在化学反应和有机合成中具有重要作用。
本文将介绍醛和酮的合成和反应,包括常见的合成方法和典型的反应类型。
一、醛和酮的合成方法1. 氧化还原反应合成醛氧化还原反应是常用的合成醛的方法之一。
例如,通过加热醛或醇与强氧化剂如酸性高锰酸钾(KMnO4)、氢氧化钾(KOH)等反应,可将醛及醇氧化为醛,生成相应的酮。
2. 羧酸的还原合成醛羧酸的还原是另一种制备醛的方法。
一般使用还原剂如亚磷酸酯(如三氯化铝)、氯化铝等来催化羧酸的还原,生成相应的醛。
3. 烷基化合成醛烷基化反应是一种常见的合成醛的方法。
通过将卤代烷和金属盐如亚铁盐(如亚铁(II)氯化铵)反应,在适当的条件下,可生成相应的醛。
4. 卡宴转化合成酮卡宴转化(Wolff-Kishner反应)是制备酮的经典方法之一。
该反应以卡宴(Hydrazine)为还原剂,将醛还原得到相应的酮。
二、醛和酮的典型反应类型1. 氧化反应醛和酮都是易于氧化的官能团,容易被氧化剂氧化,生成酮和酸。
例如,醛在氧气或过氧化氢(H2O2)的存在下,可发生氧化反应,生成相应的酸。
2. 加成反应醛和酮常参与加成反应,与亲电试剂如胺类、羰基化合物、硫酸盐等反应,生成相应的加合物。
3. 缩合反应酮与酮发生缩合反应后,产生烯酮类化合物。
醛和酮通过催化剂如氢氰酸钠(NaCN)等催化,也可发生缩合反应,生成相应的糖类化合物。
4. 氧化邻位反应邻位氧化反应是醛和酮经典的反应类型之一。
将醛或酮与碱性过氧化物如过氧化乙酰、过氧化苯甲酮等反应,可发生邻位氧化反应,生成相应的酮或醛。
总结:通过氧化还原反应、羧酸的还原、烷基化合成和卡宴转化等方法,可以有效地合成醛和酮。
而醛和酮在化学反应中则常见于氧化、加成、缩合和氧化邻位等各种典型反应中。
熟悉醛和酮的合成方法和反应特点,对于有机合成和发展新颖化合物具有重要意义。

大学有机化学反应方程式总结醛和酮的加成反应醛和酮是有机化合物中常见的官能团,其加成反应在有机合成中具有重要的地位。
本文将对醛和酮的加成反应进行总结,包括反应方程式和反应机理的介绍,以便于读者更好地理解和掌握这些反应。
一、醛的加成反应1. 醛的加成反应概述醛分子中的羰基碳上带有一个氧原子和一个氢原子,因此醛具有较强的亲电性。
醛的加成反应是指醛分子中的羰基碳与亲核试剂发生反应,生成加成产物。
常见的醛的加成反应有醛的加成氢化反应、醛的加成生成醇反应等。
2. 醛的加成氢化反应醛的加成氢化反应是一种重要的醛的还原反应,常用还原剂有氢气(H2)、铝酸铵(NH4AlH4)等。
具体反应方程式如下:醛+ H2 → 醇例如,乙醛(CH3CHO)与氢气反应生成乙醇(CH3CH2OH)。
3. 醛的加成生成醇反应醛的加成生成醇反应是醛与亲核试剂(如水、醇等)反应生成醇的反应。
具体反应方程式如下:醛+ H2O → 醇例如,甲醛(HCHO)与水反应生成甲醇(CH3OH)。
二、酮的加成反应1. 酮的加成反应概述酮分子中的羰基碳上带有两个碳原子,因此酮的亲电性较弱。
酮的加成反应是指酮分子中的羰基碳与亲核试剂发生反应,生成加成产物。
常见的酮的加成反应有酮的加成生成醇反应、酮的加成生成伯胺反应等。
2. 酮的加成生成醇反应酮的加成生成醇反应是酮与亲核试剂(如水、醇等)反应生成醇的反应。
具体反应方程式如下:酮+ H2O → 醇例如,丙酮(CH3COCH3)与水反应生成丙醇(CH3CH2OH)。
3. 酮的加成生成伯胺反应酮的加成生成伯胺反应是酮与含有活化氢的亲核试剂(如胺)反应生成伯胺的反应。
具体反应方程式如下:酮 + R-NH2 → 伯胺其中,R为有机基团。
例如,丙酮与甲胺反应生成丙基胺。
总结:醛和酮作为有机化合物中重要的官能团,在有机合成中经常参与加成反应。
醛的加成反应包括醛的加成氢化反应和醛的加成生成醇反应;酮的加成反应包括酮的加成生成醇反应和酮的加成生成伯胺反应。


化学反应中的醛酮反应醛酮反应是一类重要的有机化学反应,指的是醛与酮之间进行氧化还原反应,生成相应的醇和酸酐的过程。
该反应在有机合成、医药化学等领域具有广泛的应用。
本文将介绍醛酮反应的机理、分类以及其在实际应用中的一些例子。
一、醛酮反应的机理醛酮反应通常是通过氧化还原的方式进行,其中醛或酮被氧化为酸酐或醇。
该反应是在酸性或碱性条件下进行的。
在酸性条件下,醛酮反应首先发生质子化,形成醇醛离子或酮离子。
接着,醇醛离子或酮离子会接受电子,生成相应的酸酐或醇产物。
在碱性条件下,醛酮反应开始于亲核试剂的加成。
亲核试剂攻击醛或酮中的部分正电荷,形成一个中间体。
然后,中间体经历质子化或负离子迁移等步骤,最终生成酸酐或醇产物。
二、醛酮反应的分类根据反应条件和产物类型的不同,醛酮反应可以分为多种类型,如氧化、还原、氧气插入和杂原子插入等。
下面将介绍其中的几种典型反应。
1. 氧化反应氧化反应是指醛或酮被氧化为酸酐的反应。
常见的氧化剂有氧气、过氧化氢、高锰酸钾等。
例如,乙醛可以通过氧气氧化为乙酸的反应:CH3CHO + O2 -> CH3COOH2. 还原反应还原反应是指醛或酮被还原为醇的反应。
典型的还原剂有金属钠、锂铝烷等。
例如,丙酮可以通过锂铝烷还原为异丙醇的反应:(CH3)2CO + LiAlH4 -> (CH3)2CHOH3. 氧气插入反应氧气插入反应是指氧气直接参与醛酮反应,生成酸酐的反应。
例如,甲醛可以通过氧气插入反应生成甲酸的反应:CH3CHO + 1/2 O2 -> CH3COOH4. 杂原子插入反应杂原子插入反应是指醛酮反应中,醛或酮分子中的氧原子被其他原子或基团所取代的反应。
例如,乙醛可以经过羟胺的插入反应生成乙酰肼:CH3CHO + H2NNH2 -> CH3C(NHNH2)O三、醛酮反应的应用举例醛酮反应在有机合成和医药化学中具有广泛的应用。
下面介绍两个具有代表性的例子。

醛,酮与格氏试剂的反应醛、酮与格氏试剂的反应是有机化学中的一种重要反应,它是通过格氏试剂对醛、酮进行加成反应,得到相应的醇的过程。
这种反应在有机合成中具有广泛的应用,尤其是在制药、化妆品、农药等领域中得到了广泛的应用。
本文将详细介绍醛、酮与格氏试剂的反应机理、反应条件、反应特点以及应用。
一、反应机理格氏试剂是由三苯基膦和亚锡酸盐或锡粉在乙醇或乙醚中反应得到的。
它的结构式为:R3P=CHR’,其中R为苯基,R’为甲基、乙基或苯基等基团。
醛、酮与格氏试剂的反应机理可以分为两步:第一步:格氏试剂与醛、酮发生加成反应,生成中间体。
如下所示:R3P=CHR’ + RCHO → R3P-CH(OH)R’R3P=CHR’ + R2CO → R3P-CH(OH)R’R’’第二步:中间体发生消除反应,生成相应的醇。
如下所示:R3P-CH(OH)R’→ R3P + R’CH2OHR3P-CH(OH)R’R’’→ R3P + R’CH(OH)R’’ + R’’CH2OH二、反应条件醛、酮与格氏试剂的反应需要在一定的条件下进行,主要包括反应温度、反应时间、反应物比例等。
具体条件如下:反应温度:反应温度通常在室温下进行,也可以在-78℃下进行。
反应时间:反应时间一般为数小时到数天不等,根据反应物的不同而定。
反应物比例:醛、酮和格氏试剂的摩尔比应该为1:1:1。
反应溶剂:反应溶剂通常为乙醇或乙醚。
三、反应特点醛、酮与格氏试剂的反应具有以下特点:1、反应产物为醇,得率较高。
2、反应条件温和,适用范围广。
3、反应物容易制备,易于操作。
4、反应具有良好的选择性,可以得到相应的单一产物。
四、应用醛、酮与格氏试剂的反应在有机合成中具有广泛的应用,尤其是在制药、化妆品、农药等领域中得到了广泛的应用。
以下是几个应用案例:1、制药领域:醛、酮与格氏试剂的反应可以制备出一些重要的药物原料,如对羟基苯甲酸酯、对羟基苯丙酸酯等。
2、化妆品领域:醛、酮与格氏试剂的反应可以制备出一些重要的香料和精油成分,如香叶醇、香茅醇等。
醛,酮的反应与制备
醛,酮的反应与制备
它可分为三类:与亲核试剂的加成反应;α-H反应;氧化还原反应
1.与亲核试剂的加成反应(1)与含碳亲核试剂的加成
① 它与有机金属(格氏试剂、烷基锂)反应,然后水解得到各种醇
②与氢氰酸反应在碱性条件下与醛,酮生成α-羟基腈③与炔化物加成继而水解生成
炔醇
④ Wittig使醛、酮和磷的内部盐反应生成烯烃(2)与含氧亲核试剂加成① 与水反
应
②与醇反应,得到的产物称为半缩醛,半缩酮,酸性条件下,与醇继续反应生成缩醛,缩酮。
(3)与含氮亲核试剂的加成①与羟胺反应生成肟
② 与肼或氨基脲反应,产物分别为腙和氨基脲
③与伯胺反应生成亚胺;与仲胺反应生成烯胺;与叔胺不反应④与未取代的氨反应产
物复杂
rrco+h2n-yrrcn-y+h2oh2n-y=h2n-oh,h2n-r,h2n-nhconh2,h2n-nhc6h3(no2)2-
2,4
(4)与含硫亲核试剂的加成反应①与亚硫酸氢钠反应②与硫醇反应2.α-h的反应
(1) H的α-酸度:羰基和烯醇形式的互变异构
(2)α-h的卤代:与卤素自动生成α-卤代产物,副产物卤化氢起催化作用
(3)羟醛缩合:在碱存在下,通过分子间缩合反应β-羟醛缩合反应生成醛。
在类
似的条件下,酮也可以缩合。
(4)曼尼希反应:在酸性条件下,带有活性氢的醛和酮可
以与甲醛和胺一起形成β-氨基醛、酮。
3.氧化还原反应
(1)氧化反应:醛被过酸氧化得到羧酸,酮被过酸氧化得到酯,这种反应叫做拜耳-
维利格反应。
(2)还原反应:在过渡金属催化下加氢,或用硼氢化钠、铝锂氢化物等还原剂还原
成醇。
酮也可在乙醇钠中用金属钠还原成仲醇,而在弱酸环境下,可以用铁粉或锌粉还原
醛类。
用金属钠或镁汞齐在非质子溶剂中还原酮,得到双分子还原产物邻二醇。
在盐酸中,锌汞齐可以将醛和酮的羰基还原为亚甲基,这被称为克莱门斯还原法。
在高温、高压和碱
的存在下,以肼为还原剂,醛和酮的羰基也能还原成亚甲基,称为沃尔夫-卡西纳还原法。
(3) Connie Charlotte反应:Noα-在碱性条件下,H的一个醛分子被氧取代
化成酸,一分子辈还原成醇。
若有甲醛,则甲醛优先被氧化。
(4)安息香缩合反应:两分子苯甲醛在cn-存在下缩合生成安息香。
其他没有α-h的醛也缩合
(5)默克-默里还原偶联反应:在氯化钛(TiCl3或TiCl4)存在下,用锌铜偶联剂
还原醛和酮,得到双分子偶联烯烃。
这个反应叫做j.e.麦克默里还原偶联反应。
通常,会得到顺式和反式异构体的混合物。
多官能团的醛,酮
1.1,2-二酮(α-二酮)
(1)被高碘酸氧化而发生两个羰基之间共价键的断裂,生成两分子羧酸
(2) 2.1,3-二酮在碱性条件下发生二苯羟基乙酸重排(β-二酮)
在碱存在下可以完全转化为烯醇盐,这种烯醇盐能和卤代烃或酰氯作用转化成亚甲基
上的烷基化和酰化产物。
3.α,β-不饱和醛,酮
(1) HCN添加:始终为1,4-添加。
HCN被添加到双键中。
通常情况下,不添加双键。
(2)迈克尔(michael)加成反应:
(3)与有机金属的反应:有机锂,仅1,2加成;有机铜锂,1,4加成;有几种镁,1,2加成和1,3加成。