高中化学物质的氧化性及还原性
- 格式:docx
- 大小:14.34 KB
- 文档页数:4
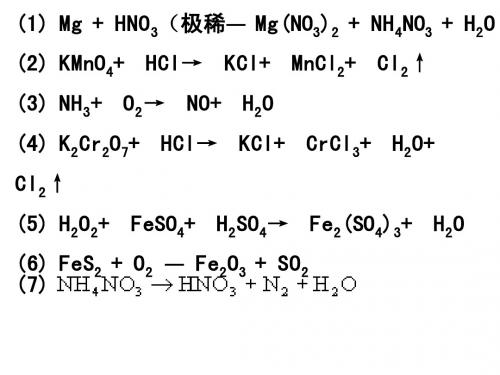

第33讲物质的氧化性与还原性强弱的比较[基础篇]1、基本知识:氧化性→得电子性,得到电子越容易→氧化性越强还原性→失电子性,失去电子越容易→还原性越强由此,金属原子因其最外层电子数较少,通常都容易失去电子,表现出还原性,所以,一般来说,金属性也就是还原性;非金属原子因其最外层电子数较多,通常都容易得到电子,表现出氧化性,所以,一般来说,非金属性也就是氧化性。
2、比较方法:(1)根据金属活动性顺序来判断:一般来说,越活泼的金属,失电子氧化成金属阳离子越容易,其阳离子得电子还原成金属单质越难,氧化性越弱;反之,越不活泼的金属,失电子氧化成金属阳离子越难,其阳离子得电子还原成金属单质越容易,氧化性越强。
(2)根据非金属活动性顺序来判断:一般来说,越活泼的非金属,得到电子还原成非金属阴离子越容易,其阴离子失电子氧化成单质越难,还原性越弱。
K、Ca、Na、Mg、Al、Zn、Fe、Sn、Pb,(H)、Cu、Hg、Pt、Au金属的活动性逐渐减弱(还原性逐渐减弱)K+、Ca2+、Na+、Mg2+、Al3+、Zn3+、Fe2+、Sn2+、Pb,(H+)、Cu2+、Hg2+、Ag+氧化性逐渐增强(3)根据氧化还原反应发生的规律来判断:氧化还原反应可用如下式子表示:规律:反应物中氧化剂的氧化性强于生成物中氧化产物的氧化性,反应物中还原剂的还原性强于生成物中还原产物的还原性。
(4)根据氧化还原反应发生的条件来判断:如:MnO 2+4HCl (浓)−→−∆ MnCl 2+C12↑+2H 2O 2KMnO 4+16HCl (浓)→2MnCl 2+5C12↑+8H 2O+2KCl后者比前者容易(不需要加热),可判断氧化性 KMnO 4>MnO 2 (5)根据反应速率的大小来判断:如:2Na 2SO 3+O 2→2Na 2SO 4(快), 2H 2SO 3+O 2→2H 2SO 4(慢),其还原性: Na 2SO 4>H 2SO 3>SO 2 (6)根据被氧化或被还原的程度来判断:如:Cu +Cl 2−−→−点燃CuCl 2 ,2Cu +S −→−∆Cu 2S 即氧化性:。

化学物质的氧化性与还原性在化学领域中,氧化性和还原性是两个重要的概念。
它们描述了化学物质在化学反应中失去或获得电子的能力,是化学反应中电子转移的核心概念。
本文将会介绍氧化性和还原性的定义、影响因素以及相关实例。
一、氧化性的定义和表现氧化性指的是一种物质生成氧化物或能够使其他物质失去电子的能力。
在氧化反应中,氧化剂能够从另一种物质中获得电子,自身则被还原。
氧化性的强弱可以通过其标准电位来衡量,标准电位愈高,氧化性愈强。
不同物质的氧化性差异很大。
例如,氧(O2)具有很强的氧化性,它能够促使其他物质燃烧;而金属铁(Fe)在氧气中容易生锈,表现出较强的氧化性。
二、还原性的定义和表现还原性指的是一种物质失去氧化剂的电子或自身获得电子的能力。
在还原反应中,还原剂能够向另一种物质提供电子,自身则被氧化。
与氧化性相似,还原性的强弱可以通过其标准电位来衡量,标准电位愈低,还原性愈强。
还原性也存在很大的差异。
例如,氢气(H2)是一种常见的还原剂,可以在许多还原反应中起到关键作用。
而金属铜(Cu)也具有较强的还原性,可以将银离子(Ag+)还原成银(Ag)。
三、影响氧化性和还原性的因素1. 电负性:在一些共价化合物中,原子的电负性差异决定了氧化性和还原性。
电负性较低的原子在化学反应中更容易失去电子,表现出较强的氧化性;相反,电负性较高的原子更倾向于获得电子,表现出较强的还原性。
2. 溶液中的氧化性:溶液中的氧化剂和还原剂也会影响物质的氧化性和还原性。
例如,溶液中的酸性条件常常增强氧化剂的氧化性,碱性条件则常常增强还原剂的还原性。
3. 反应条件:温度、压力和光照等反应条件也会影响氧化性和还原性。
一些反应需要高温或光照才能发生,而在低温或黑暗环境下可能完全没有反应。
四、实例分析1. 锌与硫酸反应:Zn + H2SO4 -> ZnSO4 + H2在这个反应中,锌(Zn)失去了两个电子,被硫酸(H2SO4)氧化成锌离子(Zn2+),硫酸则被还原成硫酸氢根离子(HSO4-)。

高一化学氧化性还原性知识点化学中的氧化性和还原性是指物质在化学反应过程中会损失电子的能力和能够得到电子的能力。
氧化性与损失电子的能力有关,而还原性与得到电子的能力有关。
深刻理解和掌握氧化性和还原性的知识,对于解决化学反应过程中的问题起到至关重要的作用。
本文将介绍高一化学氧化性和还原性的基本概念、性质和相关的例子。
一、氧化性的概念和性质氧化性是指物质在化学反应中能够损失电子从而被氧化剂(一种能够接受电子的物质)氧化的能力。
具有较强氧化能力的物质通常会损失电子,并形成正离子或中性分子。
1. 氧化剂的特点:氧化剂可以接受电子,同时自身被还原。
通常,氧化剂具有较高的电子亲和力或氧化态较高的元素。
2. 氧化反应:在氧化反应中,氧化剂从被氧化的物质中接受电子,引起被氧化物质的电荷状态增加。
典型的氧化反应如下:2Mg + O2 → 2MgO在上面的反应中,氧化剂是氧气,它接受了镁的电子,并将镁氧化为镁氧化物(MgO)。
3. 氧化性高低的判定:氧化性的高低可以通过判定物质的电子亲和力、电离能等参数来确定。
一般来说,金属元素具有较低的电子亲和力和较低的氧化态,因此它们的氧化性较弱。
二、还原性的概念和性质还原性是指物质在化学反应中能够得到电子从而被还原剂(一种能够提供电子的物质)还原的能力。
具有较强还原能力的物质通常会得到电子,并形成负离子或中性分子。
1. 还原剂的特点:还原剂可以提供电子,同时自身被氧化。
通常,还原剂具有较强的亲电子能力或较低的氧化态元素。
2. 还原反应:在还原反应中,还原剂将电子提供给其他物质,引起被还原物质的电荷状态减少。
典型的还原反应如下:Cl2 + 2e- → 2Cl -在上述反应中,氯原子(Cl2)通过接受电子而被还原为氯离子(Cl-)。
3. 还原性高低的判定:还原性的高低可以通过判定物质的电子亲和力和氧化态等参数来确定。
一般来说,非金属元素具有较高的电子亲和力和较高的氧化态,因此它们的还原性较强。

第20课时 物质的氧化性、还原性强弱比较及规律和应用知识归纳:一、氧化性、还原性强弱的认识1.氧化性是指物质 的性质(或能力);还原性是指物质 的性质(或能力)。
2.氧化性、还原性的强弱取决于物质得、失电子的 程度,与得、失电子数目的 无关。
例如:Na -e -===Na +,Al -3e -===Al 3+,但根据金属活动性顺序表,Na 比Al 活泼,更易失去电子,所以Na 比Al 的还原性强。
二、氧化性、还原性强弱的比较方法方法一 依据反应原理(还原性强) (氧化性强) (氧化性较弱) (还原性较弱)氧化性:氧化剂>氧化产物。
还原性:还原剂>还原产物。
可总结为:比什么性,找什么剂(物),产物之性小于剂。
方法二 依据金属活动性顺序方法三 依据元素周期表方法四 依据电化学原理(1)原电池:一般情况下,两种不同的金属构成原电池的两极,其还原性:负极>正极。
(2)电解池:用惰性电极电解混合溶液时,在阴极先放电的阳离子的氧化性较强,在阳极先放电的阴离子的还原性较强。
方法五 依据反应条件及反应的剧烈程度反应条件要求越低,反应越剧烈,对应物质的氧化性或还原性越强,如是否加热、反应温度高低、有无催化剂和反应物浓度大小等。
例如:根据2Na +2H 2O===2NaOH +H 2↑,Mg +2H 2O=====△Mg(OH)2+H 2↑,可以推知还原性Na>Mg 。
方法六 依据氧化还原反应的程度(1)相同条件下,不同氧化剂作用于同一种还原剂,氧化产物价态高的其氧化性强。
如(2)相同条件下,不同还原剂作用于同一种氧化剂,还原产物价态低的其还原性强。
如物质的氧化性还原性还与以下因素有关:(1)浓度:同一种物质浓度越大,氧化性(或还原性)越强,如氧化性:浓H2SO4>稀H2SO4,浓HNO3>稀HNO3,还原性:浓HCl>稀HCl。
(2)温度:同一种物质,温度越高其氧化性越强,如热的浓硫酸的氧化性比冷的浓硫酸的氧化性强。

物质氧化性、还原性强弱比较规律总结方法归纳:物质氧化性、还原性强弱的比较,实质上是物质得失电子难易程度的比较。
即物质越易得到电子,则其氧化性越强,越难得到电子则其氧化性越弱;反之,物质越易失去电子,则其还原性越强,越难失去电子,则其还原性越弱。
★越易失电子的物质,失后就越难得电子;越易得电子的物质,得后就越难失去电子。
一. 利用化合价,比较物质氧化性、还原性的强弱由同种元素形成的不同价态物质的氧化性和还原性的强弱规律:元素的最高价态只具有氧化性(如:Fe 3+、KMnO 4等),元素的最低价态只具有还原性(如S 2-、I -等),元素的中间价态既具有氧化性又具有还原性,但主要呈现一种性质(如SO 2一还原性为主)。
如:由铁元素组成的物质,氧化性:Fe Fe Fe <<++23;还原性:Fe Fe Fe >>++23。
二、依据元素周期表1.同周期,如:Na 、Mg 、Al 、Si 、P 、Cl 从左到右,还原性逐渐减弱,氧化性逐渐增强。
2.同主族,从上到下,还原性逐渐增强(如:Li 、Na 、K 、Rb 、Cs ),氧化性逐渐减弱(如:F 、Cl 、Br 、I 、At)。
三、利用元素活泼性的不同,比较物质氧化性、还原性的强弱1. 对金属而言,金属越活泼(金属性越强),其单质的还原性越强,其金属阳离子的氧化性越弱。
如:对金属活动性顺序表而言:K 、Ca 、Na 、Mg 、Al 、Zn 、Fe 、Sn 、Pb (H )、Cu 、Hg 、Ag 、Pt 、Au ,其活泼性(金属性)依次减弱;单质的还原性 K>Ca>Na>Mg>Al>Zn>Fe>Sn>Pb>(H 2)>Cu> Hg>Ag>Pt>Au ;离子的氧化性:K +<Ca 2+<Na +<Mg 2+<Al 3+<Zn 2+<Fe 2+<Sn 2+<Pb 2+<(H +)<Cu 2+< Hg 2+<Ag +<Pt 2+<Au +2.对非金属而言,非金属越活泼(非金属性越强),其非金属单质的氧化性越强,其阴离子的还原性越弱。
高中化学各种离子,分子和元素的氧化性还原性排序氧化还原反应是一种基本的化学反应,有时也被称为氧化还原过程。
在一个氧化还原反应中,氧化剂的相对全电荷(当前的)减少,而还原剂的相对全电荷(当前的)增加。
虽然确切的定义可能会根据具体的环境而有所不同,但一般来说,氧化剂可以被定义为减少另一个物质中电子的物质,而还原剂则被定义为增加另一物质中电子的物质。
在高中化学中,我们主要研究的是氧化还原反应的参与者,即离子、分子和元素,以及它们的氧化性和还原性。
离子是拥有正电荷或负电荷的原子核外的电子组成的分子,而分子则是一个或多个离子的组合物。
元素是由原子组成的物质,是原子核和电子的最小物质单位。
离子的氧化性还原性可以根据它们的电荷来确定。
一般来说,带正电荷的离子具有较强的氧化性,而带负电荷的离子具有较强的还原性。
例如,氯离子(Cl-)具有较强的还原性,因为它具有一个负电荷,可以吸收其它正电荷的物质的电子。
相反,氢离子(H+)具有较强的氧化性,因为它具有一个正电荷,可以传递自己的电子给其它物质。
分子的氧化性还原性取决于它们所含有的离子,以及离子之间的电荷分布。
例如,具有三个正电荷和一个负电荷的氯气分子(Cl2)具有较强的氧化性,因为它有三个正电荷,可以传递给其它物质三个电子;而具有四个正电荷和两个负电荷的氯化钠分子(NaCl)则具有较强的还原性,因为它有两个负电荷,可以吸收外部物质的电子。
元素的氧化性还原性则取决于它们的电子配置,也就是元素的原子排列情况。
例如,氢元素(H)具有高度的氧化性,因为它只有一个外层电子,可以传递出去;而氮元素(N)具有较低的氧化性,因为它有四个外层电子,而且不易传递出去。
由上可知,高中化学的各种离子、分子和元素的氧化性还原性取决于它们的电荷、离子之间的电荷分布或电子配置。
因此,我们可以根据它们的电荷、离子之间的电荷分布或电子配置,来对高中化学的各种离子、分子和元素的氧化性还原性进行排序。
元素的氧化还原性质及常见氧化还原反应氧化还原反应是化学反应中常见的一类,它包含了许多元素在反应中电子的转移过程。
本文将探讨元素的氧化还原性质以及一些常见的氧化还原反应,以帮助读者更好地理解和应用这一概念。
一、氧化还原性质1. 氧化性:元素或化合物失去电子,形成正离子的倾向称为氧化性。
具有较强氧化性的物质能够从其他物质中接受电子,使其发生氧化反应。
2. 还原性:元素或化合物获得电子,形成负离子的倾向称为还原性。
具有较强还原性的物质能够将电子提供给其他物质,使其发生还原反应。
3. 氧化态:元素在化合物中的电荷状态称为氧化态。
氧化态的变化反映了元素在反应中电子的转移过程,常用罗马数字表示。
二、常见氧化还原反应1. 金属与非金属的反应金属通常具有较强的还原性,而非金属则具有较强的氧化性。
当金属与非金属发生反应时,金属会失去电子变为正离子,而非金属则接受电子变为负离子。
例如,钠与氯反应生成氯化钠的反应方程式为:2Na + Cl2 → 2NaCl在这个反应中,钠被氧化成为钠离子Na+,而氯原子被还原成为氯离子Cl-。
2. 同一元素的反应某些元素在不同化合物中具有不同的氧化态,它们之间的转化常常伴随着氧化还原反应。
这种反应称为同一元素的氧化还原反应。
例如,二氧化锰可以发生如下反应:3MnO2 + 4Al → 3Mn + 2Al2O3在这个反应中,二氧化锰中的锰原子从氧化态+4还原为0态,而铝则从0态被氧化为+3态。
3. 化合物的分解反应某些化合物在受热或电解等条件下能够分解成原子或离子,这种反应也是氧化还原反应。
例如,过氧化氢可以发生如下分解反应:2H2O2 → 2H2O + O2在这个反应中,过氧化氢分子被分解成水和氧气,其中氧元素的氧化态从-1还原到0。
4. 氧化剂和还原剂的反应氧化剂具有较强的氧化性,能够氧化其他物质;还原剂具有较强的还原性,能够还原其他物质。
氧化剂与还原剂的反应也是氧化还原反应。
例如,二氧化铜和一氧化碳可以发生如下反应:CuO + CO → Cu + CO2在这个反应中,二氧化铜是氧化剂,氧化一氧化碳为二氧化碳,同时自身被还原为金属铜。
高中化学总结氧化性还原性强弱的判断(1)根据元素的化合价物质中元素具有最高价,该元素只有氧化性;物质中元素具有最低价,该元素只有还原性;物质中元素具有中间价,该元素既有氧化性又有还原性。
对于同一种元素,价态越高,其氧化性就越强;价态越低,其还原性就越强。
(2)根据氧化还原反应方程式在同一氧化还原反应中,氧化性:氧化剂>氧化产物还原性:还原剂>还原产物氧化剂的氧化性越强,则其对应的还原产物的还原性就越弱;还原剂的还原性越强,则其对应的氧化产物的氧化性就越弱。
(3)根据反应的难易程度注意:①氧化还原性的强弱只与该原子得失电子的难易程度有关,而与得失电子数目的多少无关。
得电子能力越强,其氧化性就越强;失电子能力越强,其还原性就越强。
②同一元素相邻价态间不发生氧化还原反应。
常见氧化剂:①、活泼的非金属,如Cl2、Br2、O2 等;②、元素(如Mn等)处于高化合价的氧化物,如MnO2、KMnO4等③、元素(如S、N等)处于高化合价时的含氧酸,如浓H2SO4、HNO3 等④、元素(如Mn、Cl、Fe等)处于高化合价时的盐,如KMnO4、KClO3、FeCl3、K2Cr2O7⑤、过氧化物,如Na2O2、H2O2等高考化学:氧化还原反应典型问题氧化还原反应的规律很多,应用比较广泛的主要有电子得失守恒规律、化合价升降规律、“归中”规律和“强制弱”规律等。
这里给出氧化还原反应的规律应用问题例题解析。
例1.在一定条件下,PbO2与Cr3+反应,产物是Cr2O72-和Pb2+,则与1molCr3+反应所需PbO2的物质的量为A.3.0molB.1.5molC.1.0molD.0.75mol解析:利用得失电子守恒原理解决氧化剂与还原剂物质的量比的问题一直是高考的热点问题。
此题为高考理综新课程卷上的一道选择题,尽管在试题设问上与以往有所不同,但本质上仍然是利用得失电子的物质的量相等原理来考查还原剂Cr3+与氧化剂PbO2的物质的量关系。
有关氧化还原反应的常见物质的氧化性和还原性
一、顺序的由来及依据
学过氧化还原反应的强弱律之后,我们可以根据下列反应
①2FeCl 2+Cl 2=2FeCl 3②2FeCl 3+2HI =I 2+2FeCl 2+2HCl ③I 2+K 2S =S+2KI 判断氧化剂的氧化性由强到弱的顺序为 Cl 2>Fe 3+>I 2>S 同样可以得出还原性由弱到强的顺序为 Cl -<Fe 2+<I -<S 2-
推而广之,我们可以根据大量的氧化还原反应得出常见物质的氧化性还原性顺序。
再者,从理论上由物质的标准电极电势也可得到同样的结论。
二、常见氧化剂(还原剂)的氧化性(还原性)由强到弱顺序 关于SO 2、SO 32-还原性的说明:由于在溶液中SO 2、SO 32-的氧化产物是稀硫酸而不是浓硫酸,再者,由反应I 2+SO 2+2H 2O2HI +H 2SO 4可得,还原性I -<SO 2,所以SO 2、SO 32-的还原性比I -强,但比S 2-弱。
三、助记口诀:
氟锰氯硝浓硫酸,溴铁铜碘硫氢铅。
往后离子氧化性,前氧后低表来翻。
理解要点:
(1)注意各微粒中元素的价态
氧化性 F 2 MnO 4- Cl 2 HNO 3 浓H 2SO 4 Br 2 Fe 3+ Cu 2+
I 2 (SO 42-) 还原性 F - M n 2+ Cl - NO,NO 2 (SO 2) Br - Fe 2+
Cu
I -
SO 2,SO 32- 氧化性
S
H +
Pb 2+
Fe 2+
Zn 2+
Al 3+
Mg 2+
Na +
Ca 2+
K +
还原性 S 2-
H 2
Pb
Fe
Zn
Al
Mg
Na
Ca
K
(2)由氧化性顺序可得还原性顺序,氧化剂的氧化性越强,其对应的还原产物还原性越弱。
(3)强氧化剂可氧化弱氧化剂的还原产物生成弱氧化剂,此之谓“前氧后低”即前面的物质可氧化后面物质的低价态。
四、应用举例
1.推测物质可能发生的氧化还原反应(见下表)
2.推测能否反应及产物
如①Fe 3+
与I -
可反应但不能与Cl -
,Br -
反应; ②浓H 2SO 4能干燥HCl 但不能干燥HBr 、HI 、H 2S;
③Fe 与Cl 2,Br 2能生成FeCl 3,FeBr 3但与I 2,S 只能生成FeI 2,FeS;
④能把Fe 氧化成Fe 3+的有Cl 2,HNO 3,浓H 2SO 4,Br 2但I 2,S 都只能把Fe 氧化成+2价。
⑤HNO 3能氧化HBr,HI,H 2S 但不能氧化HCl 3.推测反应顺序
①如少量Cl 2通入到FeBr 2,FeI 2中的离子方程式就不同;
②把Fe 投入到Fe 2(SO 4)3+H 2SO 4+CuSO 4混合液中时相继发生的反应顺序。
4.判断氧化还原产物及书写氧化还原方程式
如书写KMnO 4与SO 2的方程式,应生成Mn 2++SO 42-然后结合元素守恒判断出其它产物。
5.需要说明的问题:
①Cu 2++S 2-CuS ↓而不是氧化还原,类似的Ag ++(S 2-,Br -,I -)也不是氧化还原。
②2HI +H 2SO 4(浓)I 2+SO 2+2H 2O; I 2+SO 2+2H 2O2HI +H 2SO 4
说明浓度不同,氧化性或还原性也有所不同 ③Cl 2+2KBr2KCl +Br 2 Br 2+2KClO 32KBrO 3+Cl 2
都可以发生,是因为前者氧化性Cl 2>Br 2而后者是还原性Br 2>Cl 2,二者并不矛盾。
④2C+SiO
2CO+Si
2
Na+KClK+NaCl
并不能说明还原性C>Si或Na>K,二者都可以发生,要从抽气引起平衡移动来解释。