初中化学九年级下册高效课堂资料-《溶解度》(第二课时)教案
- 格式:doc
- 大小:141.14 KB
- 文档页数:9


人教版初中化学九下9.2 溶解度(第2课时)教学设计一、教学目标1.了解什么是溶解度,掌握溶解度的概念和计算方法。
2.了解溶解度与温度、溶质质量、溶剂数量之间的关系。
3.掌握溶解度曲线的绘制方法。
4.培养学生观察、实验、分析问题和解决问题的能力。
二、教学重难点1.溶解度的概念和计算方法。
2.溶解度与温度、溶质质量、溶剂数量之间的关系。
3.溶解度曲线的绘制方法。
三、教学准备1.教材《化学(人教版)九年级下册》。
2.实验器材和化学试剂:烧杯、温度计、蒸发皿、玻璃棒、硫酸铜、饱和溶液。
四、教学步骤步骤一:导入新课1.引导学生回顾上节课学到的内容,复习溶质、溶剂、溶解度的概念。
2.提问:你认为溶解度与什么因素有关?学生回答。
3.导入本节课的新知识:溶解度与温度、溶质质量、溶剂数量之间的关系。
步骤二:讲解溶解度与温度的关系1.呈现实验场景:将一小团硫酸铜放入100ml蒸发皿中,加热蒸发皿,当溶液变绿色时停火。
请问:加热后溶解度会发生什么变化?2.进行讨论,引导学生得出结论:加热后溶解度增大。
3.解释现象:加热可以增加溶质分子的运动速度,使其更容易与溶剂分子发生相互作用,从而增大溶解度。
4.提示学生记录实验数据:温度和溶解度之间的关系。
步骤三:讲解溶解度与溶质质量的关系1.呈现实验场景:准备100ml饱和溶液,依次向其中加入1g、2g、3g的溶质,观察溶解度的变化。
2.进行讨论,引导学生得出结论:溶解度随溶质质量的增加而增大。
3.解释现象:增加溶质质量可以增加溶质分子的数量,增大与溶剂分子的相互作用机会,从而增大溶解度。
4.提示学生记录实验数据:溶质质量和溶解度之间的关系。
步骤四:讲解溶解度与溶剂数量的关系1.呈现实验场景:将相同质量的溶质依次溶解在50ml、100ml、200ml的水中,观察溶解度的变化。
2.进行讨论,引导学生得出结论:溶解度随溶剂数量的增加而减小。
3.解释现象:增加溶剂数量可以稀释溶质分子的浓度,减小与溶剂分子的相互作用机会,从而减小溶解度。

人教版初中化学九下9.2 溶解度第二课时教案一、课程内容概述本课时主要内容是关于溶解度的学习。
通过本课的学习,学生将能够理解溶解度的定义和计算方法,并能够应用所学知识解决一些与溶解度有关的问题。
二、教学目标1.理解溶解度的概念及计算方法;2.掌握溶解度与温度、溶质量之间的关系;3.能够应用溶解度的知识解决实际问题。
三、教学重难点1.溶解度的概念及计算方法;2.溶解度与温度、溶质量之间的关系。
四、教学准备1.教材《化学》九年级下册;2.PowerPoint课件。
五、教学过程步骤一:导入通过回顾上节课的内容,复习溶解的概念和溶解过程中的吸热现象。
引出本节课的主题:溶解度。
步骤二:概念讲解1.提出问题:什么是溶解度?学生进行讨论,然后老师给出定义:在一定温度下,饱和溶液中单位体积溶液中所溶解的物质的质量。
2.通过实例讲解溶解度的计算方法。
例如:某溶质在20℃下,每100g水溶解30g,那么其溶解度为:溶解度 = 溶质质量 / 溶剂质量× 100% 溶解度 = 30g / 100g × 100% = 30%3.通过讲解溶解度的计算方法,让学生理解溶解度是用质量比例表示的,并可用百分数表示。
步骤三:溶解度与温度的关系1.引导学生思考:在相同条件下,溶解度是否与温度有关?为什么?2.通过实验讲解溶解度与温度的关系。
教师可准备一些不同温度下的饱和溶液,并让学生观察并比较。
3.结果分析:随着温度的升高,溶解度增大。
可以通过分子动力理论解释,温度的增加会增加溶剂分子的动能,从而有利于溶质分子与溶剂分子的碰撞和相互作用,溶解度增大。
步骤四:溶解度与溶质质量的关系1.引导学生思考:在相同条件下,溶解度是否与溶质质量有关?为什么?2.通过实验讲解溶解度与溶质质量的关系。
可以选取相同温度下不同质量的溶质与相同质量的溶剂进行实验,并观察并比较。
3.结果分析:溶质质量的增加将增加溶质分子与溶剂分子的碰撞机会,从而溶解度增大。

第九单元课题2溶解度(第2课时)教学设计一、教材分析本节课是人教版(2012年版)《义务教育教科书·化学(下册)》第九单元“溶液”课题2溶解度的第2课时,主要学习固体溶解度、气体溶解度以及混合物分离方法。
这一课时可以让学生更深入的理解饱和溶液、不饱和溶液的概念和应用,并为以后学习溶液的浓度、酸碱盐的相关知识作了铺垫。
溶解度的教学主要涉及概念教学、定量分析方法教学、物质分离方法教学等,这有利于发展学生的逻辑思维能力和解决问题的能力,体会化学与生活生产的紧密关系。
本节内容属于化学核心素养的基本素养,也是学生适应未来生活的必需知识,在初中化学中占有重要的地位。
二、学情分析学生已经了解饱和溶液、不饱和溶液的概念,并知道一些简单的转化方法,但是因为大多数的学生还处在形象思维向逻辑思维过渡的阶段,这导致学生定量分析溶液的能力的是有欠缺的。
这一阶段的学生积累了一定的生活经验,只是不能很好的联系化学知识,需要得到适当的引导。
他们对化学实验现象、未知领域以及与前认知相冲突的情境有着强烈的好奇心,所以情境教学活动可以有效的调动学生的学习积极性。
三、素养目标【教学目标】1、了解固体和气体溶解度的含义,利用溶解性表格或溶解度曲线,查阅有关物质的溶解度,依据给定的数据绘制溶解度曲线。
掌握溶解度曲线中点、线、面的含义,能利用溶解度的知识分离混合物、解释生活中的现象。
2、通过比较溶解能力大小的实验活动掌握定量分析的方法,从而建立溶解度的概念。
通过描绘溶解度曲线,提升数据处理和图形分析的能力,能根据不同物质的溶解度曲线的特征分析出物质提纯的方法。
3、通过对溶解度的学习,感知化学知识的重要性,对实际生活、生产有更深层次的理解,进一步的认识严谨的态度、科学的方法、探究的精神在探究过程的重要性。
【评价目标】1、通过对固体和气体溶解度的学习,诊断并发展学生对化学概念的认知水平(认知结构水平)。
2、通过溶解度表格和曲线的形式定量分析物质的溶解度,诊断并发展学生定量分析的科学探究能力(定量的探究发现水平)。

溶解度(第二课时)教学目标:知识与技能:1. 了解固体溶解度概念的含义。
2.学会绘制溶解度曲线,能从溶解度曲线中获取相关的图示信息。
过程与方法:1、初步学会列表法、作图法等常用数据处理方法。
2、通过简单的探究活动,增进对概念的理解和方法的运用。
情感态度与价值观:1.在小组合作学习的过程中,体会自主学习的快乐,学会合作,增强协作精神。
2.认识数型结合法在体现事物变化规律中的作用。
教法学法教法:情景设疑、体验探究、问题启导、科学建构。
学法:小组合作、共享交流、自主探究、反思悟法。
二、教学重点、难点重点:溶解度的含义。
难点:溶解度概念的建立;溶解度曲线的含义。
教学过程:一、创情激趣【视频】“洪荒之力”获铜牌。
【问题】游泳比赛如何比出冠军?二、新知探究(一)概念的形成提出问题:如何比较不同物质的溶解能力的大小呢?以氯化钠和硝酸钾为例,让学生讨论、交流结论:比较两种物质溶解能力的大小,需要控制的条件有:定温度、定溶剂、定状态(饱和)这种溶解的限度在化学上用溶解度来表示溶解度定义:在一定温度下,某固态物质在100克溶剂里达到饱和状态时所溶解的质量,叫做这种物质在这种溶剂里的溶解度(符号S)。
(二)概念的理解例:硝酸钾在20℃时的溶解度是31.6g。
在20℃时,100g水中溶解31.6g硝酸钾,溶液达到饱和。
在20℃时,100g水中最多可溶解溶质的质量为31.6g。
巩固训练:来找茬(1)50gA物质溶于100g水中刚好形成饱和溶液,则该物质溶解度为50g。
()(2)20 ℃50gB物质溶于水中,刚好形成100g饱和溶液,则20 ℃时该物质溶解度为50g。
()(3)20 ℃50gC物质溶于100g水中,形成150g溶液,则20 ℃时该物质溶解度为50g。
()(4)20 ℃50gD物质溶于100g水中恰好形成饱和溶液,则20 ℃时该物质溶解度为50。
()例:某温度下硝酸钾的溶解度为20克,则此温度下硝酸钾饱和溶液中溶质质量:溶剂质量= ,溶质质量:溶液质量=(三)溶解度的表示方法学生自学教材P36、37页,归纳:(1)列表法(2)曲线法对比两种表示方法,找出各自的优缺点:溶解度曲线的应用:结合教材上图9—12,9--13,讨论:(1)固体物质溶解度受温度变化的影响?大多数固体物质溶解度随温度升高而增大,例如硝酸钾等。

9.2 溶解度第二课时教学设计一、教学目标1.理解溶解度的定义和计量单位。
2.掌握溶解度与温度、物质质量之间的关系。
3.熟练运用溶解度相关公式,解决实际问题。
4.培养学生的观察和实验设计能力。
二、教学重点1.理解溶解度的概念和计量单位。
2.掌握温度和物质质量对溶解度的影响。
3.运用溶解度公式解决实际问题。
三、教学内容1.溶解度的概念和计量单位。
2.溶解度与温度的关系。
3.溶解度与物质质量的关系。
4.运用溶解度公式解决相关问题。
四、教学过程1. 情境导入通过展示一个图像或描述一个生活情境,引导学生思考溶解度的概念和意义。
例:在冬天,我们在洗脸时通常需要用热水,而在夏天则可以用冷水。
为什么同样的物质,温度不同时其溶解度也不同呢?2. 知识解释和示例分析将溶解度的定义和计量单位以简洁的语言解释给学生,比如:溶解度是指在特定温度下溶质在溶剂中能溶解的最大质量。
常用单位是克/升。
然后通过示例分析,解释温度对溶解度的影响以及如何计算溶解度,引导学生理解其中的原理和规律。
3. 实验操作设计一个简单的实验验证溶解度与温度的关系。
要求学生使用相同质量的溶质,在不同温度下溶解,测量溶解度并记录数据。
然后让学生总结实验结果,验证温度对溶解度的影响。
4. 教学讲解通过讲解溶解度与物质质量的关系,引导学生理解物质质量对溶解度的影响,并提供相应的计算公式。
解释公式中各项的含义和计算方法,并通过示例演算,让学生掌握运用公式解决实际问题的能力。
5. 练习与讨论给学生提供一些练习题,让他们运用所学知识解决相关问题。
在解答过程中引导学生思考和讨论,加深对溶解度的理解和应用能力。
6. 拓展探究组织学生进行小组或个人拓展探究活动,让他们自主选择一个与溶解度相关的话题,进行调查和研究,并展示自己的发现和成果。
7. 课堂总结通过课堂小结,回顾和强化本节课所学内容,梳理重点和难点,提醒学生理解和记忆重要知识点。
五、教学评价方法1.基于学生实际表现和课堂参与情况进行观察评价。

课题2 溶解度教学重点:饱和溶液的涵义;利用溶解度曲线获得相关信息。
教学难点:固体物质溶解度的涵义;利用溶解度曲线获得相关信息。
教学器材:烧杯、试管多个、NaCl 、KNO 3、酒精灯、火柴、胶头滴管、氢氧化钙、试管夹等。
教学方法:提出问题→ 建立假设→ 设计方案→ 动手实验→ 观察记录→ 分析现象→ 得出结论。
教学课时:2课时教学过程:第二课时【复习引入】⑴什么是饱和溶液?什么是不饱和溶液?⑵如何判断某硝酸钾溶液是否饱和?若不饱和,有几种方法使之转化为饱和溶液?相同条件下,不同物质在水中的溶解能力相同吗?【探究新知】一、溶解性实验【演示】教学目标:知识目标:通过实验探究,建立饱和溶液与不饱和溶液的概念,了解饱和溶液与不饱和溶液的相互转化的方法,了解结晶现象。
能力目标:培养学生实验,观察、分析、归纳的能力。
知道影响气体溶解度的一些因素。
会利用有关气体溶解度的知识解释身边的一些现象。
情感目标:逐步建立用辩证的、发展的思想观点来看待事物的变化,和逐步培养由具体到一般认识事物过程的能力,并培养学生互相协作、友好相处的健康心态。
分别加入极少量熟石灰较多量的氯化钠两支同量水的试管中,振荡蔗糖全部溶解熟石灰剩余相同条件下,有些物质易溶于水,有些物质很难溶解,说明不同物质在水中的溶解能力不同。
碘易溶于汽油,而却很难溶于水中,由此可得出什么结论?高锰酸钾易溶于水中,而油脂却很难溶解在水中,由此可以得出什么结论?物质溶解性大小与溶质、溶剂的性质有关。
如何比较不同物质在水中溶解性的大小?溶解性只是简单地描述了物质本身的一种属性,怎样才能定量地描述物质的溶解能力呢?下面,我们来研究溶解度。
我们常用溶解度来表示物质溶解性的大小。
根据溶质的状态不同,溶解度可分为固体溶解度和气体溶解度,我们先学习固体溶解度。
二、固体溶解度⒈溶解度在一定温度下,某固态物质在100g 溶剂里达到饱和状态时所溶解的质量,叫做这种物质溶解在这种溶剂里的溶解度。

《溶解度》(第二课时)教案.doc第二课时教案教学目标:1. 了解溶解度的定义和影响因素;2. 掌握测量溶解度的方法;3. 理解饱和溶液的概念和其特征。
教学重点:2. 如何准确测量溶解度。
教学过程:一、课前导入1. 提问:什么是溶解?什么是溶解度?2. 呈现图片:(见附件1)请同学们看图,思考图片中的现象。
3. 引导思考:为什么糖放到水中会消失,而石头放到水中不会消失?二、知识点讲解溶解指的是把一种物质溶解在另一种物质中的过程。
溶解度是指在规定的温度和压力下,单位体积溶媒中最多能溶解的溶质的质量。
通常用符号S表示,单位是g/L或mol/L。
影响溶解度的因素很多,包括溶剂的性质、温度、压力等。
下面简单介绍一下各个因素对溶解度的影响。
(1)溶剂的性质溶解度与溶剂的性质有很大关系。
由于不同溶剂的分子之间有着不同的相互作用力,不同的溶剂对不同的物质的溶解度也会产生影响。
(2)温度溶解度与温度的关系十分密切。
通常情况下,溶解度随着温度升高而增加,但对于某些物质来说,溶解度随着温度升高而降低。
(3)压力溶解度与压力的关系通常不太显著。
但对于一些气体溶解度来说,随着压力的增加,溶解度也会增加。
(1)重量法重量法是一种通过称量样品质量和饱和溶液的质量来确定溶解度的方法。
计算公式为: S = m / V其中,S为溶解度,m为样品的质量,V为饱和溶液的体积。
(2)体积法通过加入不断递增的溶质来测量溶解度的方法称为体积法。
在该方法中,温度和压力必须固定,然后记录每次加入溶质的量并测量饱和溶液的体积。
计算公式为:饱和溶液是指在一定温度下,添加溶质到溶剂中直到不能再溶解更多的溶质的溶液。
该溶液具有以下特征:(1)饱和溶液中溶质的摩尔浓度不再随着添加更多溶质而增加;(2)饱和溶液和溶质之间达到了平衡状态;(3)温度和压力是不变的,否则饱和溶液的饱和度也将发生变化。
三、课后练习1. 根据以下数据计算NaCl在25℃下的溶解度:质量:10g体积:200mL3. 什么是饱和溶液?饱和溶液有哪些特征?教学总结:通过本课时的讲解,同学们了解了溶解度的定义及影响因素,学会了测量溶解度的方法,并掌握了饱和溶液的概念及其特征。

第九单元课题2 溶解度〔第二课时〕
一、教材依据
本节课是人教版九年级化学,第九单元课题2?溶解度〔第二课时〕?。
二、设计思路
本节课内容接近学生的生活经验,而且是在学生已经掌握了溶液形成以及饱和溶液与不饱和溶液等根底上,又接触的溶解度,便于理解,因此在教学中,我是从生活中熟悉的物质入手,运用实验手段,提供丰富的教学信息,设计合理问题情境,使学生在情境的刺激下产生兴趣、好奇,从而进行问题分析,由表及里,认识溶解度在生产、生活和社会开展中的重要作用。
采用归纳比照分析法和学生合作探究的方法,让学生在“探究中学习〞,在“学习中探究〞。
三、教学目标:
1.知识与技能
理解溶解度与溶解性之间的关系;掌握溶解度的概念,会从溶解度的曲线中得到信息;了解气体溶解度的概念及影响因素。
2.过程与方法
通过学习溶解度的概念,使学生懂得任何事物都是相对的,并且量变引起质变;通过对溶解度曲线的学习,培养学生观察图像的能力;会利用有关气体溶解度的知识解释身边的一些现象。
3.情感态度与价值观
逐步建立用辩证的、开展的思想观点来看待事物的变化,和逐步培养由具体到一般认识事物过程的能力,并培养学生互相协作、友好相处的健康心态。
四、教学重点:
利用溶解度曲线获得相关信息。
五、教学难点:
固体物质溶解度的涵义,利用溶解度曲线的相关信息解决实际问题。
六、教学准备:
多媒体课件;蔗糖、碘、氢氧化钙、酒精、水、药匙、镊子、试管、烧杯等。
七、教学过程:
八、板书设计:
课题3 溶解度〔第二课时〕。
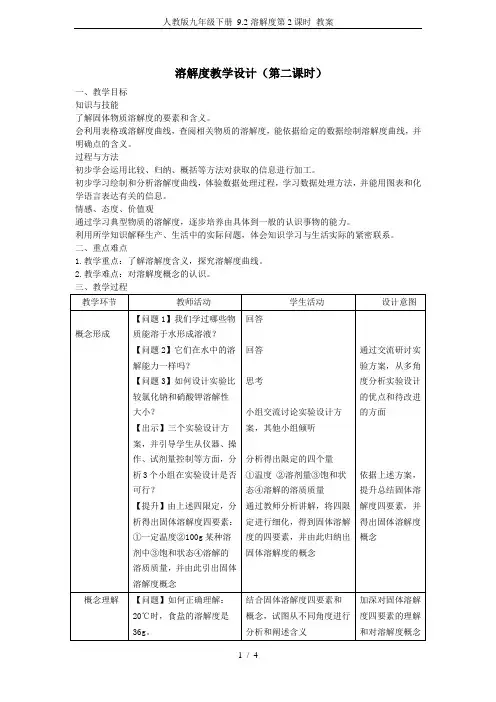
溶解度教学设计(第二课时)
一、教学目标
知识与技能
了解固体物质溶解度的要素和含义。
会利用表格或溶解度曲线,查阅相关物质的溶解度,能依据给定的数据绘制溶解度曲线,并明确点的含义。
过程与方法
初步学会运用比较、归纳、概括等方法对获取的信息进行加工。
初步学习绘制和分析溶解度曲线,体验数据处理过程,学习数据处理方法,并能用图表和化学语言表达有关的信息。
情感、态度、价值观
通过学习典型物质的溶解度,逐步培养由具体到一般的认识事物的能力。
利用所学知识解释生产、生活中的实际问题,体会知识学习与生活实际的紧密联系。
二、重点难点
1.教学重点:了解溶解度含义,探究溶解度曲线。
2.教学难点:对溶解度概念的认识。
三、教学过程。

《溶解度》教学设计第2课时◆教材分析本课题包含饱和溶液和溶解度两部分知识主要从定量的角度让学生去认识物质的溶解性以及溶液的状态。
以学生亲身参与的“活动与探究”和“讨论”为线索组织教学过程。
先引人饱和溶液的概念,再引入溶解度概念,并巩固和应用溶解度概念。
最后通过讨论引入气体溶解度的概念。
本课题要求学生能利用溶解性表或溶解度曲线,依据给定的数据绘制溶解度曲线,并利用溶解度曲线获得有关信息。
同时注重让学生学会运用比较、归纳、概括等方法对获取的信息进行加工利用,认识定量研究对于化学科学发展的重大作用,形成严谨、求真的科学态度,为将来学习打下坚实的基础。
◆学情分析在学生从定性角度了解溶液的组成和基本特征之后,本课题以物质的溶解度为核心展开,从定量的角度认识物质的溶解性。
这样从定性研究到定量研究,知识内容加深了,研究方法提高了,因此对学生的能力要求也提升了一个层次。
◆教学目标1.了解饱和溶液的概念;了解固体物质溶解度的含义。
2.会利用溶解性表或溶解度曲线,查阅有关物质的溶解性或溶解度;能依据给定的数据绘制溶解度曲线。
3.知道影响气体溶解度的一些因素。
4.会利用有关知识解释身边的一些现象。
5.学习利用已取得的信息,运用比较、归纳、概括等方法对获取的信息进行加工。
6.认识定量研究对于化学科学发展的重大作用。
7.通过绘制溶解度曲线,对学生进行严谨、求真的科学态度的教育,激发学生的学习兴趣和求知欲。
◆教学重难点【教学重点】建立饱和溶液和溶解度的概念,利用溶解度曲线获得有关信息。
【教学难点】固体物质溶解度的含义;利用溶解度曲线获得有关信息。
◆课前准备相关资料卡片、活动卡片、图片等。
◆教学过程一、导入新课【展示】一杯水【提问】大家看,你觉得这杯水可以无限量地溶解食盐吗?【导入】这说明食盐在水中具有一定的溶解限量。
事实上,大多数的固体物质都像食盐一样在水中不能无限量地溶解。
那么,哪些因素会影响溶解限量,我们又如何表示溶解限量呢?这节课,我们来继续学习课题2 溶解度。
人教版九年级化学下册教案第九单元溶液课题2 溶解度(第二课时)课时目标1.掌握溶解度的概念和计算方法;2.了解影响溶解度的因素。
教学重点1.溶解度的概念和计算方法;2.影响溶解度的因素。
教学难点1.理解溶解度和溶解度曲线的关系;2.掌握计算溶解度的方法。
教学准备•教师:黑板、粉笔、实验器材;•学生:教材、作业本,实验记录表。
教学过程Step 1 概念讲解1.教师引导学生回顾上节课所学内容,复习溶解度的定义和单位,并与饱和溶液、过饱和溶液做简单区分。
2.教师向学生介绍溶解度与溶质的质量、溶剂的质量以及温度有关,并且关系密切。
Step 2 溶解度的计算方法1.教师将学生分为小组,每个小组选择1个溶质进行实验,根据教师提供的溶剂和温度条件,计算溶解度。
2.教师示范一个计算溶解度的实验步骤,并引导学生按照实验步骤进行操作。
3.学生根据实验结果计算溶解度,并填写在实验记录表上。
4.各小组汇报实验结果和计算溶解度的方法。
Step 3 实验结果的分析和讨论1.教师带领学生对实验结果进行分析,探讨影响溶解度的因素。
2.教师引导学生思考以下问题:–在相同温度下,固定溶质质量,溶剂质量逐渐增大,溶解度是增大还是减小?为什么?–在相同溶质质量下,溶剂质量和溶解度之间有何关系?–在相同溶质质量和溶剂质量下,随着温度的升高,溶解度是增大还是减小?为什么?Step 4 总结归纳1.教师对本节课的重点知识进行总结归纳,强化学生对溶解度的理解。
2.教师核对学生填写的实验记录表,并对常见的计算错误进行讲解和纠正。
课堂小结本节课我们学习了溶解度的概念和计算方法,了解了影响溶解度的因素。
通过实验和讨论,学生对溶解度有了更深的理解,并掌握了计算溶解度的方法。
课后作业1.完成课本上相关的练习题;2.思考如何改变实验条件,使得溶解度发生变化。
以上是本节课的教案,希望能对您的教学工作有所帮助。
祝您教学愉快!。
课题1溶解度一、教材分析本课是人教版九年级化学下第九单元《溶液》之课题2,属于课程标准中一级主题《物质的化学变化》下的《水与常见的溶液》。
固体溶解度是贯穿溶液知识体系的一个重要纽带,使学生对溶液从定性认识转向定量认识,并为结合数据判断溶液是否饱和、饱和溶液和不饱和溶液的相互转化、结晶方法的选择等提供了较好的数据支撑,可以帮助学生初步形成用定量数据指导定性实验的观念。
通过本单元课题1的学习,学生对溶液及其组成、基本特征有了初步认识,通过课题2第一课时的学习,学生能区分饱和溶液和不饱和溶液,并初步了解两者之间相互转化的方法。
在此基础上,本课时定量研究溶质在一定量溶剂中溶解的限度,提出了固体溶解度概念,并学习绘制溶解度曲线,顺应了学生的学习需要,能较好地激发学生的探究欲望和学习兴趣。
这部分知识的学习可以培养学生实践与理论相结合的意识,在增长知识的同时,逐步学会分析和解决问题的方法。
二、学情分析初三学生思维活跃,课外知识较为丰富,对未知世界充满好奇,乐于完成富有挑战性的任务,喜欢将所学知识和已有经验、生活实际相联系,愿意表达自己的观点。
通过课题1的学习,学生了解了溶液的组成和基本特征,明确了饱和溶液、不饱和溶液及其相互转化,学生也具备了绘制溶解度曲线所需的在平面直角坐标系绘制曲线的数学知识。
目前学生已具备一定的观察、比较、分析、归纳等能力,但还需要巩固和提高,特别是从定性研究转向定量研究,对学生的能力要求提升了一个层次。
三、课时安排本课程共分为两课时:课时1饱和溶液课时2溶解度课时2溶解度一、教学目标1.了解固体物质溶解度的含义。
2.了解溶解度曲线所表示的意义,能通过溶解度曲线获得相关信息。
3.知道影响气体溶解度的一些因素,能利用气体溶解度的知识解释生活中的相关现象。
二、教学重难点教学重点:1.固体物质的溶解度的含义。
2.利用溶解度曲线获得相关信息。
教学难点:利用溶解度曲线获得相关信息。
三、教学过程【问题与讨论】上节课我们已学习了饱和溶液与不饱和溶液,在实验过程中,室温下,10g氯化钠或硝酸钾放入20mL水中,都有固体剩余,那两者剩余的固体量一样吗?【图片展示】“溶解之王”争霸赛【实验探究】氯化钠与硝酸钾相比谁的溶解能力更强呢?【问题】该如何设计?【讲解】判断两种固体物质溶解的多少时,需要限定的条件:1.物质在水中溶解的多少与溶剂的量有很大关系,所以必须限定相同质量的水。
初中化学九年级下册高效课堂资料
课题二《溶解度》(第2课时)
【教学目标】
知识与技能:
1.理解溶解度的含义,知道溶解度的相对大小与溶解性的关系。
2.了解溶解度曲线,能利用溶解度曲线查阅有关物质的溶解度。
3.认识影响气体溶解度大小的因素。
过程与方法:
培养学生观察、分析能力及利用控制变量法进行抽象概括、形成规律性认识的能力。
情感态度与价值观:
通过对不同物质溶解度的比较和外界条件对物质溶解度影响的分析,体会事物内外因关系和质变与量变的辩证关系。
【教学重点】固体溶解度概念及溶解度曲线
【教学难点】固体溶解度概念及溶解度曲线的应用
【突破方法】实验探究法、多媒体辅助法、讨论法、归纳分析法
教学过程:
【课前预习】
1、不同物质在水中溶解能力是否相同?举例说明。
2、同种物质在不同溶剂中溶解能力是否相同?
【课内探究】
小组交流预习结果
【反馈小结】
物质的溶解能力不仅与溶质的性质有关,也与溶剂性质有关。
一、溶解性
通常我们将一种物质在另一种物质中的溶解能力大小叫溶解性。
【投影展示】影响溶解性大小的因素(学生记笔记)
内因:溶质性质和溶剂性质;外因:温度(若是气体,还与压强有关)二、溶解度
【实验探究】如何比较氯化钠、硝酸钾的溶解性大小?
【分组讨论】
(设计意图:给学生充足的讨论时间,鼓励他们畅所欲言,相互纠错与补充,教师再给予适时的提示与总结。
)
提示性问题:
(1)水温相同还是不同?用一杯冷水和一杯热水分别溶解氯化钠和硝酸钾,行不行?
(2)水的体积是否相同?用一杯水和一盆水分别溶解,行不行?(3)是否要达到饱和状态?100克水能溶解1克氯化钠也能溶解1克硝酸钾,能否说明氯化钠、硝酸钾的溶解性相同?确定实验方案【点拨总结】要比较二者溶解性的大小,必须在(1)水温相同(2)水的体积相同(3)达到饱和状态时才能比较
【投影展示】展示完整方案并进行实验
方案:
实验1:在50ml水(水温均为20℃)加入各10g氯化钠和硝酸钾并搅拌,观察现象;
实验2:再分别秤取10g氯化钠和硝酸钾,
分别继续往实验1所得溶液中加入,都加到不再溶解为止,看最后分别剩余多少,
计算:二者在20℃时,一定量的水中达到饱和状态时溶解的多少{结论}1、20 ℃时,氯化钠比硝酸钾更易溶于水。
【点拨】用溶解度来定量表示物质溶解能力的大小
若把溶剂的量规定为100 g,则某温度下100 g溶剂中最多溶解的溶质的质量为这种溶质在这个温度下的溶解度。
【思考】理解溶解度的涵义,并思考从上述实验中还可得什么结论?{结论}2、20 ℃时,氯化钠的溶解度是36g,硝酸钾的溶解度是31 .6g。
(一)溶解度定义
【学生自学】
【思考1】理解固体溶解度定义时需考虑哪几个要素?
学生先独立思考后,再与同学交流自己的看法
【投影展示】学生记笔记
①定温②100 g溶剂③饱和状态④溶解溶质质量,四个要素缺一不可
【思考2】溶解度表示什么含义?
如:某物质在20ºC的溶解度为21.5g,其含义是什么?
【同桌交流】
【投影展示】
其含义是:在20ºC时,该物质在100g水中达到饱和状态时溶解的质量为21.5g;或者说:在20ºC时,在100g水中最多能溶解该物质21.5g。
【思考3】影响固体溶解度的因素是什么?
学生回答后,小结:
外因:温度
内因:溶质的性质溶剂的性质
(二)溶解度和溶解性的关系
【自学】课本P36中间资料
【点拨】此时溶解度对应的温度是20ºC
【跟踪训练】
1、判断下列说法是否正确,并指明错误原因。
①把20克某物质溶解在100克水里恰好制成饱和溶液,这种物质的溶解度就是20克。
②20℃时10克氯化钠溶解在水里制成饱和溶液,故20℃时氯化钠的溶解度是10克。
③20℃时10克氯化钠可溶解在100克水里,故20℃时氯化钠的溶解度是10克。
④20℃时36克食盐溶解在100克水中恰好饱和,故20℃时食盐的
溶解度是36。
2、①不溶物就是绝对不溶的物质。
这句话是否正确?
②20℃时碳酸钙的溶解度是0.0013克,所以碳酸钙是___物质。
③20℃时食盐的溶解度是36克,所以食盐属于__物质。
【点拨】用实验的方法可以测出不同物质在同一温度时的溶解度,也可测出同一物质在不同温度时的溶解度,怎样表示物质的溶解度?(三)溶解度的表示方法:
【投影展示】
(1)列表法
(2)溶解度曲线
投影展示几种固体物质的溶解度曲线。
【学生观察】观察溶解度曲线,找出10 ℃时硝酸钠的溶解度及在什么温度下,硝酸钾的溶解度为110 g。
【交流讨论】
1、溶解度曲线上的每一个点表示什么含义?
2、不同物质溶解度曲线的交点表示什么意义?
3、溶解度曲线有哪些应用?
4、影响固体溶解度的主要因素是什么?表现在哪些方面?
学生交流讨论后,小组总结发言
【投影展示】学生做好笔记
1:曲线上的点:表示某物质在某一温度时的溶解度(溶液是饱和的)2:曲线的交点:表示不同物质在某一温度时的溶解度相同
3:溶解度曲线的应用:
(1)可以查出同一物质在不同温度时的溶解度
(2)可以看出不同物质溶解度受温度变化影响的大小:曲线越陡,该物质的溶解度受温度影响越大
(3)可以比较不同物质在同一温度时的溶解度大小
4:影响固体溶解度的外在因素是温度
(1)大多数固体溶解度随温度升高而增大,例如硝酸钠;
(2)少数固体溶解度受温度影响不大,例如氯化钠;
(3)极少数固体随温度升高溶解度反而减小,例如氢氧化钙。
二、气体溶解度
【讨论】1、天气闷热时,鱼儿为什么总爱在水面上进行呼吸?
天气闷热时,温度高,压强小,水中溶解的氧气少
2、课本P38讨论题
【点拨】这些现象都与气体的溶解度有关
(一)定义
自学课本课本P38有关内容
(二)影响气体溶解度的因素
根据以上讨论题和生活中的一些现象,说明影响气体溶解度的因素有哪些?
学生回答后,小结
【投影展示】影响气体溶解度的因素:
气体溶解度一般随压强增大而增大,压强减小而减小。
气体溶解度一般随温度升高而减小,温度降低而增大。
【基础达标】见课件
1、(1)A点表示意义?
(2)在40℃时,硝酸钾的溶解度___ (填大于、小于)硝酸钠的溶解度(3)在80℃时氯化钠、氯化钾、氯化铵、硼酸的溶解度由大到小的顺序是___________________________。
2、甲、乙两种不含结晶水的固体物质在不同温度下的溶解度如下
根据下表中的数据进行判断,下列有关说法正确的是()
A. 甲的溶解度大于乙的溶解度
B. 30℃时,等质量的甲、乙两物质饱和溶液中所含溶质的质量相等
C. 使乙物质从它一定温度下的饱和溶液中析出,可采用冷却的方法
D. 升高温度可使甲的不饱和溶液转变为饱和溶液
3. 增大二氧化碳在水中溶解度的方法()
A. 升温增压;
B. 升温减压;
C. 降温增压;
D. 降温减压。
4.下列几种物质①硝酸钾②熟石灰③氧气④二氧化碳溶解度随温度的升高而增大的是()
A.①②
B.③④
C.①③④
D.只有①
【能力提升】
5.对多数固体物质,使其不饱和溶液变为饱和溶液时,一般可采取的
办法是( )
A.增加压强
B.升高温度
C.加溶质或减少溶剂
D.降低温度 6.室温下,向一定量的氯化钠溶液中加入10 g 氯化钠固体充分搅拌后,尚有部分固体未溶解,加入10 g 水后,固体全部溶解。
下列判断正确的是( )
A.加水前是饱和溶液
B. 加水前可能是饱和溶液
C. 加水后一定是饱和溶液
D. 加水后一定是不饱和溶液 【梳理所学,盘点收获】
通过这节课的学习,你学到了什么?看谁说得好 【投影】 小结:
【课后拓展】
硝酸钾固体中含有少量氯化钠,如何提纯硝酸钾?
第三节 溶解度
同种溶质在不同的溶 剂中的溶解能力不同
不同的溶质在同种溶 剂中的溶解能力不同
溶解性
物质的溶解度
定量描述
①一定温度 ②100克溶剂 ③溶液饱和 ④单位是克
易溶 、可溶 、 微溶 、 难(不)溶
固体的溶解度
气体的溶解度
影响因素
表示方法
表示方法
影响因素。