A.M B.M2+ C.M3+ D.MO2+
(2)实验中需配制1.0 mol/L的NaOH溶液100 mL,所需仪器除了玻璃棒、托盘天平、量筒、药匙、烧杯、胶头滴管,还缺少的仪器有
________________________________________________________________________。 A. ①是酒精,②是CCl4,③是苯
C. 蒸发后所得精盐很潮湿 (3)F E
(72)绿色植物的光合作用:6CO2+6H2O C6H12O6+6O2
D. 蒸发皿上沾有精盐没有全部转移到称量纸上 3. 常见有机物发生的反应
(33)铁和硫酸铜溶液(“曾青得铁则化为铜”):Fe+CuSO4 FeSO4+Cu(固体表面覆盖一层红色物质,溶液由蓝色变为浅绿色;湿法炼铜) 3.(1)冒气泡,溶液变浑浊 x=390 g
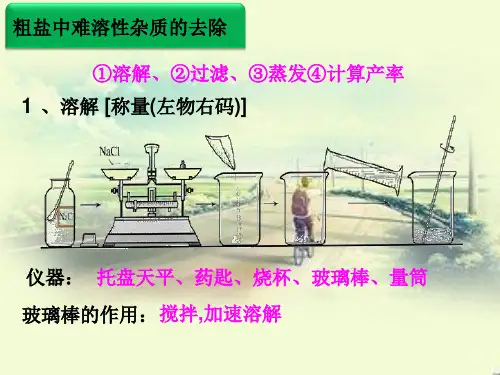
溶解
• 玻璃棒的作用: 搅拌,加速溶 解
过滤
• 玻璃棒的作用 引流
蒸发
• 玻璃棒的作用: 搅拌、防止局 部过热液体发 生飞溅
谢观 谢
看
热(或间歇加热烘干)
(4)转移精盐时,确保全部转移到指定容器 (5)玻璃棒使用正确
生活中的不 溶性杂质的 去除应用
常见蒸 (37)稀盐酸除铁锈:6HCl+Fe2O3 2FeCl3+3H2O(红色固体逐渐溶解、溶液由无色变为黄色)
(2)反应物都是固体和液体,反应都不需要加热
发结晶 [解析] (1)一氧化碳具有可燃性,与空气混合加热可能会发生爆炸,故在加热前要先通一氧化碳以排尽玻璃管内的空气,防止一氧化碳不纯发生爆炸。(2)在高温条件下,一氧化碳与氧化铁
厨房 酸,化学方程式为:SO2+H2O H2SO3,2H2SO3+O2 2H2SO4。(3)以上两个化学反应都属于化合反应;氢元素显+1价,氧元素显-2价,所以亚硫酸中硫元素的化合价为+4。(4)亚硫酸、硫 工业生产 酸、盐酸和碳酸都能使石蕊溶液变红的原因是溶液中都含有氢离子。(5)吸收二氧化硫常用氢氧化钠溶液,氢氧化钠和二氧化硫反应生成亚硫酸钠和水。