分析化学滴定分析概论
- 格式:ppt
- 大小:660.50 KB
- 文档页数:48







第五章 化学平衡与滴定分析法概论第一节 定量分析的步骤和要求定量分析的任务:准确测定试样中待测组分的含量步骤:试样的采集与制备;分析方法的选择;试样预处理;测定;结果评价。
要求:准确测量,对化学分析,化学反应完全程度达到99.9%。
第二节 分析化学中的溶液平衡(一)活度平衡常数pC nB mA =+ n Bm A p c a a a Ka = (二)离子活度和浓度的关系:][i i i C a γ=(三)离子强度与离子的活度系数21][21i n i i Z C I ∑== )3.01(50.0lg 2I II Z i i -+-=γ γ<1, a<c. 当 I<10-4 mol/kg, γ→1,a ≈c(四)浓度常数和活度常数的关系p C n B m A n m pcaKa B A C K γγγ==][][][, n n B m m A p p c n B m A p c B A C a a a Ka ][][][γγγ== 混合平衡常数:n m A p maB aC K ][][= 第三节 滴定分析法概论一、滴定分析法的过程、有关术语和方法特点1 .滴定分析过程、化学计量点与终点过程: 使用滴定管将一种已知准确浓度的试剂溶液(标准溶液)滴加到待测物的溶液中,直到待测组分恰好完全反应止,然后根据标准溶液的浓度和所消耗的体积,算出待测组分的含量。
滴定分析基本术语:滴定:滴加标准溶液的操作过程。
化学计量点(sp ):滴加标准溶液与待测组分按化学反应方程式化学计量关系就恰好完全反应之点。
指示剂:滴定分析中能发生颜色改变而指示终点的试剂终点(ep):指示剂变色之点。
终点误差(Et):实际分析操作中指示剂变色点与化学计量点之间的差别。
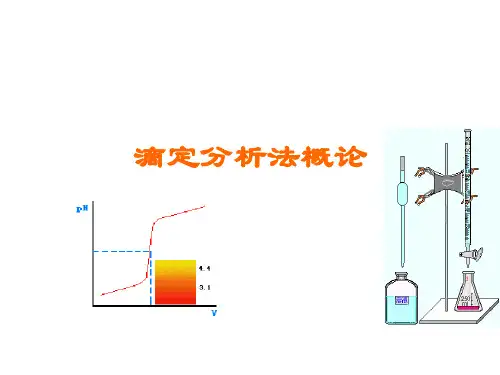
2、滴定曲线、滴定突跃和滴定突跃范围滴定曲线:在滴定过程中,溶液性质与滴定剂加入量之间的函数关系曲线。
滴定突跃:滴定过程中,溶液性质的变化在计量点附近急剧变化,滴定曲线的中段近于垂直线,这种由量变到质变的现象称为滴定曲线。


第四章 滴定分析概论1. 当加入的标准溶液与待测组分按反应式的化学计量关系恰好反应完全时,反应即达到了化学计量点。
滴定度是指每毫升滴定剂相当于待测物质的克数,用T T/A 表示;每毫升滴定剂中所含溶质的克数表示的滴定度用T M 表示。
先用适当的试剂与待测物质反应,使之置换出一种能被定量滴定。
2. 用来直接配置标准溶液的物质即称为基准物质。
基准物质应具备的条件:1) 物质具有足够的纯度,即杂质含量小于滴定分析所允许的误差限度; 2) 物质的组成要与化学式完全符合;3) 物质的性质稳定,加热干燥时不分解,称量时不吸湿,不吸收CO 2,不被空气氧化;4) 物质最好具有较大的摩尔质量以减少称量误差。
5. 计算下列各物质的量浓度。
(1)用0.630g 的H 2C 2O 4· 2H 2O 配制成100.0ml 的溶液; (2)用98.0mg 的H2SO4配成20.0ml 的溶液; (3)用3.00g 的NaOH 配制成0.100L 溶液; (4)用69.0 g 的BaCl2配制成2.00L 溶液(2)L mol /04997.0100.2008.98100.9833=⨯⨯-- (3) L mol /7500.0100.000.4000.3=(4) L mol /1657.000.223.2080.69=4. 已知浓盐酸的相对浓度为1.19,其中含HCl 为37%,求其浓度为多少?如欲配制1L 0.1mol/L 的HCl 溶液,应取这种浓盐酸多少毫升?L mol /08.12146.36%37100019.1=⨯⨯ v 08.121.01=⨯ ml v 28.8=9. 现有0.0968mol/L HCl 溶液1000ml, 欲配成0.1000mol/L HCl 溶液2000ml,需加入盐酸溶液多少毫升?20001000.008.1210000968.0⨯=+⨯v ml v 60.8=10. 用20.00ml KMnO 4溶液恰好能氧化一定重量的KHC 2O 4· 2H 2O ,同样重量的KHC 2O 4· 2H 2O 能被0.1000mol/L NaOH 溶液22.10ml 中和,试求KMnO 4溶液的浓度。
第三章 滴定分析法概论思考题3.下列物质中哪些可用直接法配制标准溶液?哪些只能用间接法配制?为什么? 答:直接法:K 2Cr 2O 7, NaCl, AgNO 3 有可以直接配制的基准物质间接法: NaOH, H 2SO 4, HCl, Na 2S 2O 3, KMnO 4性质不稳定,无对应基准物质5.若用硼砂Na 2B 4O 7·10H 2O 基准物长期保存在硅胶干燥器中,当用其滴定HCl 溶液浓度,则结果是偏高还是偏低?答:长期放于干燥器中结晶水会逐渐消失,即m 会减小,根据C HCl =m/MV 可知,用其滴定HCl ,结果会偏低。
6. 写出下列物质溶液的电荷平衡(1)H 2SO 4电荷平衡式:[H +] = [OH -] + [HSO 4-] + 2[SO 42-](2)H 3AsO 4电荷平衡式: [H +] = [OH -] + [H 2AsO4-] + 2[HAsO 42-] + 3[AsO 43-] (3)MgBr 2电荷平衡式:[H +] + 2[Mg 2+] = [OH -] + [Br -]7.写出下列物质在水溶液的质量平衡式(总浓度为c ) (1)Mg(OH)2 : [Mg] = c [OH -]-[H +] =2c (2)Zn 2(Fe(CN)6): [Zn 2+] = 2CC=[Fe(CN)64-]+[Fe(CN)53-]+[Fe(CN)42-]+[Fe(CN)3-]+[Fe(CN)2]+[FeCN +]+[Fe 2+] (3)NaH 2PO 4 :[Na +] = C C = [H 3PO 4] + [H 2PO 4-] + [HPO 42-] + [PO 43-]习题答案1. 已知浓硫酸的密度为1.84g/cm 3,其中含H 2SO 4约为96%(质量分数),求其浓度。
若配制0.15mol/L H 2SO 4溶液1L,应取多少毫升浓硫酸? 解:浓硫酸的浓度:L mol C /181/08.98100096.084.1=⨯⨯=取浓硫酸 mL V C C V 3.810001815.01212=⨯==2. 有0.5540mol/L KOH 溶液100.0mL ,需加多少毫升水才能配成0.5000 mol/L 的溶液? 解:由2211V C V C =得: mL V V 80.10)0.100(5000.00.1005540.0=⇒+⨯=⨯3. 试计算K 2CrO 7标准溶液(0.02000mol/L )对Fe,FeO,Fe 2O 3和Fe 3O 4的滴定度。