水的电离和溶液的pH(第一课时)
- 格式:ppt
- 大小:113.00 KB
- 文档页数:5
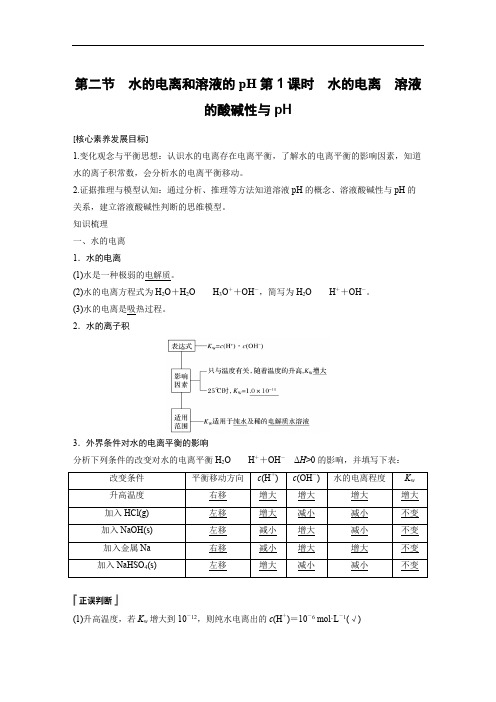
第二节水的电离和溶液的pH第1课时水的电离溶液的酸碱性与pH[核心素养发展目标]1.变化观念与平衡思想:认识水的电离存在电离平衡,了解水的电离平衡的影响因素,知道水的离子积常数,会分析水的电离平衡移动。
2.证据推理与模型认知:通过分析、推理等方法知道溶液pH的概念、溶液酸碱性与pH的关系,建立溶液酸碱性判断的思维模型。
知识梳理一、水的电离1.水的电离(1)水是一种极弱的电解质。
(2)水的电离方程式为H2O+H2O H3O++OH-,简写为H2O H++OH-。
(3)水的电离是吸热过程。
2.水的离子积3.外界条件对水的电离平衡的影响分析下列条件的改变对水的电离平衡H2O H++OH-ΔH>0的影响,并填写下表:改变条件平衡移动方向c(H+)c(OH-)水的电离程度K w升高温度右移增大增大增大增大加入HCl(g)左移增大减小减小不变加入NaOH(s)左移减小增大减小不变加入金属Na右移减小增大增大不变加入NaHSO4(s)左移增大减小减小不变(1)升高温度,若K w增大到10-12,则纯水电离出的c(H+)=10-6 mol·L-1(√)(2)在纯水中加入少量酸,水的电离平衡向逆向移动,K w 减小(×)(3)25 ℃时,若溶液中c (H +)=1.0×10-6 mol·L -1,则溶液中c (OH -)=1.0×10-8mol·L -1(√) (4)25 ℃时,水的离子积K w =1.0×10-14,35 ℃时水的离子积K w =2.1×10-14,则35 ℃时水中的c (H +)>c (OH -)(×) (5)25 ℃时,0.01 mol·L-1的盐酸中,由水电离出的c (OH -)=1.0×10-12mol·L -1(√)1.常温下,某溶液中由水电离出来的c (H +)=1.0×10-11mol·L -1,该溶液可能是________。



水的电离和溶液的pH(第一课时)水的电离和溶液的pH是化学中十分重要的基础概念。
本文将在“接地气”的写作风格下,对水的电离和溶液的pH进行科普,增加一些语气词和情绪词,让化学学习更加生动有趣!
一、水的电离
水是一种极其重要的物质,它的化学性质对许多化学反应和地球环境有着重要影响。
水分子在互相碰撞时,会有一些分子间的反应,使其中一部分水分子转化为氢离子(H+)和氢氧根离子(OH-),此过程即称为水的电离。
水的电离反应可以表示为:H2O = H+ + OH-,其中H+离子称为酸性离子,OH-离子称为碱性离子。
二、酸碱中和
酸和碱是化学中重要的概念。
当酸性溶液和碱性溶液混合时,会发生中和反应,生成的溶液称为酸碱中和溶液。
如何确定溶液的酸碱性呢?这时就需要用到溶液的pH值。
pH值是刻画溶液酸碱性质的重要参数,它表示溶液中氢离子浓度的负对数,即pH = -log[H+]。
当溶液中[H+]浓度为1×10^-7mol/L时,它的pH为7,称为中性溶液。
当溶液中[H+]浓度高于1×10^-7mol/L时,pH小于7,称为酸性溶
液,如橙汁;当[H+]浓度低于1×10^-7mol/L时,pH大于7,称为碱性
溶液,如肥皂水。
三、结论
水的电离和溶液的pH一直是化学学习中不可或缺的基础知识。
通
过本文的科普,我们可以了解到水的电离反应和酸碱中和的基本概念,并学会了如何确定溶液的酸碱性质。
相信我们在接下来的学习中,将
更加轻松深入地了解更多化学知识。


第二节水的电离和溶液的pH第1课时水的电离溶液的酸碱性与pH基础巩固1.纯水在80 ℃时的pH()。
A.等于7B.大于7C.小于7D.无法确定答案:C解析:25 ℃时,纯水的pH=7,升高温度,水的电离平衡向右移动,c(H+)增大,所以pH<7。
2.常温下,水的电离达到平衡:H2O H++OH-ΔH>0。
下列叙述正确的是()。
A.向水中通入少量氨气,平衡逆向移动,c(OH-)减小B.向水中加入少量NaHSO4粉末,c(H+)增大,K W不变C.向水中加入少量CH3COONa固体,平衡逆向移动,c(H+)降低D.将水加热,K W增大,pH不变答案:B解析:向水中通入少量氨气,生成一水合氨,一水合氨电离产生OH-,c(OH-)增大,A项错误。
向水中加入少量CH3COONa固体,CH3COO-与H+结合生成弱酸CH3COOH,c(H+)减小,平衡正向移动,C项错误。
将水加热,水的电离平衡正向移动,K W增大,pH减小,D项错误。
3.常温下,在0.01 mol·L-1硫酸中,水电离出的H+的浓度是()。
A.5×10-13 mol·L-1B.0.02 mol·L-1C.1×10-7 mol·L-1D.1×10-12 mol·L-1答案:A解析:溶液中的H+有两部分来源:水电离出来的H+和H2SO4电离出来的H+。
其中H2SO4电离出来的H+为c(H+)=0.01 mol·L-1×2=0.02 mol·L-1,受H2SO4的抑制,水电离出来的H+要小于10-7 mol·L-1,溶液中的H+几乎全部来自H2SO4,可以认为溶液中的H+的总浓度就是0.02 mol·L-1。
根据K W可计算出溶液中的c(OH-)=5×10-13 mol·L-1。
水电离出等量的H+和OH-,所以水电离出的H+的浓度也是5×10-13 mol·L-1。
第三章第二节第1课时一、选择题1.将纯水加热至较高温度,下列叙述中正确的是(D)A.水的离子积变大,呈酸性B.水的离子积不变,呈中性C.水的离子积变小,呈碱性D.水的离子积变大,呈中性解析:水的电离是吸热过程,将纯水加热至较高温度,促进了水的电离,c(H+)和c(OH -)都增大,水的离子积增大,但电离出的氢离子和氢氧根离子相等,所以仍呈中性,故选D。
2.水的电离过程为H2O H++OH-,在25 ℃时,水的离子积K w=1.0×10-14;在35 ℃时,水的离子积K w=2.1×10-14。
则下列叙述正确的是(D)A.c(H+)随着温度的升高而降低B.35 ℃时,c(H+)>c(OH-)C.35 ℃时的水比25 ℃时的水电离程度小D.水的电离是吸热过程解析:由题中条件可以看出,温度升高时K w增大。
25 ℃时,纯水中c(H+)=c(OH-)=1×10-7mol·L-1;35 ℃时,纯水中c(H+)=c(OH-)≈1.45×10-7mol·L-1。
温度升高,纯水中c(H+)和c(OH-)都增大,且始终相等,水的电离程度也增大,因温度升高平衡向正反应方向移动,故水的电离为吸热过程。
3.一定温度下,满足下列条件的溶液一定呈酸性的是(D)A.能与金属Al反应放出H2的溶液B.加酚酞后显无色的溶液C.pH=6.5的某溶液D.c(H+)>c(OH-)的任意水溶液解析:与Al反应放出H2的溶液可能是酸性溶液,也可能是碱性溶液,A项错误;加入酚酞后显无色的溶液可能呈中性或弱碱性或酸性,B项错误;pH=6.5的溶液也可能呈中性或碱性,C项错误。
4.关于pH的测定,下列说法正确的是(D)A.pH试纸在使用之前应用蒸馏水润湿B.用广泛pH试纸测得某盐酸的pH=2.3C.利用酸碱指示剂可以测溶液的pHD.pH计是精确测定溶液pH的仪器解析:pH试纸在使用之前不能用蒸馏水润湿,如果用蒸馏水润湿了,则会对所测溶液进行稀释,可能会造成误差,故A项说法错误;广泛pH试纸可以识别的pH差约为1,用广泛pH试纸测得的pH是整数,故B项错误;酸碱指示剂只能判断溶液的酸碱性,无法测其pH,故C项错误;pH计可以精确测定溶液的pH,故D项正确。