元素周期律{第一课时}
- 格式:ppt
- 大小:3.27 MB
- 文档页数:43

《元素周期律》第一课时教学设计讲授新课一、1~18号元素的特点1~18号元素的特点注:稀有气体元素的原子半径测定与相邻非金属元素的测定依据不同,数据不具有可比性,故不列出。
1~18号元素的特点1~18号元素的特点【设疑】观察下表,思考:随着原子序数递增,元了解同周期元素的原子半径大小及化合价,探索出规律。
素原子的核外电子排布、原子半径和化学价各呈现什么规律性变化?【设疑】观察下表,思考:随着原子序数递增,元素原子的核外电子排布、原子半径和化学价各呈现什么规律性变化?随着原子序数的递增,元素原子的核外电子排布、原子半径和化合价都呈现周期性变化。
核外电子层数相同,原子半径逐渐变小,化合价逐渐升高。
当K层为最外层时,最多能容纳2个电子数除了K层,其他各层为最外层时,多能容纳8个电子数。
【设疑】元素的金属性和非金属性是否也随着原子序数的递增而呈现周期性变化?第三周期元素性质的递变取一小段镁条,用砂纸除去表面的氧化膜,放到试管中。
向试管中加入2mL水,并滴入2滴酚酞溶液,观察现象。
观察表格,思考问题。
总结规律无明显现象。
因为镁和冷水不反应。
过一会儿,加热试管至液体沸腾,观察现象。
与钠和水的反应相比,镁和水的反应难易程度如何?生成了什么物质?有气体产生,溶液变成红色反应式:Mg + 2H2O ——Mg(OH)2 + H2↑钠的金属性要比镁大得多,所以与水反应钠比镁要剧烈得多。
所谓金属性就元素的原子失去电子的能力。
元素的金属性越强,越容易失电子被氧化。
第三周期元素性质的递变向试管中加入2mL 1mol/L AlCl3溶液,然后滴加氨水,直到不再产生白色絮状Al(OH)3沉淀为止。
将沉淀分装在两只试管中,向一支试管中滴加2mol 盐酸,向另一只试管中滴加2mol/LNaOH溶液。
边滴加边振荡,观察现象。
Al(OH)3在酸或强碱溶液中都能溶解,表明它既能与酸发生反应,又能与强碱溶液发生反应。
反应的离子方程式分别如下:Al(OH)3 + 3H+——Al3+ + 3H2OAl(OH)3 + OH-——AlO-2 + 2H2O金属元素的氢氧化物钠、镁、铝是金属元素,都能形成氢氧化物。

云课堂核心理念:整合资源教自主合作学教师点拨导当堂分层练云课堂导学案....据此设计配套课件正 价 最 低负 价结论2:随着原子序数的递增,元素 也呈现周期性变化。
[深入探究](1)分析原子序数为11~17的非金属元素的最高正化合价和最低负化合价的变化规律得出二者的关系________________________________________________(2)原子序数为11~17的主族元素的最高正化合价和最低负化合价的数值与原子最外层电子数的关系是_________ 3原子半径的周期性变化规律:同一周期元素,随着原子序数的递增,元素原子半径逐渐 (___________外)。
结论3同一周期元素,随着原子序数的递增,元素____________________呈现周期性变化 归纳::随着______________的递增,元素原子的 ____ 、 _______ 、 ________________都呈现周期性变化。
元素符号 H He 原子半径nm 0.037 ─ 元素符号 LiBeBC NOFNe原子半径nm 0.152 0.089 0.082 0.077 0.075 0.074 0.071 ─ 元素符号 NaMgAlSiPSClAr原子半径nm0.186 0.160 0.143 0. 117 0.110 0.102 0.099 ─四、小结:本节课主要内容(重点展示): 同周期元素性质递变规律D 、堂清训练卷(分ABC 三个等级,时值约15分钟)基础巩固(A )1下列微粒结构示意图表示的各是什么微粒?A B C D能力提升(B)2.下列递变情况中不正确的是()A.钠、镁、铝原子的最外层电子数依次增多B.硅、磷、硫、氯元素的最高正化合价依次升高C.碳、氮、氧、氟的原子半径依次增大D.锂、钠、钾、铷的电子层数依次增多思维拓展(C)3.某元素原子核外有3个电子层,该元素最高正化合价与最低负化合价绝对值相等,则这种元素的名称是,元素符号为,最高价氧化物的化学式为,气态氢化物的化学式为。


元素周期律(第一课时)教案一、教学目标本课时的教学目标是让学生了解元素周期律的基本思想和周期表的组成,掌握元素周期律的基本规律,同时也能够了解元素周期律的历史背景和发展过程。
二、教学重点和难点1. 教学重点:元素周期律的基本思想和周期表的组成,元素周期律的基本规律。
2. 教学难点:周期表对元素性质的预测和周期律的历史背景。
三、教学过程【导入】1. 通过图片展示和简单的活动,学生们了解有哪些元素以及它们分别的性质,引发学生们对于元素性质变化的思考,为引入元素周期律做铺垫。
2. 色码表的制作,让学生自行收集不同颜色的小球,为下一环节的分类打下基础。
【展开】1. 通过对于普朗克、门捷列夫、柯西和门德里夫提出的元素周期律做简单的介绍,引导学生理解周期律的基本思想和周期表的组成。
2. 解释周期表中元素的排列方式,回顾周期表中元素分类的基本方式和命名规律,让学生们掌握元素周期律的基本规律。
3. 进一步讲解元素周期律中元素性质的预测,让学生了解周期表的应用和实用价值。
4. 分组或自由活动,让学生们通过分析周期表中元素性质的变化以及不同元素之间的联系,探究元素周期律的更深层次的规律。
同时以简单易懂的例子,帮助学生理解元素周期规律。
【总结】1. 回顾教学目标,帮助学生梳理课程内容,巩固所学的知识和技能。
2. 对元素周期律在实际应用中的重要性做简单介绍。
四、教学反思在本课程的教学中,我重点强调了元素周期律的基本规律以及周期表的组成,同时也帮助学生理解了元素性质的预测和周期律的历史背景。
通过让学生进行分类活动和探究活动,培养了学生的合作能力和思考能力,并且让学生深入理解了元素周期律所涉及的知识点。
在未来的教学中,我会更注重教学重难点与生活联系的整合以及教学形式的多样化,保障学生更好的学习效果。
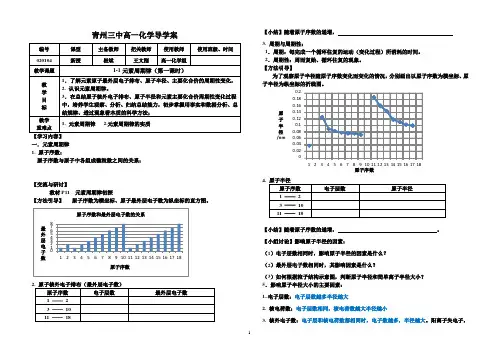
青州三中高一化学导学案编号 课型 主备教师 把关教师 使用教师 使用班级、时间020104 新授崔斌王文刚高一化学组教学课题 1-1元素周期律(第一课时)教 学 目 标 1.了解元素原子最外层电子排布、原子半径、主要化合价的周期性变化,2. 认识元素周期律。
3.在总结原子核外电子排布、原子半径和元素主要化合价周期性变化过程中,培养学生观察、分析、归纳总结能力,初步掌握用事实和数据分析、总结规律、透过现象看本质的科学方法; 教学 重难点1. 元素周期律2.元素周期律的实质【学习内容】 一.元素周期律 1. 原子序数:原子序数与原子中各组成微粒数之间的关系:【交流与研讨】教材P11 元素周期律初探【方法引导】 原子序数为横坐标、原子最外层电子数为纵坐标的直方图。
12345678123456789101112131415161718最外层电子数原子序数原子序数和最外层电子数的关系2. 原子核外电子排布(最外层电子数)原子序数 电子层数最外层电子数1 ——23 —— 10 11 —— 18【小结】随着原子序数的递增, 3. 周期与周期性:1.周期:每完成一个循环往复的运动(变化过程)所消耗的时间。
2.周期性:周而复始、循环往复的现象。
【方法引导】为了观察原子半径随原子序数变化而变化的情况,分别画出以原子序数为横坐标、原子半径为纵坐标的折线图。
4. 原子半径原子序数 电子层数原子半径1 ——23 —— 10 11 —— 18【小结】随着原子序数的递增, 。
【小组讨论】影响原子半径的因素:(1)电子层数相同时,影响原子半径的因素是什么? (2)最外层电子数相同时,其影响因素是什么?(3)如何根据粒子结构示意图,判断原子半径和简单离子半径大小?5.影响原子半径大小的主要因素: 1..电子层数:电子层数越多半径越大2. 核电荷数:电子层数相同,核电荷数越大半径越小3. 核外电子数:电子层和核电荷数都相同时,电子数越多,半径越大。



元素周期律第一课时第一课时教学目标:知识目标:使学生了解元素原子核外电子排布,原子半径,主要化合价与元素金属性、非金属性的周期性变化。
能力目标:通过对元素周期律的了解、掌握和应用,培养学生总结归纳及逻辑推理能力。
情感目标:使学生了解辩证唯物主义理论联系实际的观点,量变、质变的观点。
教学重点:原子的核外电子层排布,微粒半径变化规律。
教学过程:引入:前面我们学习过卤素和碱金属元素。
意识到元素之间存在着某种联系,现在我们就一起揭示其内在的联系,探究这种联系的本质。
我们按核电荷数由小到大的顺序给元素编号,这种编号,叫做原子序数。
显然核电荷数=原子序数。
教师提出要求:画出1~18号元素原子结构示意图,然后从核外电子排布、原子半径、元素主要化合价几个方面进行讨论,寻找是否体现一定的规律性,若有规律是什么?学生活动:画出1~18号元素原子结构示意图,然后讨论。
学生发表自己的见解,填写表格表1原子序数电子层数最外层电子数达到稳定结构时的最外层电子数1~211 223~102~结论:随着原子序数的递增,元素原子的最外层电子排布呈现周期性变化。
表2原子序数原子半径的变化3~10逐渐减小11~17逐渐减小结论:随着原子序数的递增,元素原子半径呈现周期性变化。
表3原子序数化合价的变化1~2+1 03~10+1 +511~18-4 -1 0结论:随着原子序数的递增,元素化合价呈现周期性变化。
教师评价并播放元素周期律的动画练习:1.比较微粒间半径的大小(1)Na、Mg、Al、Si、P、S、Cl(2)Na与Na;Cl与Cl(3)Na、Ca、H引导学生总结出比较微粒半径的方法:一看电子层数,二看核电荷数,三看电子数。
2.列出具有10电子和18电子的微粒。
小结:随着原子序数的递增,元素原子的电子层排布,原子半径和化合价均呈现周期性变化。
板书设计:第二节元素周期律一、元素性质的周期性变化1.原子的电子层排布的周期性2.原子半径的周期性3.化合价的周期性小结:微粒比较微粒半径的方法:一看电子层数,二看核电荷数,三看电子数。

