第二篇 材料结构第4章金属键和金属晶体
- 格式:ppt
- 大小:1.50 MB
- 文档页数:61



第二章材料的结构(含答案)一、填空题(在空白处填上正确的内容)1、内部原子按一定规律排列的物质叫________。
答案:晶体2、金属晶体在不同方向上具有不同性能的现象叫________。
答案:各向异性3、常见的金属晶格类型有________、________、________三种。
答案:体心立方、面心立方、密排六方4、常见的金属晶格类型有三种,α-Fe、Cr、W、Mo、V的晶格属于________。
答案:体心立方5、表示晶体中原子排列的空间格子叫做________,组成空间格子的最基本的几何单元叫做________。
答案:晶格、晶胞6、实际金属结构中的点缺陷包括________、________和________;它们可使金属的强度________。
答案:间隙原子、置换原子、空位、提高7、工程材料的结合键有________、________、________和________四种。
答案:离子键、共价键、金属键、分子键8、三种常见金属晶格类型为________、________和________。
答案:体心立方晶格、面心立方晶格、密排六方晶格;9、按溶质原子在溶剂晶格中所处的位置不同,固溶体可分为________和________两种。
答案:置换固溶体、间隙固溶体10、面心立方晶格中,晶胞的原子数为________,致密度为________。
答案:4、0.7411、位错分为两种,它们是________和________;多余半排原子面的是________位错。
答案:刃型位错、螺型位错、刃型位错12、相是指金属或合金中成分________,结构________,并由________与其它部分分开的均匀组成部分。
答案:相同、相同、界面13、合金中成分、结构和性能相同的组成部分称为________。
答案:相14、按其几何形式的特点,晶格缺陷可分为________、________和________。
答案:点缺陷、线缺陷、面缺陷15、体心立方晶格中,晶胞的原子数为________,原子半径与晶格常数的关系为________,致密度为________。

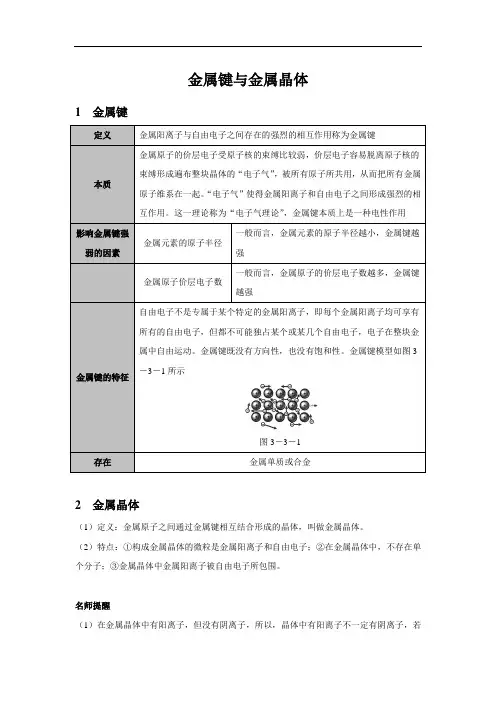
金属键与金属晶体1 金属键定义金属阳离子与自由电子之间存在的强烈的相互作用称为金属键本质金属原子的价层电子受原子核的束缚比较弱,价层电子容易脱离原子核的束缚形成遍布整块晶体的“电子气”,被所有原子所共用,从而把所有金属原子维系在一起。
“电子气”使得金属阳离子和自由电子之间形成强烈的相互作用。
这一理论称为“电子气理论”,金属键本质上是一种电性作用影响金属键强弱的因素金属元素的原子半径一般而言,金属元素的原子半径越小,金属键越强金属原子价层电子数一般而言,金属原子的价层电子数越多,金属键越强金属键的特征自由电子不是专属于某个特定的金属阳离子,即每个金属阳离子均可享有所有的自由电子,但都不可能独占某个或某几个自由电子,电子在整块金属中自由运动。
金属键既没有方向性,也没有饱和性。
金属键模型如图3-3-1所示图3-3-1存在金属单质或合金2 金属晶体(1)定义:金属原子之间通过金属键相互结合形成的晶体,叫做金属晶体。
(2)特点:①构成金属晶体的微粒是金属阳离子和自由电子;②在金属晶体中,不存在单个分子;③金属晶体中金属阳离子被自由电子所包围。
名师提醒(1)在金属晶体中有阳离子,但没有阴离子,所以,晶体中有阳离子不一定有阴离子,若有阴离子,则一定有阳离子。
(2)金属单质或合金的晶体(晶体锗、灰锡除外)属于金属晶体。
(3)金属晶体与共价晶体一样,是一种“巨分子”。
3 电子气理论解释金属材料的有关性质物理性质电子气理论解释延展性当金属受到外力作用时,晶体中的各原子层就会发生相对滑动,但不会改变原来的排列方式,而且弥漫在金属原子间的电子气可以起到类似轴承中滚珠之间润滑剂的作用,所以在各原子层之间发生相对滑动以后,仍可以保持这种相互作用,因而即使在外力作用下,金属发生形变也不易断裂。
因此,金属有良好的延展性。
如图3-3-2所示:图3-3-2导电性在金属晶体中,自由电子的移动是没有方向的,但是在外加电场的作用下,自由电子就会发生定向移动,因而形成电流,所以金属容易导电。



专题3微粒间作用力与物理性质第一单元金属键金属晶体[教学目标]1.了解金属晶体模型和金属键的本质2.认识金属键与金属物理性质的辨证关系3.能正确分析金属键的强弱4.结合问题讨论并深化金属的物理性质的共性5.认识合金及其广泛应用[课时安排] 3课时第一课时[学习内容]金属键的概念及金属的物理性质【引入】同学们我们的世界是五彩缤纷的,是什么组成了我们的世界呢?学生回答:物质讲述:对!我们的自然世界是有物质组成的,翻开我们的化学课本的最后一页我们可以看到一张化学元素周期表,不论冬天美丽的雪花,公路上漂亮的汽车。
包括你自己的身体都是有这些元素的一种或几种构成的。
那么我们现在就来认识一下占周期表中大多数的金属。
【板书】§3-1-1 金属键与金属特性大家都知道晶体有固定的几何外形、有确定的熔点,水、干冰等都属于分子晶体,靠范德华力结合在一起,金刚石、金刚砂等都是原子晶体,靠共价键相互结合,那么我们所熟悉的铁、铝等金属是不是晶体呢?它们又是靠什么作用结合在一起的呢?【展示】几种金属的应用的图片,有金属导线(铜或铝)、铁丝、镀铜金属片等,并将铁丝随意弯曲,引导观察铜的金属光泽。
叙述应用部分包括电工架设金属高压电线,家用铁锅炒菜,锻压机把钢锭压成钢板等。
【讨论】请一位同学归纳,其他同学补充。
1、金属有哪些物理共性?2、金属原子的外层电子结构、原子半径和电离能?金属单质中金属原子之间怎样结合的?【板书】一、金属共同的物理性质容易导电、导热、有延展性、有金属光泽等。
二、金属键【动画演示并讲解】金属原子的电离能低,容易失去电子而形成阳离子和自由电子,阳离子整体共同整体吸引自由电子而结合在一起。
这种金属离子与自由电子之间的较强作用就叫做金属键。
金属晶体的组成粒子:金属阳离子和自由电子。
金属离子通过吸引自由电子联系在一起, 形成金属晶体.经典的金属键理论把金属键形象地描绘成从金属原子上“脱落”下来的大量自由电子,金属原子则“浸泡”在“自由电子”的“海洋”之中。

