分子间力氢键
- 格式:ppt
- 大小:3.87 MB
- 文档页数:50

分子内氢键与分子间氢键分子内氢键和分子间氢键是化学中两个重要的概念,它们在分子结构和性质上起着至关重要的作用。
本文将分别对这两个概念进行介绍和分析。
一、分子内氢键分子内氢键是指分子内部形成的氢键。
氢键是一种静电作用力,通常发生在含有氢原子的分子中,其中氢原子与较电负性的原子(如氧、氮、氟)形成的键。
氢键的形成与原子之间的电子云的相互作用有关。
分子内氢键在分子结构上起着至关重要的作用。
它可以影响分子的构象、稳定性和化学性质。
例如,DNA的双螺旋结构就是由分子内氢键所稳定的。
分子内氢键还可以影响分子的物理性质,如沸点、溶解度等。
因此,研究分子内氢键对于理解分子结构和性质具有重要意义。
二、分子间氢键分子间氢键是指分子之间形成的氢键。
分子间氢键是分子间相互作用的一种重要形式。
与分子内氢键不同,分子间氢键是在分子之间形成的。
它可以影响分子的聚集态和物理性质。
分子间氢键在许多领域中都具有重要的应用价值。
例如,在药物设计中,分子间氢键可以影响药物的溶解度和生物活性。
在材料科学中,分子间氢键可以影响材料的结晶性质和力学性能。
因此,研究分子间氢键对于合理设计和优化材料性能具有重要意义。
分子内氢键和分子间氢键在分子结构和性质上起着重要作用。
分子内氢键影响分子的构象和稳定性,而分子间氢键影响分子的聚集态和物理性质。
研究这两个概念对于理解分子的行为和性质具有重要意义,也有助于开发新的材料和药物。
希望通过本文的介绍,读者能对分子内氢键和分子间氢键有更深入的了解,并能进一步探索这两个概念在化学和材料科学中的应用。

化学键分子间作用力氢键化学键指的是分子内原子之间的相互作用力,而分子间作用力则是指不同分子之间的相互作用。
分子间作用力一般分为三种类型:范德华力、电子偶极相互作用力和氢键。
其中氢键是分子间作用力中最为强大、常见和重要的一种。
氢键是指氢原子与较电负的原子发生作用力的一种静电相互作用力。
可以说,氢键是生命之源和物质世界的基础。
一、氢键的定义氢键是指氢原子与较电负的原子(如氮、氧和氟)上的孤对电子或π电子的相互作用力。
通俗的说,就是一个分子中的氢原子与另一个分子中的氧、氮、氟等原子之间的作用力,在分子中扮演着重要的角色。
氢键是一种独特的静电相互作用力,发生在分子之间,不同于共价键和离子键。
二、氢键的形成原理氢键的形成是因为氢原子与氧、氮、氟等元素的电负性相差较大,氢原子中心的正电荷和氧、氮、氟原子上的负电子相吸引,导致氢、氮、氧、氟之间发生静电相互作用力。
在氢键中,氢原子所带的正电性与氮、氧和氟原子上带有的负电性相互吸引形成一个小的电偶极。
因此,可以说氢键是氢与氧、氮、氟等元素之间的一种电子偶极相互作用力。
三、氢键的种类氢键根据成键方向可以分为线性氢键和非线性氢键。
线性氢键的配置形成氢键的方向是一条直线,而非线性氢键的配置则是对称的,可以是任意角度。
1. 线性氢键线性氢键是氢原子与较电负的原子上孤对电子或π电子成键的一种形态。
线性氢键通常是由两个分子之间相互作用所形成,成键的方向是成一条直线。
线性氢键除了O–H…O型的氢键外还有N–H…O型的,两者基本相同,只是其中的H原子的反应物不同。
2. 非线性氢键非线性氢键是指氢键的成键方向并不是线性,而是是不对称的。
除了H-O-H型氢键以外,有OH…π,NH…π和CH…O等类型的非线性氢键。
四、氢键在生物体系中的作用氢键在生物体系中发挥着多种多样的作用。
例如在DNA 的双螺旋结构中,两个串联的DNA链之间的成键就是O-H…O 型的氢键;在蛋白质的三维结构中,氢键是蛋白质分子内的一种重要的成键方式,涉及到蛋白质的稳定、折叠和功能性;在蛋白质与DNA相互作用后形成的复合物中,氢键也是重要的成键方式之一。

分子间力与氢键的形成与特性引言:分子间力是指分子之间的相互作用力,它对于物质的性质和行为起着重要的影响。
其中,氢键作为一种特殊的分子间力,在化学和生物学领域中扮演着至关重要的角色。
本文将探讨分子间力的基本概念、氢键的形成与特性,并探讨其在化学和生物学中的应用。
一、分子间力的基本概念分子间力是指分子之间的相互作用力,它可以分为两种类型:吸引力和排斥力。
吸引力包括范德华力、静电引力和氢键等,而排斥力则由分子之间的电子云重叠引起。
这些力的作用决定了物质的相态、溶解度和化学反应速率等性质。
二、氢键的形成与特性氢键是一种特殊的分子间力,它是由氢原子与较电负的原子(如氧、氮和氟)之间的相互作用形成的。
氢键的形成需要满足三个条件:氢原子与较电负原子的共价键连接、氢原子与另一个较电负原子之间的静电引力以及分子间的适当排列。
氢键通常比范德华力要强,但比共价键要弱。
氢键具有以下特性:1. 强度和方向性:氢键通常比范德华力要强,但比共价键要弱。
它的强度与氢键中的氢原子和较电负原子之间的距离有关。
此外,氢键是有方向性的,即氢原子与较电负原子之间的键是直线状的。
2. 形成与断裂动力学:氢键的形成和断裂速率较快,这使得分子在氢键的存在下可以进行快速的结构变化和反应。
3. 影响物质性质:氢键对物质的性质和行为起着重要的影响。
例如,氢键可以影响物质的沸点、溶解度和晶体结构等。
三、氢键在化学中的应用氢键在化学中有广泛的应用,以下是其中几个方面的例子:1. 溶剂效应:溶剂中的氢键可以影响化学反应的速率和平衡。
例如,在水溶液中,氢键可以促进离子的溶解和反应。
2. 分子识别:氢键可以用于分子识别和分离。
例如,通过氢键的形成,可以选择性地将某些分子从混合物中分离出来。
3. 催化反应:氢键可以在催化反应中起到重要的作用。
例如,许多酶催化的生物反应中,氢键可以稳定过渡态和中间体,从而促进反应的进行。
四、氢键在生物学中的应用氢键在生物学中也有重要的应用,以下是其中几个方面的例子:1. 蛋白质结构:氢键在蛋白质的二级结构(如α-螺旋和β-折叠)中起到关键的稳定作用。

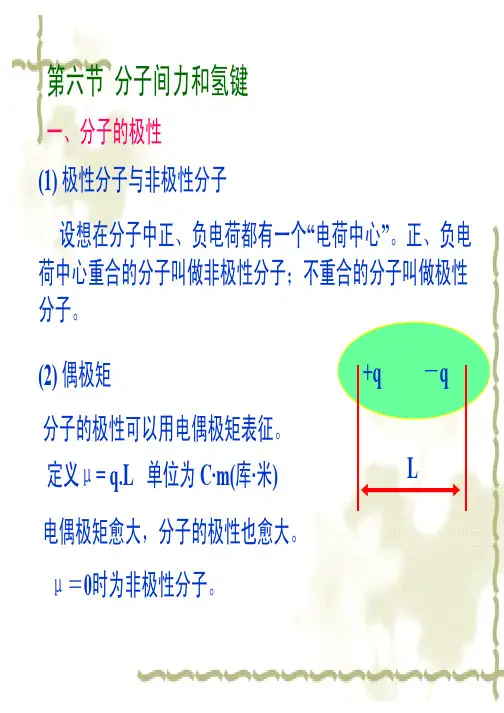
(1)极分子与极分子在分子中、负一个“中心”。
正、负中心合的分子叫做极分子;合的分子叫做极分子。
(2) 偶极分子的极可以偶极征。
+q -qL 定义μ= q.L 单位为C·m(库·)偶极愈大,分子的极也愈大。
μ=0时为极分子。
一、分子的极六分子力和氢(3) 分子的极与的极的关双原子分子分子的极与的极一。
三原子以上的分子分子的极,仅与的极关,与分子的构型关。
的极极:同原子形成的化学极:原子形成的化学双原子分子:H2Cl2—极分子,HCl,CO—极分子多原子分子: CH4, BF3, BeCl2, S8 ——极分子NH3, H2O, CH3Cl ——极分子,(1) 固偶极——极分子的中心叠二、分子力(2) 导偶极——外场作下,分子的中心发生对位产生的偶极。
电场撤去,导偶极消失。
极分子、非极分子在外加场的作下产生导偶极1.分子的偶极偶极子是指大小,号反,彼为d 的两个(+q,-q)所成的(2) 时偶极——分子中原子的子和核的对动会使分子的中心发生时的对位产生时偶极.何分子产生时偶极,时偶极存在时极,却反复发生。
2. 分子力的⑴取向力极分子中永久偶极的互作力。
极分子的取向力意图-+-++--+⑵诱导力导偶极与永久偶极的作力。
⑶色散力偶极的作力。
对大多数分子来,散力是主的(水外)。
±+-+-+-注意1.极分子与极分子 取向力、诱导力、色散力2.极分子与极分子 导力、色散力3.极分子与极分子 散力3.分子力的特征①是弱作力。
比化学小1-2个数。
O中,分子力47.28kJ.mol-1如H2E(OH)=463kJ.mol-1②是力。
在300pm-500pm效,且与r7成反比。
③无方向和和。
分子的极同,三力的比例也同,但散力是主的,存在于一切分子之。
其强度与分子的大小关,分子的增大增大。
4..氏力对物物理的影响构似的同列物(如卤、稀气体),分子大,偶极,分子作力强,物的熔沸;分子或,体大的变形大,熔沸。

分子间氢键原理
分子间氢键原理
分子间氢键是一种分子间的相互作用力,它是由于氢原子与较电负的原子(如氧、氮、氟等)形成的电荷分布不均而产生的。
这种相互作用力在生物化学、有机化学、物理化学等领域中都有广泛的应用。
氢键的形成原理是基于分子间的电荷分布不均。
在分子中,氢原子的电子云密度较小,而氧、氮、氟等原子的电子云密度较大。
当这些原子之间距离较近时,氢原子的电子云会被邻近原子的电子云所吸引,从而形成一个电荷分布不均的局部区域。
这个局部区域被称为氢键供体。
另一方面,邻近原子的电子云也会被氢原子的电子云所吸引,形成一个电荷分布不均的局部区域,被称为氢键受体。
当氢键供体和氢键受体之间的距离适当时,它们之间会形成一个弱的相互作用力,即氢键。
氢键的强度较弱,通常只有分子间的范德华力的1/10到1/3。
但是,氢键在分子的结构和性质中起着至关重要的作用。
例如,在蛋白质的空间结构中,氢键是维持蛋白质的稳定性和功能性的重要因素。
在DNA分子中,氢键是维持DNA双螺旋结构的重要因素。
在有机化学中,氢键是分子间反应的重要催化剂。
总之,氢键是一种重要的分子间相互作用力,它在生物化学、有机化学、物理化学等领域中都有广泛的应用。
了解氢键的形成原理和特性,对于理解分子的结构和性质,以及分子间相互作用的机理具有重要的
意义。


分子间形成氢键的条件和原因一、氢键的概念和特点1. 氢键是一种非共价的相互作用力,通常出现在分子间。
2. 在氢键中,氢原子与高电负性的原子(如氧、氮或氟)形成相互作用,通常以H...X的方式表示,其中X代表较高电负性的原子。
3. 氢键能够影响分子之间的结构、性质和反应,具有重要的生物学、化学和材料学意义。
二、形成氢键的条件1. 构成氢键的原子必须具有较高的电负性,如氧、氮或氟等元素。
2. 氢原子与高电负性原子形成氢键时,氢原子的正电荷与原子间的电子对产生吸引力,使得氢键形成。
3. 氢键的形成需要一定的几何构型条件,通常要求氢原子、接受氢键的原子和共价键中的原子在同一平面上。
三、氢键形成的原因1. 电负性差异:氢键形成的基本条件是原子间的电负性差异,如氢与氧、氮、氟等高电负性元素之间的相互作用。
2. 构型效应:氢键的形成还受到分子构型的影响,通常要求形成氢键的原子处于一定的构型条件下。
3. 距离效应:氢键的形成受到原子间距离的影响,通常要求形成氢键的原子之间的距离在一定的范围之内。
4. 分子间的相互作用力:除了氢键,分子之间的范德华力、静电作用等相互作用力也可能影响氢键的形成。
四、氢键的应用和意义1. 生物学中的应用:生物分子(如蛋白质、DNA)的结构和功能受到氢键的影响,深入研究氢键有助于理解生物分子的结构和活性。
2. 化学反应中的影响:在化学反应中,氢键的存在和破坏可能影响反应的进行和速率,对于理解和控制化学反应具有重要意义。
3. 材料学中的作用:在材料的设计和合成过程中,氢键的形成常常影响材料的结构和性质,有助于开发具有特定功能的新材料。
通过对分子间形成氢键的条件和原因进行系统的研究和理解,不仅有助于深入理解分子间相互作用的基本机制,也为相关领域的研究和应用提供了重要的理论基础。
希望未来能够深入探索氢键在生物学、化学和材料学等领域中的更广泛应用,推动相关领域的发展和创新。
五、氢键在生物学中的应用1. 蛋白质结构中的氢键:蛋白质是生物体内最重要的功能分子之一,在蛋白质的二级、三级结构中,氢键起到了至关重要的作用。



高中化学:分子间作用力和氢键知识点[知识详解]一.分子间作用力1.定义:分子间存在着将分子聚集在一起的作用力,称分子间作用力。
分子间作用力也叫范德华力.2.实质:一种电性的吸引力.3.影响因素:分子间作用力随着分子极性.相对分子质量的增大而增大.分子间作用力的大小对物质的熔点.沸点和溶解度都有影响.一般来说.对于组成和结构相似的物质来说,相对分子质量越大,分子间作用力越强,物质的熔沸点也越高.4.只存在于由共价键形成的多数化合物,绝大多数非金属单质分子和分子之间. 化学键是分子中原子和原子之间的一种强烈的作用力,它是决定物质化学性质的主要因素。
但对处于一定聚集状态的物质而言,单凭化学键,还不足以说明它的整体性质,分子和分子之间还存在较弱的作用力。
物质熔化或汽化要克服分子间的作用力,气体凝结成液体和固体也是靠这种作用力。
除此以外,分子间的作用力还是影响物质的汽化热、熔化热、溶解黏度等物理性质的主要因素。
分子间的作用力包括分子间作用力(俗称范德华力)和氢键(一种特殊的分子间作用力)。
分子间作用力约为十几至几十千焦,比化学键小得多。
分子间作用力包括三个部分:取向力、诱导力和色散力。
其中色散力随分子间的距离增大而急剧减小一般说来,组成和结构相似的物质,分子量越大,分子间距越大,分子间作用力减小,物质熔化或汽化所克服的分子间作用力减小,所以物质的溶沸点升高温度止200 150 100, 50 0 -50 -100 -150 -200熔温度尺200 150叫0 -50 -100 -150 -200熔叫相对分子质■筑卤化碳的熔.沸点与相对分子质量的关系化学键与分子间作用力比较化学键分子间作用力概念 相邻的原子间强烈的相互作用 物质分子间存在的微弱的相互作用能量 较大很弱性质影响主要影响物质的化学性质主要影响物质的物理性质.氢键一特殊的分子间作用力1.概念:氢键是指与非金属性很强的元素(主要指N 、O 、F )相结合的氢原子与另一个分子中非金属性极强的原子间所产生的引力而形成的.必须是含氢 化合物,否则就谈不上氢键。
分子间力和氢键的区别
分子间力指的是分子的永久偶极和瞬间偶极引起的弱静电相互作用,包括范德华力、盐键、疏水作用力、芳环堆积作用、卤键等。
而氢键则是一种特殊的分子间作用力,是活泼的非金属原子与氢原子之间形成的强极性键(A-H)上的氢核,与电负性很大的、含孤电子对并带有部分负电荷的原子B之间的静电引力。
氢键的本质是强极性键上的氢核与电负性很大的、原子半径较小且带有未共享电子对的原子(如O、N、F等)之间的静电引力。
这种力一般在
40kJ/mol以下,比一般的键能小得多。
因此,分子间力和氢键在定义和性质上存在明显的差异。
如需了解更多关于分子间力和氢键的区别,建议查阅化学专业书籍或咨询化学专家。
分子内氢键和分子间氢键对电离
氢键是一种分子间相互作用力,它在化学和生物学中起着至关重要的作用。
氢键可以分为分子内氢键和分子间氢键,它们对分子的电离过程有着重要的影响。
首先,让我们来了解一下分子内氢键和分子间氢键的概念。
分子内氢键是指同一分子内部的氢键作用,通常是由一个分子内的氢原子与该分子内的电负性较强的原子(如氧、氮或氟)形成氢键。
而分子间氢键则是指不同分子之间的氢键作用,通常是由一个分子内的氢原子与另一个分子内的电负性较强的原子形成氢键。
分子内氢键和分子间氢键对分子的电离过程有着不同的影响。
在分子内氢键作用下,分子内的氢键结构会影响分子内部的电子分布,从而影响到分子的电离性。
分子内氢键可以增强或减弱分子的电离性,具体取决于氢键的强度和位置。
另一方面,分子间氢键也会对分子的电离性产生影响。
分子间氢键可以影响分子的空间结构和分子之间的相互作用,从而影响到分子的电离过程。
分子间氢键的形成会改变分子的极性和稳定性,进而影响到分子的电离性。
总的来说,分子内氢键和分子间氢键对分子的电离过程都有着重要的影响。
它们可以通过调控分子的结构和相互作用来影响分子的电离性,进而影响到化学反应和生物过程。
因此,深入理解分子内氢键和分子间氢键对电离的影响机制,对于理解化学和生物学中的许多重要现象具有重要意义。