第四章 分子结构——分子间的作用力、氢键、离子极化理论汇总
- 格式:ppt
- 大小:1.81 MB
- 文档页数:31


分子结构
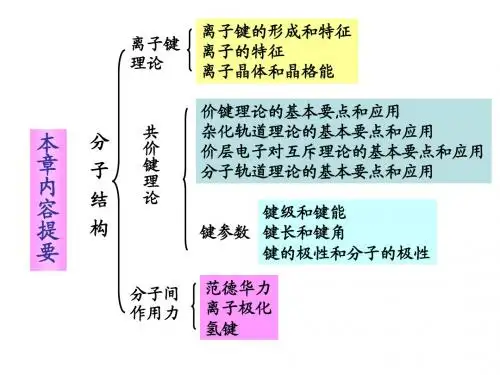
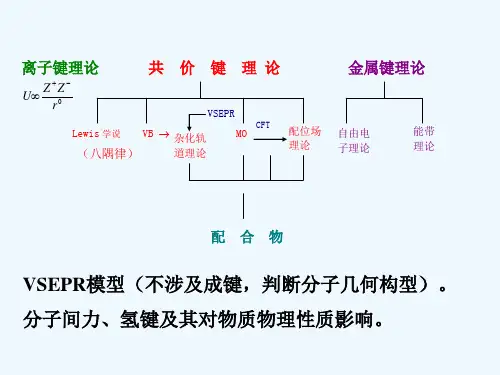
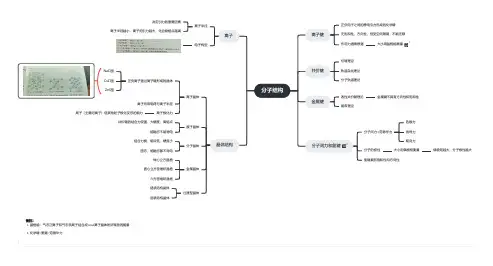
离子键
正负电子之间的静电引力形成的化学键
无饱和性、方向性,但受空间限制,不能无限作用力通常很强
1
大小用晶格能衡量
离子
离子半径
决定引力的重要因素
离子半径越小,离子间引力越大,化合物熔点越高
电子构型
共价键
价键理论
轨道杂化理论分子轨道理论
金属键
改性共价键理论金属键不具有方向性和饱和性
能带理论
2
分子间力和氢键
分子间力=范德华力
色散力
诱导力取向力
分子的极性
大小用偶极矩衡量
偶极矩越大,分子极性越大
氢键具有饱和性和方向性
晶体结构
离子晶体
正负离子通过离子键形成的晶体
NaCl型CsCl型ZnS型
离子所带电荷与离子半径
离子极化力
离子(主要阳离子)使其他粒子极化变形的能力
原子晶体
共价键的结合力较强,大硬度,高熔点
熔融态不易导电
分子晶体
结合力弱,熔点低,硬度小
固态、熔融态都不导电
金属晶体
体心立方晶格面心立方密堆积晶格
六方密堆积晶格过渡型晶体
链状结构晶体
层状结构晶体
备注:
1. 晶格能:气态正离子和气态负离子结合成1mol 离子晶体时所释放的能量
2. 化学键>氢键>范德华力。

分子间作用力包括静电、氢键、离子偶极
分子间作用力是指分子之间的相互作用力,它们是维持分子结构和化学反应的基础。
分子间作用力包括静电、氢键、离子偶极等多种类型,下面我们将分别介绍它们的特点和作用。
静电作用力是指由于电荷之间的相互作用而产生的力。
当两个分子中的电荷不平衡时,它们之间就会产生静电作用力。
例如,当两个分子中一个带正电荷,一个带负电荷时,它们之间就会产生吸引力。
静电作用力在分子间的相互作用中起着重要的作用,它可以影响分子的构象和化学反应。
氢键是一种特殊的分子间作用力,它是由于氢原子与氮、氧、氟等元素形成的强电负性差而产生的。
氢键的作用力比静电作用力弱,但是它在生物分子的结构和功能中起着重要的作用。
例如,DNA分子中的氢键可以保持DNA的双螺旋结构,从而维持DNA的稳定性。
离子偶极是指分子中存在正负电荷分布不均的情况。
当分子中的正负电荷分布不均时,就会形成离子偶极。
离子偶极的作用力比静电作用力弱,但是它在分子间的相互作用中也起着重要的作用。
例如,当两个分子中一个带正电荷,一个带负电荷时,它们之间就会产生离子偶极作用力。
分子间作用力是维持分子结构和化学反应的基础,它们包括静电、氢键、离子偶极等多种类型。
这些作用力在分子间的相互作用中起
着重要的作用,它们可以影响分子的构象和化学反应,从而影响生物分子的结构和功能。
因此,研究分子间作用力对于理解生物分子的结构和功能具有重要的意义。




高考化学分子结构知识点总结在高考化学中,分子结构是一个重要的知识点,理解分子结构对于掌握化学物质的性质、反应等方面具有关键作用。
接下来,让我们一起深入了解一下这部分内容。
一、化学键化学键是将原子结合成分子的一种作用力。
常见的化学键包括离子键、共价键和金属键。
1、离子键离子键通常存在于由活泼金属元素(如钠、钾)和活泼非金属元素(如氯、氟)组成的化合物中。
活泼金属原子容易失去电子形成阳离子,活泼非金属原子容易得到电子形成阴离子,阴阳离子通过静电作用形成离子键。
离子键的特点是无方向性和饱和性。
2、共价键共价键是原子之间通过共用电子对形成的化学键。
根据共用电子对是否偏移,共价键又分为极性共价键和非极性共价键。
(1)极性共价键:在不同原子之间形成,共用电子对偏向吸引电子能力强的原子,如氯化氢(HCl)中的 HCl 键。
(2)非极性共价键:在相同原子之间形成,共用电子对不发生偏移,例如氢气(H₂)中的 HH 键。
共价键具有方向性和饱和性。
其方向性使得原子间形成特定的空间取向,以达到最大程度的重叠,从而使分子具有一定的空间构型。
饱和性则决定了原子形成共价键的数量。
3、金属键金属键存在于金属单质或合金中,由金属阳离子和自由电子之间的强烈相互作用形成。
金属键决定了金属的物理性质,如导电性、导热性和延展性。
二、共价键的参数了解共价键的参数有助于我们更深入地理解分子的结构和性质。
1、键长指两个成键原子之间的核间距。
键长越短,键能越大,化学键越稳定。
2、键能指断开 1mol 共价键所吸收的能量或形成 1mol 共价键所释放的能量。
键能越大,化学键越稳定,物质的化学性质越稳定。
3、键角指分子中两个共价键之间的夹角。
键角决定了分子的空间构型。
三、分子的空间构型1、价层电子对互斥理论(VSEPR)该理论认为,分子的空间构型取决于中心原子周围的价层电子对的数目和相对位置。
价层电子对包括成键电子对和孤电子对。
(1)中心原子价层电子对数的计算中心原子价层电子对数=σ键电子对数+孤电子对数σ键电子对数=与中心原子结合的原子个数孤电子对数=(中心原子价电子数与中心原子结合的原子最多能接受的电子数 ×结合原子个数)÷ 2(2)常见分子的空间构型①直线形:中心原子价层电子对数为 2,如二氧化碳(CO₂),键角为 180°。
《分子间作用力》分子间作用力是指物质中的分子之间相互作用的力,其大小决定了物质的性质和现象。
分子间作用力包括范德华力、离子作用力、氢键、极性作用力等,它们是物质存在、相互作用和反应的基础。
不同种类的分子间作用力在化学、物理、生物等领域都起着重要的作用。
范德华力是物质中非极性分子之间的相互作用力。
范德华力是一种弱的作用力,但是它的作用范围广,几乎存在于各种物质中。
范德华力的产生是由于分子中的电子云的运动导致的。
电子云在分子内部不断运动,会使分子中的电荷分布不均匀。
由于电子云运动的随机性,瞬时产生了电偶极矩。
这时,瞬时的电偶极矩会引起周围分子的极化,并产生引力作用。
范德华力的大小与分子的极性、大小和形状有关。
如果分子比较大且形状对称,范德华力会更强。
离子作用力是带电粒子之间的作用力。
当物质中存在有正负符号的离子时,它们之间会通过电磁作用力相互吸引或排斥。
离子作用力的大小与离子的电荷和距离有关。
电荷越大,离子作用力越大;离子距离越近,离子作用力越强。
氢键是一种特殊的分子间作用力,它是带有氢原子的分子与带有电负性较强的原子(如氧、氮、氟)之间的作用力。
氢键的产生是由于氢原子与带有电负性的原子之间的较强电荷差引起的。
氢键的强度介于范德华力和共价键之间,相比于范德华力更强。
氢键在生物分子如DNA、蛋白质中起着重要的作用,能够稳定分子的结构。
极性作用力是由极性分子之间相互作用引起的作用力。
极性作用力的大小与分子间的电荷差有关,电荷差越大,极性作用力越大。
极性作用力可分为极性-极性作用力和极性-非极性作用力。
在极性-极性作用力中,两个极性分子之间形成氢键或其他电荷引力,相互吸引。
在极性-非极性作用力中,极性分子与非极性分子之间的电荷分布差异引起的作用力。
极性作用力是物质溶解、相互作用的重要基础。
总结起来,分子间作用力是物质中分子之间相互作用的力,决定了物质的性质和现象。
范德华力、离子作用力、氢键、极性作用力等是常见的分子间作用力,它们在化学、物理、生物等领域都起着重要的作用。
高中化学选修3分子间作用力和氢键知识点总结一.分子间作用力1.定义:分子间存在着将分子聚集在一起的作用力,称分子间作用力。
分子间作用力也叫范德华力.2.实质:一种电性的吸引力.3.影响因素:分子间作用力随着分子极性.相对分子质量的增大而增大.分子间作用力的大小对物质的熔点.沸点和溶解度都有影响.一般来说.对于组成和结构相似的物质来说,相对分子质量越大,分子间作用力越强,物质的熔沸点也越高.4.只存在于由共价键形成的多数化合物,绝大多数非金属单质分子和分子之间.化学键是分子中原子和原子之间的一种强烈的作用力,它是决定物质化学性质的主要因素。
但对处于一定聚集状态的物质而言,单凭化学键,还不足以说明它的整体性质,分子和分子之间还存在较弱的作用力。
物质熔化或汽化要克服分子间的作用力,气体凝结成液体和固体也是靠这种作用力。
除此以外,分子间的作用力还是影响物质的汽化热、熔化热、溶解黏度等物理性质的主要因素。
分子间的作用力包括分子间作用力(俗称范德华力)和氢键(一种特殊的分子间作用力)。
分子间作用力约为十几至几十千焦,比化学键小得多。
分子间作用力包括三个部分:取向力、诱导力和色散力。
其中色散力随分子间的距离增大而急剧减小,一般说来,组成和结构相似的物质,分子量越大,分子间距越大,分子间作用力减小,物质熔化或汽化所克服的分子间作用力减小,所以物质的溶沸点升高。
化学键与分子间作用力比较化学键分子间作用力概念相邻的原子间强烈的相互作用物质分子间存在的微弱的相互作用能量较大很弱性质影响主要影响物质的化学性质主要影响物质的物理性质二.氢键-特殊的分子间作用力1.概念:氢键是指与非金属性很强的元素(主要指N、O、F)相结合的氢原子与另一个分子中非金属性极强的原子间所产生的引力而形成的.必须是含氢化合物,否则就谈不上氢键。
2.实质:氢键不是化学键,属于分子间作用力的范畴.但比普通分子间作用力要强得多.3.存在:水.冰.氨.无机酸.醇等物质能形成氢键.4.分类:分子内氢键和分子间氢键5.影响:分子间氢键的形成除使物质的熔沸点升高外,对物质的溶解度.硬度等也都有影响.6.表示法:用"X—H…Y"表示,且三原子要在一条直线上.X、Y与H构成分子。