酶与酶促反应
- 格式:ppt
- 大小:2.43 MB
- 文档页数:20

酶促反应和酶的作用机制酶是一种生物催化剂,也是生命体系中非常重要的一种蛋白质。
酶的作用机制是通过酶促反应来完成的,这种反应是基于酶与底物之间的相互作用。
酶与底物结合形成酶底物复合物,反应后酶与产物解离,使得底物转化为产物。
酶促反应往往速度非常快,特异性较高,因此具有非常广泛的应用前景。
下面将从酶促反应的基本原理和酶的作用机制两方面来详细阐述。
一、酶促反应的基本原理酶促反应是一种基于酶与底物之间的相互作用来进行的化学反应。
这种反应不仅与物质的性质、反应条件有关,而且也与酶的特定性质以及生物环境下的活性相关。
在酶促反应中,酶与底物通过多种非共价键相互作用形成酶底物复合物,复合物中活性中心的化学性质被改变,从而产生反应。
这种反应可以简化为以下四个步骤:1. 亲和力:酶能够与底物结合的过程称为亲和力。
这种相互作用的前提是酶要具有适当的构象,与底物结合必须与一个特定的位点相互作用。
2. 过渡态:酶底物复合物中活性位点经历了一系列形态变化,从而形成一个临时的稳定结构,称为过渡态。
3. 成品生成:过渡态分解后,产生的产物与酶比较弱的相互作用,从而释放酶,进行下一次反应。
4. 酶活性的调节:酶活性的调节是由于底物、产物或其他非底物分子对酶的亲和力和/或立体结构的变化所引起的。
二、酶的作用机制酶的作用机制是基于其分子结构和学问性质的,主要有以下几种:1. 酶催化作用:酶可以促进底物分子之间的反应,降低反应的能垒,从而使化学反应更加容易进行。
2. 特异性:酶的活性中心由一定的氨基酸序列组成,这种序列的三级结构决定了酶的特异性。
在酶底物复合物中,酶能够与特定的底物结合,由于底物在酶的活性中心区域上的结构与底物的大小、形状和化学性质互相适应而产生特异性。
3. 反应速率:酶催化反应的速度比无酶反应快得多,因为酶结构中的活性中心能够提醒底物之间的相互作用。
酶催化反应的速率取决于反应底物的浓度、酶催化的速率常数和反应条件等。

第三章酶与酶的促反应名词解释全酶对于大多数化学本质为蛋白质的酶来说,按照化学组成可分为单纯酶和结合酶两大类。
全酶(又称结合酶)除了蛋白质组分外,还含有对热稳定的小分子物质。
前者称为酶蛋白,后者称为辅因子。
酶蛋白和辅因子单独存在时,均无催化活力。
只有二者结合成完整的分子时,才具有活力。
此完整的酶分子称为全酶。
全酶=酶蛋白+辅因子酶的辅助因子:主要包括金属离子和小分子有机化合物,在酶促反应中主要决定反应的种类和性质,在反应中起到传递电子、原子或某些化学基团的作用。
辅酶和辅基:辅酶是指以非共价键和酶蛋白结合的小分子有机物质,通过透析或超滤等物理方法可以除去。
辅基是指以共价键和酶蛋白结合的小分子有机物质,不能通过透析或超滤的方法除去酶的活性中心是指酶分子能与底物特异性结合并将底物转化为产物,具有特定空间结构的区域。
使酶分子执行其催化功能的部位同工酶催化相同的化学反应,而酶蛋白的分子结构,理化性质及免疫学性质不同的一组酶(5种乳酸脱氢酶同工酶)变构调节变构调节(也叫别构调节)是指一些代谢物与某些酶分子活性中心以外的某一部位可逆的结合(非共价结合),引起酶构象变化、从而改变酶的催化活性,此种调节方式叫做变构调节。
共价修饰调节在其他酶的催化作用下,某些酶蛋白肽链上的一些基因可与某种化学基因发生可逆的共价结合,从而改变酶的活性,此过程成为共价修饰。
抑制剂凡能是酶的催化活性下降而不引起酶蛋白变性的物质称为酶的抑制剂。
Km米氏常数(Km)的含义是酶促反应达最大速度(Vm)一半时的底物(S)的浓度。
竞争性抑制抑制剂的结构与底物结构相似,能与底物竞争结合在酶的活性中心,从而降低或抑制酶活性这种抑制作用称竞争性抑制剂,这种抑制作用称竞争性抑制作用。
底物浓度增大,抑制下降。
Km增大,亲和力下降,Vm不变非竞争性抑制有些抑制剂可与酶活性中心以外的必需基团结合,不影响酶与底物的结合,抑制剂和底物可同时结合在酶分子上,形成酶-底物-抑制剂复合物,不能释放出产物,使酶活性丧失,这种抑制剂称为非竞争性抑制剂,这种抑制作用称为非竞争性作用。

酶促反应影响因素酶促反应影响因素1. 温度:温度高于酶的最适活性温度,会加速酶分子的活性,而酶活性过高则可导致酶烧伤或破坏,从而降低反应的速率,所以保持合适的温度是影响酶促反应的重要因素之一。
2. 酶浓度:酶浓度是影响酶促反应速率的主要因素,它直接影响反应中酶与底物之间的接触次数,当酶浓度增加时,酶与底物越多,接触次数越多,反应速率自然越快,反之,当酶浓度过低时,反应速率就变慢。
3. pH值:pH值也会影响酶促反应,每种酶都有自己最适宜的pH值,若pH值过高或过低,酶活性可能会下降,甚至在一定的极端条件下可能造成酶的解离,因此需要控制反应的pH值。
4. 辅助因子:对于一些特定的酶,还需要加入某些激活剂或辅助因子,才能促进反应,引起酶活性。
例如,维生素是不可缺少的辅助因子,它们可能和一些酶结合形成介质型酶,影响酶促反应的反应速率。
5. 抑制剂:在生理反应过程中,也需要抑制酶的活性,而一些有机分子可以抑制酶的活性,从而降低反应的速率。
抑制剂的效果受其类型、浓度和pH值等影响,如果抑制剂的浓度过高,将会完全抑制酶活性,从而降低反应的速率。
6. 氧化剂和还原剂:氧化剂和还原剂都会影响酶促反应,氧化剂可以促进酶的反应速率,而还原剂则可以降低酶的反应速率。
例如,苯酚可以作为氧化剂加速酶促反应,而过氧化氢则可以作为还原剂,降低酶促反应的速率。
7. 金属离子:一些金属离子也可以影响酶的反应速率,其中锰、铜、铁等离子可能介导酶的正向活性,而硫酸钙、硫酸镁、硫酸铝等离子可能起抑制作用,降低酶的反应速率。
因此,温度、酶浓度、pH值、辅助因子、抑制剂、氧化剂和还原剂以及金属离子等都是影响酶促反应速率的重要因素。
基于此,实验室工作者可以在有效控制这些条件条件的基础上,改善反应的质量和效率,从而获得更佳的实验结果。



第3课时酶促反应及影响酶作用速率的因素教学过程导入新课教师呈示情景:出示细胞亚显微结构图或让学生观察教材中的细胞图,然后由学生回答线粒体、叶绿体、溶酶体与核糖体等细胞器的作用。
并思考,为何相关的细胞代谢只能在相应的细胞结构中完成或进行?推进新课板书:(三)酶促反应与酶促反应过程教师引导:(1)根据我们前面所学的知识可以知道,细胞内所有的代谢反应都是在酶的催化下进行的。
细胞内各种结构的功能不同,其原因之一是它们的结构中所含酶的种类各异。
(2)如:线粒体是有氧呼吸的主要场所,是由于彻底氧化分解有机物的酶分布于此;核糖体中有合成蛋白质的酶存在使其成为合成蛋白质的场所;叶绿体内有催化光合作用的酶系……(3)细胞空间上酶分布的分隔性和酶的高效性、专一性、多样性,使错综复杂的代谢反应既各自独立又相互协调统一。
(4)我们把这种由酶催化的化学反应称为酶促反应。
师那么酶促反应与一般的化学反应有何区别呢?学生活动:学生小组讨论、代表发言。
生甲酶促反应通常是在常温、常压、接近中性等温和条件下进行的。
生乙酶的催化效率很高,因而生物体内的酶促反应速率很快。
酶促反应中酶的催化往往具有专一性,即一种酶只能催化一种或一类化学反应。
……师在酶促反应中,酶究竟是如何产生催化作用的?学生活动:自主学习课文中“酶促反应的相关知识”,注意观察“酶促反应示意图”中a、b两图的区别,并进行小组讨论。
教师活动:打开自制的Flash课件,动态模拟酶在酶促反应中的作用机制(我们建议在设置媒体技术时,要尽量符合“诱导—契合”模型,而非“钥匙—锁”模型)。
生酶在酶促反应中能催化特定的底物反应,与酶的活性中心有关。
但是,什么是酶的活性中心呢?师①活性中心是指酶分子中直接和底物结合,并和酶的催化作用直接有关的部位。
②酶的活性中心一般位于酶分子的表面,呈裂缝状。
③酶活性中心一般是由两部分组成的,一部分叫做结合基团,主要起到与底物结合的作用;另一部分叫做催化基团,直接参与催化反应。
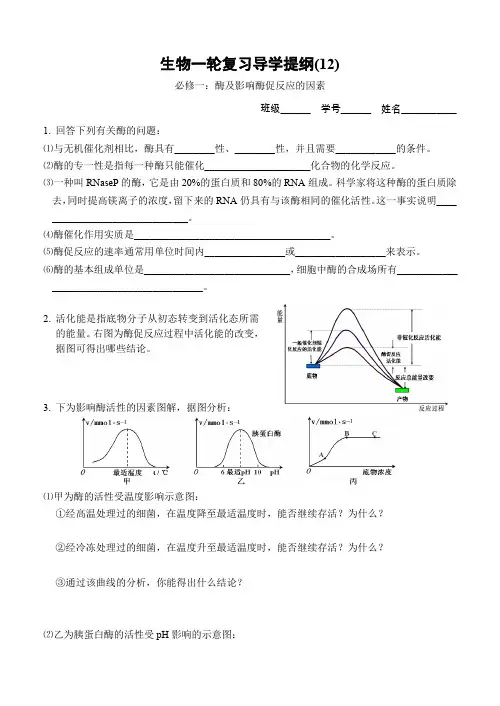
生物一轮复习导学提纲(12)必修一:酶及影响酶促反应的因素班级______ 学号______ 姓名___________1.回答下列有关酶的问题:⑴与无机催化剂相比,酶具有________性、________性,并且需要____________的条件。
⑵酶的专一性是指每一种酶只能催化_____________________化合物的化学反应。
⑶一种叫RNaseP的酶,它是由20%的蛋白质和80%的RNA组成。
科学家将这种酶的蛋白质除去,同时提高镁离子的浓度,留下来的RNA仍具有与该酶相同的催化活性。
这一事实说明____ ___________________________。
⑷酶催化作用实质是_______________________________________。
⑸酶促反应的速率通常用单位时间内________________或__________________来表示。
⑹酶的基本组成单位是_____________________________,细胞中酶的合成场所有____________ ______________________________。
2.活化能是指底物分子从初态转变到活化态所需的能量。
右图为酶促反应过程中活化能的改变,据图可得出哪些结论。
3.下为影响酶活性的因素图解,据图分析:⑴甲为酶的活性受温度影响示意图:①经高温处理过的细菌,在温度降至最适温度时,能否继续存活?为什么?②经冷冻处理过的细菌,在温度升至最适温度时,能否继续存活?为什么?③通过该曲线的分析,你能得出什么结论?⑵乙为胰蛋白酶的活性受pH影响的示意图:反应温度(℃)反应温度(℃)反应温度(℃)反应温度(℃)①当将胰液的pH 从9调至2的过程中,胰蛋白酶的活性将怎样变化?②当将胰液的pH 从2调至8的过程中,胰蛋白酶的活性将怎样变化?③通过上述分析,你能得出什么结论?④下图中能正确表示胰蛋白酶对底物的分解速度和温度关系的是______。


酶的结构与酶促反应酶是一类生物催化剂,能够在生物体内加速化学反应的进行。
酶可以通过特定的结构来催化特定的反应,这种结构与功能的关系被称为“锁与钥”模型。
本文将探讨酶的结构特点以及酶促反应的机制。
一、酶的结构酶的结构通常由蛋白质组成。
蛋白质由氨基酸经过肽键连接而成,形成了多肽链。
在多肽链的折叠过程中,酶蛋白质链会形成不同的二级、三级和四级结构。
1. 二级结构二级结构是指蛋白质链在空间上的折叠形态,其中最常见的二级结构是α螺旋和β折叠。
α螺旋是由多个氨基酸残基以螺旋形式排列而成,而β折叠则是由多个氨基酸残基以折叠形式排列而成。
这些二级结构的存在以及相对稳定的形态为酶的整体结构提供了基础。
2. 三级结构三级结构是指蛋白质链在空间上的整体折叠形态。
酶的三级结构是由不同的二级结构单元按照一定的方式排列组成的。
这些二级结构单元之间可以通过氢键、离子键、范德华力等相互作用力相连。
这些相互作用力的存在使得酶的结构相对稳定,并且能够保持特定的构象。
3. 四级结构四级结构是指由多个多肽链相互组装而成的酶的整体结构。
多肽链之间可以通过非共价键相互作用,如氢键、离子键、疏水作用力等。
这些多肽链的组装可以使得酶的结构更加复杂,形成活性中心。
二、酶促反应的机制酶促反应是指酶催化下的生物化学反应。
酶在反应中的作用是提供一个活性中心,使得底物能够与酶结合并发生特定的化学反应。
在酶促反应中,通常存在以下几个步骤:1. 亲合作用酶与底物之间通过非共价键的相互作用力来形成酶底物复合物。
这种亲合作用可以使酶底物复合物更加稳定,并增加反应速率。
2. 反应酶底物复合物在活性中心的催化下发生化学反应。
催化作用通常包括底物的分解、合成、重排等过程。
3. 产物释放反应完成后,酶释放产物,并回归到初始状态,以便继续进行下一轮反应。
产物的释放可以通过多种方式实现,如酶与产物的亲和力下降、反应条件的变化等。
三、酶的调控与应用酶的活性可以通过多种方式进行调控,如温度、pH值、底物浓度等。

酶促反应实验报告酶促反应是一种在生物体内常见的化学反应过程,其重要性不言而喻。
在生命过程中,我们的身体内有很多种酶,在不同的反应中发挥着不同的作用。
本次实验是通过酶促反应的方式来研究不同条件下对酶作用的影响。
通过实验的结果,加深我们对于酶和酶促反应的了解。
实验方法:材料:过氧化氢、酶、试管、酶标板、醋酸、磷酸盐缓冲液、双氧水。
操作步骤:1.将3倍分贝的过氧化氢与不同浓度的酶混合,分别装在试管中。
2.将不同浓度的醋酸和磷酸盐缓冲液分别混合,用于调节酸碱度。
3.将混合后的试管放入恒温水浴中,每5秒钟记录一次反应的进展情况。
实验结果:实验数据记录表:| 酸碱度 | 酿酒酵母酶 | 酶标板 || ------ | --------- | ------- || 2 | 快 | 快 || 3 | 适中 | 适中 || 4 | 缓慢 | 缓慢 |根据实验结果可以看出,酿酒酵母酶在不同酸碱度的环境下,反应的速度存在较大的差异。
在酸碱度为2的情况下,酶的反应速度最快,其次是酸碱度为3的情况,而酸碱度为4时酶的反应速度最慢。
这也从侧面证明了酶是一种对于环境条件比较敏感的物质,在不同的环境下会有差异表现。
通过本次实验,我们可以得出以下结论:1.不同的酸碱度对于酶活性存在影响。
2.在酸碱度为2的情况下酶反应的速度最快。
4.不同酸碱度下的酶反应速度趋向一致,说明酶的反应受到环境条件的影响较大。
参考文献:1. 王嘉亮, 张小强, 林文豪. 酶结构与功能的研究进展[J]. 化学通报, 2016(04):31-37.2. 刘洋, 朱佳佳, 赵芳芳. 酶影响因素及应用综述[J]. 技术创新与应用, 2018(26):142-143.3. 赵亚非, 宋茂静, 杨月华. 酶活性与温度、温敏性酶[J]. 湖南农业科学, 2015(10):23-25.。
酶的底物特异性和酶促反应速率酶是生物体内的催化剂,在许多生化反应中起着关键作用。
酶的底物特异性和酶促反应速率是酶学研究中的重要内容。
本文将对酶的底物特异性和酶促反应速率进行探讨,并分析其在生物体内的意义。
一、酶的底物特异性酶的底物特异性指的是酶对底物的选择性。
酶能够识别并结合特定的底物,并将其转化为产物。
酶的底物特异性是由酶的结构决定的。
酶的活性部位有具有特定的结构和电荷,能够与底物形成亲和力较强的结合。
酶的底物特异性可以通过“锁与钥”模型来解释。
在这个模型中,酶的活性部位就像一个锁孔,底物则是适合于这个锁孔的钥匙。
只有当底物的结构与酶的活性部位完全吻合时,才能形成稳定的酶底物复合物,从而进行催化反应。
实际上,酶的底物特异性并不是非常严格的。
一种酶可以与多种底物发生反应,但不同底物的反应速率可能不同。
酶的底物特异性受到多种因素的影响,如酶的空间构象、活性位点的氨基酸残基以及底物的结构。
二、酶促反应速率酶促反应速率是指在酶的作用下,底物转化为产物的速率。
酶促反应速率决定了酶催化的效率和生化反应的速度。
酶促反应速率可以通过酶的催化常数来衡量,常用的催化常数包括酶的最大反应速率(Vmax)和底物浓度为一半时的反应速率(Km)。
Vmax表示在酶浓度饱和的情况下,单位时间内转化的最大底物量。
Vmax取决于酶的浓度和底物浓度。
当底物浓度远远大于Km时,Vmax可以表示为一个恒定值。
而当底物浓度接近Km时,Vmax则表示为底物浓度的函数。
Km表示当反应速率达到Vmax的一半时,底物浓度的大小。
Km可以衡量酶对底物的亲和力和酶的底物特异性。
Km越小,酶对底物的亲和力越强,底物与酶的亲和力越大,Km越大,则表示酶对底物的亲和力越弱,底物与酶的亲和力越小。
酶的底物特异性和酶促反应速率在生物体内具有重要的生理学和生化学意义。
酶的底物特异性使得生物体内的化学反应能够更加高效地进行,减少了底物的能量消耗和副产物的产生。
酶促反应速率可以调节生物体内代谢途径的速度,使其适应外部环境的需求。
化学反应中的酶与酶促反应在化学反应中,酶是一种重要的催化剂。
它们能够加速酶促反应的进行,降低活化能,从而使反应更加高效。
本文将从酶的结构与功能、酶促反应的机制等方面进行讨论。
一、酶的结构与功能酶是一种特殊的蛋白质,由氨基酸组成,具有复杂的三维结构。
它们可以在生物体内特异性地催化化学反应,而不改变自身的化学性质。
酶能够与底物结合形成酶底物复合物,通过改变反应介质中底物的构象,使反应速率增加。
酶的功能主要体现在以下几个方面:1. 催化反应:酶通过提供活化能的途径,降低化学反应的活化能,从而加速反应进行。
这种催化作用可以使反应速率提高几千倍甚至百万倍。
2. 特异性:酶对特定底物有高度的选择性,只与特定的底物结合并催化特定的化学反应。
这种特异性是由酶的结构决定的。
3. 调节反应:酶可以通过调节其自身的活性,根据细胞内外的环境变化,来对化学反应进行调节。
这种调节使生物体能够适应不同的生理和环境需求。
二、酶促反应的机制酶促反应是指在酶存在的条件下,底物发生化学反应,最终生成产物。
酶促反应的机制可以分为以下几个步骤:1. 酶与底物的结合:酶与底物之间通过非共价相互作用力,如氢键、离子键、范德华力等,结合形成酶底物复合物。
2. 底物转化:酶通过改变底物的构象,使其在酶的作用下发生化学变化。
这种构象改变通常涉及底物的键长、键角等参数的变化。
3. 产物释放:酶通过进一步改变底物的构象,使之转化为产物。
产物在酶的作用下与酶解离,释放出来。
通过上述步骤,酶能够在细胞内部发挥催化作用,加速复杂的生物化学反应,从而维持细胞内的代谢平衡。
三、酶与生物反应的应用由于酶对生物反应的催化作用具有高效、特异性和选择性等优点,因此在生物技术领域得到广泛应用。
1. 生物催化:酶在工业生产中被广泛利用,例如酶制剂可以用于制备食品、药物和化妆品等。
利用酶催化反应,可以减少废物产生,提高反应效率。
2. 生物传感器:酶可以被用作生物传感器的生物元件。
酶促反应得特点
状况陈述
1. 酶促反应是一种可以加速生物反应的反应,它能够大大加快原有反应的速度,促进物质代谢过程。
2. 酶促反应可分为可逆反应和不可逆反应,可是当末端产物受限时,可逆反应也会失去可逆性。
3. 酶促反应中,酶可以显著的影响反应的速度,即在特定环境中使反应加速的功能被称为酶活性。
4. 酶促反应中,为了保证反应的有效进行,通常需要一定的水分、有机溶剂、pH值和温度等环境条件。
5. 酶促反应也可受外界干扰,辐射、电磁波、药物、放射性物质等因素均可影响酶活性。
酶促反应机制
酶促反应机制是指通过酶作用来促进生物化学反应的过程。
酶是一种生物催化剂,能够降低化学反应所需的能量和反应速率,从而加速生物体内的化学反应。
酶在反应中起到的作用是将底物(反应物)转化成产物。
酶与底物结合后形成酶-底物复合物,然后在酶的催化下,底物被分解或合成成产物。
酶作为一个催化剂,不会被反应消耗,而是可以被多次使用。
酶促反应的速率受到多种因素的影响,包括温度、pH、底物浓度和酶的浓度等。
一般来说,酶的催化作用在一定温度和pH条件下最为有效,而随着温度的升高和pH的变化,酶的催化作用会受到影响。
在生物体内,酶促反应是许多生命过程中必不可少的一部分,比如食物的消化、能量的产生和细胞分裂等。
同时,酶促反应也在医学和工业生产中有着广泛的应用,比如制药、生物技术和食品加工等领域。