九年级化学上册第二章 2.3构成物质的微粒Ⅱ__原子和离子第3课时相对原子质量离子作业课件新版粤教版
- 格式:ppt
- 大小:1.27 MB
- 文档页数:5




2.3构成物质的微粒(Ⅱ)——原子和离子一、原子:1、原子是构成物质的另一种微粒。
原子构成分子,原子也可直接构成物质,如金属汞、稀有气体等。
2、在化学变化中,分子本身发生变化,而原子本身没有变化,只是重新组合成新的分子,构成新的物质,所以,原子是化学变化中的最小粒子。
(注意:原子不是构成物质的最小粒子。
)※、分子与原子的比较化学反应的实质:在化学反应中分子分裂为原子,原子重新组合成新的分子。
二、原子的构成原子的的构成:原子由核外带负电的电子和带正电的原子核构成,原子核由带正电的质子和不带电的中子构成。
在不显电性的粒子里:核电荷数=质子数=核外电子数注意:原子不是构成物质的最小粒子。
原子只是化学变化中的最小粒子;普通氢原子核中只有质子无中子,氢原子的原子核就是一个质子。
(1)原子结构示意图的认识核外电子排布的规律:核外电子按能量由低到高从里往外排,第一层最多容纳2个电子,第二、三层最多容纳8个电子。
按顺序背诵:质子数从1~18的元素符号和名称: 氢氦锂铍硼 碳氮氧氟氖 钠镁铝硅 磷硫氯氩 (1)在原子中核电荷数=质子数=核外电子数 (2)原子的质量主要集中原子核 上决定元素种类 质子数(核电荷数) (3)三决定 决定元素化学性质 最外层电子数 决定原子的质量 原子核(4)相对原子质量≈质子数+中子数说明:最外层电子数相同其化学性质不一定都相同(Mg ,He 最外层电子数为2) 最外层电子数不同其化学性质有可能相似(He ,Ne 均为稳定结构) 稳定结构:最外层电子数是8(只有一层的为2)的结构。
元素的化学性质跟原子的最外层电子数关系最密切,原子的最外层电子数决定元素的化学性质:最外层电子数小于4时,易失去最外层所有电子,成为阳离子;(通常是金属元素)最外层电子数多于4时,易得到电子使最外层电子数变为8,成为阴离子(通常是非金属元素)最外层电子数与化合价的关系:(元素的最高正价等于原子的最外层电子数) 最外层电子数小于4时,最外层电子数就是元素的化合价(正价); 最外层电子数多于4时,最外层电子数-8=元素的化合价三、相对原子质量:以一种碳原子(碳-12)质量的1/12作为标准,其他原子的质量跟它相比较所得的数值,是该种原子的相对原子质量。


2.3 构成物质的微粒(II)——原子和离子一、教学内容:1、知道原子、离子也是构成物质的一种微粒,了解原子的结构。
2、理解相对原子质量的概念,会查相对原子质量。
3、初步学习通过“模型”来认识物质结构。
4、建立物质是无限可分的观点。
二、重点、难点:知道原子、原子的结构,理解相对原子质量是重点。
原子结构的空间想象,相对原子质量的理解是难点。
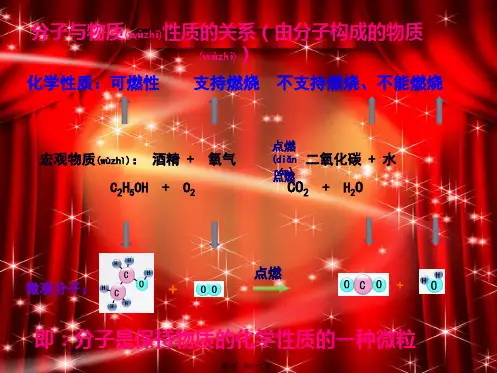
三、教学程序(一)分子很小,分子又是由什么构成的呢?分子还能不能分割呢?分子还可以分成更小的微粒—原子! 【探究实验】加热氧化汞氧化汞的分解现象:管壁上有银白色物质生成,在试管口试验的带火星的木条复燃原理:氧化汞−−→−加热汞 + 氧气 HgO Hg O 2结论:在化学变化中,氧化汞分子本身发生了变化,分解成汞原子和氧原子,而汞原子和氧原子不能再分,它们只是重新组合。
(二)原子也是构成物质的一种微粒1、原子也是构成物质的一种微粒金属、稀有气体(氦气He 等)、金刚石、硅等是由原子构成的 2、原子的质量—相对原子质量原子的质量很小,使用很不方便,如氢原子:×2710-kg氧原子:kg 2610657.2-⨯ 相对原子质量=一个碳原子实际质量一个原子的实际质量⨯)12/1(用以上方法,代入具体数据,就可算出各种原子的相对原子质量,如:H 的相对原子质量=110993.1)12/1(10674.12627=⨯⨯⨯--kg kg(近似值)O 的相对原子质量=kgkg262610993.1)121(10657.2--⨯⨯⨯=16其它常见元素的相对原子质量的计算结果见课本P89表中(近似值) 注意:相对原子质量 = 质子数 + 中子数 3、原子的构成⎪⎩⎪⎨⎧⎩⎨⎧负电荷每个电子带一个单位的电子核外电子不显电性中子正电荷每个质子带一个单位的质子原子核原子:::4、原子内部的特点原子的核内质子数=核外电子数=核电荷数=原子序数5、原子结构示意图(三)离子是构成物质的又一种微粒离子的形成:化学变化中,中性的原子得到或失去电子成为带电荷的微粒,这种微粒就是离子。

湖南省益阳市资阳区迎丰桥镇九年级化学上册第2章空气、物质的构成2.3 构成物质的微粒(Ⅱ)—原子和离子(第3课时)教案(新版)粤教版编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(湖南省益阳市资阳区迎丰桥镇九年级化学上册第2章空气、物质的构成2.3 构成物质的微粒(Ⅱ)—原子和离子(第3课时)教案(新版)粤教版)的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为湖南省益阳市资阳区迎丰桥镇九年级化学上册第2章空气、物质的构成2.3 构成物质的微粒(Ⅱ)—原子和离子(第3课时)教案(新版)粤教版的全部内容。
构成物质的微粒(2)—--—-原子、离子教学设计课标要求知道离子都是构成物质的微粒。
理解离子的概念教材及学情分析通过学生以有原子结构的知识,利用原子结构示意图形象的展示原子得失电子的过程,从而理解离子的形成过程课时教学目标知识与技能知道离子都是构成物质的微粒.理解离子的概念过程与方法通过阅读课本和教师利用原子结构示意图的方法形象的讲解,知道离子的形成过程。
情感态度与价值观感受世界的物质性、初步形成微观想像能力.重点重点:离子的概念难点难点:离子形成过程教法学法指导阅读法,讲授法教具准备教学过程提要环节学生要解决的问题或完成的任务师生活动设计意图引入新课观察、叙述、记录演示实验(观看金属钠在氯气中燃烧的视频)记录实验现象教学过程教阅读教材有关内容 , 讨论钠的原子与氯的原子怎样生成氯化钠?[提问 ]1. 什么叫阳离子 ?2. 什么叫阴离子?3。
带上电荷的原子 ( 或原子团) 称为什么 ?第47 页原子-分子论是怎样根据学生对思考题的回答,评价学生并讲解离子形成过程介绍化学家建立离子的概念阅读与交流。

化学九年级全一册配粤教科学版第一章大家都来学化学1.1身边的化学【达标训练】1.D2.A解析:煤炭是自然界存在的物质,不是化工产品。
3.D解析:干燥剂一般不能食用,不是食品的添加剂。
4.D 5.C 6.D7.C8.C9.B10.(1)C(2)A(3)D(4)D(5)B(6)C11.(1)苯酚有毒,对皮肤、黏膜有强烈的腐蚀作用(2)BC12.(1)衣:合成纤维的发明,使人们的服装丰富多彩(2)食:先进的化学检测手段避免有毒物质进入食品,保护了人体健康(3)住:钢铁、水泥等传统材料与新型材料的使用,让人们住进了高楼大厦(4)医:青霉素的合成和使用,使人们摆脱了许多疾病的折磨(合理即可)1.2化学实验室之旅第1课时实验室规则、实验常用仪器【达标训练】1.D 2.B 3.C 4.B 5.C 6.A7.D8.D9.C10.①②③①③①③②11.C12.(1)①H②E③C④F⑤I⑥B(或H,或B、H)(2)C解析:(2)实验结束后,酒精灯应用灯帽盖灭,待冷却后再盖上灯帽;托盘天平的砝码应放回砝码盒;滴管不能平放或倒放,用后应立即洗净,与滴瓶配套的滴管不能清洗。
第2课时化学实验基本操作【达标训练】1.C 2.A 3.C 4.D 5.A 6.D7.A解析:150 mL液体的体积较大,应用烧杯盛放,给烧杯加热必须垫上石棉网。
8.C9.平凹液面的最低处10.细口瓶倒放向着手心紧挨缓慢11.(1)胶头滴管试管刷(2)从试管底部往上套,夹在试管的中上部(3)液体量超过了试管容积的1/3,并且加热时试管口对着人12.(1)10 mL量筒、胶头滴管、试管(体积至少为20 mL)、试管夹、酒精灯(2)先用量筒量取6 mL水,倒入试管中,夹上试管夹,擦干试管外壁,用酒精灯给液体加热(3)①试管外壁有水;②没有对试管进行预热;③试管底部接触到了灯芯;④加热完后骤冷等(任写两点即可)(4)D1.3物质的变化【达标训练】1.B2.A解析:A中的烟火礼花是某些物质燃烧发出的火焰,伴随有新物质生成,是化学变化;B中是利用稀有气体通电时发出不同颜色的有色光,只是能量的转化;C中也是能量的转化;D中茅台酒挥发出酒精,这些现象均无新物质生成,都不是化学变化。
第1节构成物质的基本微粒
第3课时
一、教学目标
1.知道原子是由原子核和核外电子构成。
2.掌握核电荷数、电子数、质子数之间的关系。
3.知道原子结构示意图的含义,初步学会分析原子结构示意图。
4.了解原子最外层电子数与原子种类的关系。
二、教学重难点
重点:核电荷数、电子数、质子数之间的关系。
难点:原子结构示意图的含义;分析原子结构示意图。
三、教学准备
教学PPT及相关动图。
四、教学过程
五、板书设计
第1节构成物质的基本微粒
第3课时
一、原子核的结构
二、原子核外电子排布。