第三章 氨基酸、多肽与蛋白质
- 格式:ppt
- 大小:5.09 MB
- 文档页数:126




第三章氨基酸1.氨基酸的侧链对多肽或蛋白质的结构和生物学功能非常重要。
用三字母和单字母缩写形式列出其侧链为如下要求的氨基酸:(a)含有一个羟基;(b)含有一个氨基;(c)含有一个具有芳香族性质的基团;,(d)含有分支的脂肪族烃链;(e)含有硫;(f)含有一个在pH 7~10范围内可作为亲核体的基团或原子,指出该亲核基团或原子。
2.就异亮氨酸的结构式回答下列问题:(a)它有多少个手性中心?(b)它有多少个光学异构体?(c)绘出异亮氨酸所有光学异构体。
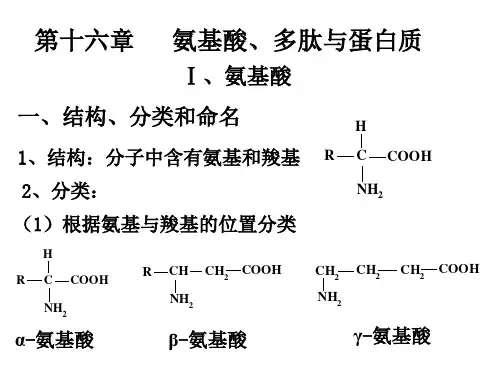
’3.根据各个氨基酸相应的pKα值(见书)画出以下各氨基酸在pH 3.0,pH 7.0,pH 13.0时的主要离子结构:(a)Gly;(b)Glu;(c)Asp;(d)Arg;(e)His;(f)Pro。
4.计算第3题中各氨基酸的等电点(pI)。
5.一种氨基酸的可解离基团可以带电或中性状态存在,这取决于它的pK值和溶液的pH。
(a)组氨酸有3种可解离基团,写出相应于每个pK值的3种解离状态的平衡方程式。
每种解离状态下的组氨酸分子的净电荷是多少?(b)在pH 1,4,8和12时,组氨酸的净电荷分别是多少?将每一pH下的组氨酸置于电场中,它们将向阴极还是阳极迁移?6.某种溶液中含有三种三肽:Tyr-Arg-Ser,Glu-Met-Phe和Asp-Pro-Lys,α-COOH 基团的pKα为3.8;α-NH3基团的pKα为8.5。
在哪种pH(2.0,6.0或13.0)下,通过电泳分离这三种多肽的效果最好?7.利用阳离子交换层析分离下列每一对氨基酸,哪一种氨基酸首先被pH7缓冲液从离子交换柱上洗脱出来。
(a)Asp和Lys;(b)Arg和Met;(c)Glu和Val;(d)Gly和Leu;(e)Ser和Ala。
8.含有685个氨基酸残基的单一一条多肽链的蛋白质的近似相对分子质量是多少?9.氨基酸的定量分析表明牛血清白蛋白含有o.58%的色氨酸(色氨酸的相对分子质量为204)。

第3章蛋白质化学答案第3章蛋白质化学答案第三章、蛋白质化学(一)氨基酸化学部分1、名称表述解:必需氨基酸:机体不能自行合成而必须从外界食物摄取的氨基酸。
ilemetvalleutrpphethrlys,对婴儿还有:arg、his。
非必需氨基酸:能够在人体内利用糖代谢中间产物转氨促进作用制备的氨基酸。
消旋作用:旋光性物质在化学反应中,其不对称原子经过对称状态的中间阶段,失去旋光性的作用。
消旋物:旋光性物质在化学反应中,产生d-型和l-型的等摩尔混合物,丧失旋光性的促进作用。
2、结构式丙氨酸、苯丙氨酸、酪氨酸、甘氨酸、丝氨酸、谷氨酸、天冬氨酸。
3、为什么共同组成蛋白质的基本单位就是氨基酸。
根据氨基酸侧链r基的极性可以分成哪几类?解:蛋白质水解产物是氨基酸。
分类:(1)非极性r基氨基酸(8种):脂肪烃侧链的氨基酸(丙氨酸、缬氨酸、亮氨酸、异亮氨酸和脯氨酸);芳香族氨基酸:(苯丙氨酸、色氨酸);甲硫氨酸(蛋氨酸)。
(2)、不拎电荷的极性r基氨基酸:7种;甘氨酸、丝氨酸、苏氨酸、酪氨酸、天冬酰胺、谷氨酰胺、半胱氨酸(3)、拎正电荷的r基氨基酸:碱性氨基酸,3种;赖氨酸、精氨酸、组氨酸。
(4)、拎负电荷的r基氨基酸:酸性氨基酸,2种;谷氨酸、天冬氨酸。
4、比较几种蛋白质水方法的特点。
求解:(1)、酸水解:产物不消旋,为l-氨基酸;色氨酸被全然毁坏;部分水解羟基氨基酸(丝氨酸或苏氨酸)被毁坏;asn、gln被毁坏。
(2)碱解:消旋,产物为d-和l-氨基酸的混合物;多数氨基酸破坏;色氨酸不被破坏(3)酶求解:不消旋,产物为l-氨基酸;不毁坏氨基酸;须要几种酶共同促进作用5、以芳香族氨基酸为基准表明其光吸收特点。
解:在可见光没有光吸收;在紫外部分有特征光吸收,酪氨酸275nm,苯丙氨酸257nm,色氨酸280nm。
6、何为氨基酸等电点?氨基酸在等电点时存有什么特性。
解:等电点:氨基酸处于正负电荷数相等即净电荷为零的兼性离子状态时溶液的ph 值。

第3章氨基酸四大类生物分子中蛋白质是生物功能的主要载体,而氨基酸(amino acid)是蛋白质的构件分子。
自然界中存成千上万在的种蛋白质,在结构和功能上的惊人的多样性归根结底是由20种常见氨基酸的内在性质造成的。
这些性质包括①聚合能力,②特有的酸碱性质,③侧链的结构及其化学功能的多样性,④手性。
本章主要讲述这些性质,它们是讨论蛋白质和酶的结构、功能以及许多其他有关问题的基础。
一、氨基酸—蛋白质的构件分子(一)蛋白质的水解一百多年前就开始了关于蛋白质的化学研究。
在早期的研究中,水解作用提供了关于蛋白质组成和结构的极其价值的资料。
蛋白质可以被酸、碱或蛋白酶催化水解。
在水解过程中,逐渐降解成相对分子质量越来越小的肽段(peptide fragment),直到最后成为氨基酸的混合物。
根据蛋白质的水解程度,可分为完全水解和部分水解两种情况。
完全水解或称彻底水解,得到的水解产物是各种氨基酸的混合物。
部分水解即不完全水解,得到的产物是各种大小不等的肽段和氨基酸。
下面简略地介绍酸、碱和酶3种水解方法及其优缺点:⑴酸水解常用H2SO4或HCl进行水解。
一般6mol/L HCl,4mol/L H2SO4;回流煮沸20h 左右可使蛋白质完全水解。
酸水解的优点是不引起消旋作用(racemization),得到的是L-氨基酸。
缺点是色氨酸完全被沸酸所破坏,羟基氨基酸(丝氨酸及苏氨酸)有一小部分被分解,同时天冬氨酸和谷氨酰胺的酰胺基被水解下来。
⑵碱水解一般与5mol/L NaOH共煮10~20h,即可使蛋白质完全水解。
水解过程中多数氨基酸遭到不同程度的破坏,并且产生消旋现象,所得产物是D-和L-氨基酸的混合物,称消旋物(见本章氨基酸的光学活性部分)。
此外,碱水解所需时间较长。
因此酶法主要用于部分水解。
常用的蛋白酶有胰蛋白酶(trypsin)、胰凝乳蛋白酶或称糜蛋白酶(chymotrypsin)以及胃蛋白酶(pepsin)等,它们主要用于蛋白质一级结构分析以获得蛋白质的部分水解产物。

第三章蛋白质化学1蛋白质:是一类生物大分子,由一条或多条肽链构成,每条肽链都有一定数量的氨基酸按一定序列以肽键连接形成。
蛋白质是生命的物质基础,是一切细胞和组织的重要组成成分。
2标准氨基酸:是可以用于合成蛋白质的20种氨基酸。
3、茚三酮反应:是指氨基酸、肽和蛋白质等与水合茚三酮发生反应,生成蓝紫色化合物,该化合物在570mm波长处存在吸收峰。
4、两性电解质:在溶液中既可以给出H+而表现出酸性,又可以结合H+而表现碱性的电解质。
5、兼性离子:即带正电和、又带负电荷的离子。
6、氨基酸的等电点:氨基酸在溶液中的解离程度受PH值影响,在某一PH值条件下,氨基酸解离成阳离子和阴离子的程度相等,溶液中的氨基酸以兼性离子形式存在,且净电荷为零,此时溶液的PH值成为氨基酸的等电点。
7、单纯蛋白质:完全由氨基酸构成的蛋白质。
8、缀合蛋白质:含有氨基酸成分的蛋白质。
9、蛋白质的辅基:缀合蛋白质所含有的非氨基酸成分。
10、肽键:存在于蛋白质和肽分子中,是由一个氨基酸的α-羧基与另一个氨基酸的α-氨基缩合时形成的化学键。
11、肽平面:在肽单元中,羧基的π键电子对与氮原子的孤电子对存在部分共享,C-N键具有一定程度的双键性质,不能自由旋转。
因此,肽单元的六个原子处在同一个平面上,称为肽平面。
12、肽:是指由两个或者多个氨基酸通过肽键连接而成的分子。
13、氨基酸的残基:肽和蛋白质分子中的氨基酸是不完整的,氨基失去了氢,羧基失去了羟基,因而称为氨基酸的残基。
14、多肽:由10个以上氨基酸通过肽键连接而成的肽。
15、多肽链:多肽的化学结构呈链状,所以又称多肽链。
16、生物活性肽:是指具有特殊生理功能的肽类物质。
它们多为蛋白质多肽链的一个片段,当被降解释放之后就会表现出活性,例如参与代谢调节、神经传导。
食物蛋白质的消化产物中也有生物活性肽,他们可以被直接吸收。
17、谷胱甘肽:由谷氨酸、半胱氨酸和甘氨酸通过肽键连接构成的酸性三肽,是一种生物活性肽,是机体内重要的抗氧化剂。


氨基酸、多肽第三章氨基酸多肽与蛋白质第一节蛋白质概论Proteins are polymers(多聚体) of amino acids.(氨酸)p-20 amino acids (氨基酸) millions of proteins with different properties and activities.Protein structures are studied at primary, secondary, tertiary and quaternary levels.-αhelix, βsheets, globular, complexes, denaturation and folding. Proteins have widely diverse forms and functions.-enzymes(酶), hormones(激素,荷尔蒙), antibodies(抗体),transporters(转运蛋白),muscle(肌肉),lens protein of eyes(眼睛晶状体),spider webs(蜘蛛网),rhinoceros horn(犀牛角),antibiotics(抗生素),mushroom poisons(蘑菇毒素).)antibiotics()mushroom poisons()一、蛋白质的化学组成与分类1、元素组成碳50%氢7%氧23%氮16%硫0-3%微量的磷、铁、铜、碘、锌、钼。
氮平均含16%。
凯氏定氮:粗蛋白质含量=蛋白氮×6.252、氨基酸组成蛋白质是由20种L-型α氨基酸组成的长链分子The earliest studies of proteins focused on the free amino acids derived from these proteins.•The 1st amino acid (asparagine) was discovered in 1806 from asparagus (芦笋) (a green vegetable).•The last (threonine) was not identified until 1938!•All the amino acids were given a trivial (common) name. Glutamate from wheat gluten (面筋) (sticky). Tyrosine from cheese (“tyros” in Greek).3、分类(1)按组成:简单蛋白:结合蛋白:核蛋白,糖蛋白,脂蛋白,色蛋白,磷蛋白,黄素蛋白,金属蛋白(2)、按分子外形的对称程度:球状蛋白质纤维状蛋白质、膜蛋白质)按功能分(3)、按功能分:酶、运输蛋白、营养和贮存蛋白、激素、受体蛋白、运动蛋白、结构蛋白、防御蛋白。