原子核外电子排布的周期性110
- 格式:ppt
- 大小:922.50 KB
- 文档页数:34


原子核外电子排布与元素周期律一、核外电子的排布规律⑴核外电子运动的特征:质量小,运动空间小,运动速度快,没有确定的轨道。
(2)电子云:电子在核外空间作高速运动,没有确定的轨迹,好象带负电荷的云雾笼罩在原子核的周围,人们形象地称之为电子云。
(3)电子层:根据电子的能量差别和通常运动区域离核的远近不同,核外电子处于不同的电子层。
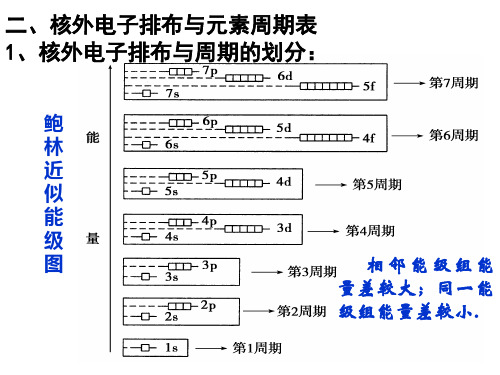
(4)电子层排布倾向能量最低:核外电子总是尽先排布在能量最低的电子层里,然后由里往外,依次排布在能量逐步升高的电子层里。
(5)各电子层容纳的电子数:各电子层最多容纳的电子数是2n 2个,最外层电子数不超过8个(K 层不超过2个),次外层电子数不超过18个,倒数第三层不超过32个。
(6)电子层排布的表示方法:原子结构示意图1、排布规律⑴核外电子排布与能量关系电子离核距离: 近 → 远 电子能量: 低 → 高 ⑵核外电子的分层排布 ① 核外电子层能量不同 电子层离核距离: 近 → 远 电子能量: 低 → 高电子层数(n ): 1 (K) 2(L) 3 (M) 4 (N) 5 (O)② 电子排布规律Ⅰ 能量最低原理:先排满低能量电子层,再依次排布在能量较高的电子层中。
Ⅱ 各电子层最多容纳的电子数:2n 2 Ⅲ 最外层电子数≤8 Ⅳ 次外层电子数≤18 Ⅴ 倒数第三层电子数≤32注意:以上三条规律不是孤立的,而是相互制约,必须同时满足。
2、常见元素微粒结构特点稀有气体元素原子的电子层结构与同周期的非金属元素的阴离子的电子层结构相同,与下一周期的金属元素形成的阳离子的电子层结构相同。
如:(1)核外有2个电子微粒(与He 原子电子层结构相同的离子):H -、Li +、Be 2+ (2)核外有10个电子微粒(与Ne 原子电子层结构相同的微粒):阳离子:+Na 、+2Mg 、+3Al 、+4NH 、+O H 3;阴离子:N -3、O -2、F -、OH -、NH -2;分子:Ne 、HF 、H 2O 、NH 3、CH 4(3)核外有18个电子微粒(与Ar 原子电子层结构相同的微粒):离子:Cl -、S 2-、P 3-、K +、Ca 2+ 分子:Ar 、HCl 、H 2S 、SiH 4、H 2O 2、PH 3、C 2H 6 (4)前18号元素的原子构的特殊性○111 H ○2最外层有1个电子的元素:H 、Li 、Na ○3最外层有2个电子的元素:Be 、Mg 、He ○4最外层电子数等于次外层电子数的元素:Be 、Al 。



高中化学之元素周期律知识点一、原子序数1、原子序数的编排原则按核电荷数由小到大的顺序给元素编号,这种编号,叫做原子序数。
2、原子序数与原子中各组成粒子数的关系原子序数=核电荷数=质子数=核外电子数二、元素周期律我们知道:一切客观事物本来是互相联系的和具有内部规律的,所以,各元素间也应存在着相互联系及内部规律。
1.核外电子排布的周期性从3-18号元素,随着原子序数递增,最外层电子数从1个递增至8个,达到稀有气体元素原子的稳定结构,然后又重复出现原子最外层电子数从1个递增至8个的变化。
18号以后的元素,尽管情况比较复杂,但每隔一定数目的元素,也会出现原子最外层电子数从1个递增到8个的变化规律。
可见,随原子序数递增,元素原子的最外层电子排布呈周期性的变化。
2.原子半径的周期性变化从3-9号元素,随原子序数递增,原子半径由大渐小,经过稀有气体元素Ne后,从11-18号元素又重复出现上述变化。
如果把所有的元素按原子序数递增的顺序排列起来,我们会发现随着原子序数的递增,元素的原子半径发生周期性的变化。
注意:①原子半径主要是由核外电子层数和原子核对核外电子的作用等因素决定的。
②稀有气体元素原子半径的测定方法与其它原子半径的测定方法不同,所以稀有气体的原子半径与其他原子的原子半径没有可比性。
一般不比较稀有气体与其它原子半径的大小。
③粒子半径大小比较的一般规律:电子层数越多,半径越大,电子层数越少,半径越小;当电子层结构相同时,核电荷数大的半径小,核电荷数小的半径大;对于同种元素的各种粒子半径,核外电子数越多,半径越大;核外电子数越少,半径越小。
例如,粒子半径:H->H>H+;Fe3+<Fe2+。
3.元素主要化合价的周期性变化从3-9号元素看,元素化合价的最高正价与最外层电子数相同(O、F不显正价);其最高正价随着原子序数的递增由+1价递增至+7价;从中部的元素开始有负价,负价是从-4递变到-1。
从11-17号元素,也有上述相同的变化,即:元素化合价的最高正价与最外层电子数相同;其最高正价随着原子序数的递增重复出现由+1价递增至+7价的变化;从中部的元素开始有负价,负价是从-4递变到-1。