茚三酮比色法测定赖氨酸含量
- 格式:doc
- 大小:76.00 KB
- 文档页数:3


茚三酮比色法测定游离氨基酸含量原理:茚三酮与氨基酸的反应分两步进行,首先是氨基酸被氧化,产生二氧化碳、氨和醛,而水合茚三酮被还原成还原性茚三酮;第二步是所生成的还原性茚三酮与另一个水合茚三酮分子和氨缩合生成成为蓝紫色化合物,该化合物颜色的深浅与氨基酸的含量成正比。磷酸缓冲液(pH.8.04):称磷酸二氢钾4.5350 g,定容500 ml。
称NAH2PO4·12H2O11.9380 g分别溶解定容500 ml。
取磷酸二氢钾10 ml与磷酸氢二钠190ml混合即为pH8.04的缓冲液2%茚三酮溶液:称取水合茚三酮 2 g,加水溶解后定容至 100 mL。
储成于棕色瓶中,避光保存。
0.25%抗坏血酸溶液:称取抗坏血酸 0.1 g,加水溶解后定容至 100 mL,现配现用,或者密封,冻存于-20 o C。
茚三酮反应液:取50 ml 2% 茚三酮,加入5 ml 0.25%的Vc,使用蒸馏水稀释到100 ml,密封储存在棕色瓶中。
亮氨酸标准液:称取 100 mg 亮氨酸(纯度不低于 99%)溶于 100 mL 水中,作为母液,此时亮氨酸的浓度为1 mg/mL。
茚三酮标准曲线制作溶液中氨基酸的浓度如果低于20 μg/ml,茚三酮显色反应将不能发生,故先配制不同浓度的氨基酸标准液,取十支试管,标号为1,2,3……10,按照下表配制1 2 3 4 5 6 7 8 9 10 11 120.4 0.5 0.6 0.7 0.8 0.9 1 1.1 1.2 1.3 1.4 1.5 1000 μg/ml亮氨酸超纯水 ml 9.6 9.5 9.4 9.3 9.2 9.1 9 8.9 8.8 8.7 8.6 8.5 亮氨酸 终浓度μg/ml 405060708090100110120130140150使用螺旋盖(内垫)试管分别取上述浓度的氨基酸标准液1ml,空白对照使用1ml 超纯水替代氨基酸标准液,然后向各个试管中加入0.5 ml 的茚三酮反应液和0.5 ml 的磷酸缓冲液,盖好盖子悬紧,置于沸水浴中煮沸15 min,分别加入3 ml 的超纯水,斡旋混匀,测定吸光度,绘制标准曲线取一支中等程度显色的试管进行紫外和可见波段的全波长扫描,结果如下图所示3004005006007008000.00.10.20.30.40.50.60.7吸光度波长(nm )403 nm565 nm选择565 nm 作为其最大吸收波长,测定各管的吸光度,弃去吸光度大于1的值 茚三酮终浓度(μg/mL) 565 nm 的吸光度 20 0.037 25 0.114 30 0.226 35 0.347 40 0.412 45 0.538 500.62155 0.692 60 0.754 65 0.834 700.968使用origin 8.5 绘制散点图并进行线性拟合,结果如下图所示0.00.20.40.60.81.0O D 565氨基酸浓度(μg/mL )注意事项:1. 茚三酮比色受测定环境中的pH 影响很大,故每次测定前需要将样品溶液的pH 值调整到中性(pH7左右),2. 茚三酮不光可以与氨基酸反应,与蛋白质同样可以反应,因此需要在测定前去除溶液中的蛋白质,因此正确做法是:向样品溶液中加入等体积等0.6 mol/L 三氯乙酸,斡旋震荡,静置10 min 后,3000 rpm 离心10 min,取上清调整pH 值至中性pH7左右,再进行测定,3. 稀释倍数的确定:因为标准曲线的测定范围为20-70 μg/mL,即20-70 mg/L,所以在不清楚你所要检测样品中氨基酸的浓度时,最好取部分样品稀释10倍和100倍,分别检测原液、十倍稀释液和100倍稀释液的OD565,发现哪个水平下OD565落在标准曲线的范围内,从而判断需要对样品稀释多少倍4. 标准曲线测定时最好选择密封性较好的试管(螺旋盖硅胶内垫),同时需要检查气密性,防止水浴蒸发导致计量误差或者使用10 mL 具塞比色管,以方便在水浴之后可以准确补水。

茚三酮比色法测定游离氨基酸含量原理:茚三酮与氨基酸的反应分两步进行,首先是氨基酸被氧化,产生二氧化碳、氨和醛,而水合茚三酮被还原成还原性茚三酮;第二步是所生成的还原性茚三酮与另一个水合茚三酮分子和氨缩合生成成为蓝紫色化合物,该化合物颜色的深浅与氨基酸的含量成正比。磷酸缓冲液(pH.8.04):称磷酸二氢钾4.5350 g,定容500 ml。
称NAH2PO4·12H2O11.9380 g分别溶解定容500 ml。
取磷酸二氢钾10 ml与磷酸氢二钠190ml混合即为pH8.04的缓冲液2%茚三酮溶液:称取水合茚三酮 2 g,加水溶解后定容至 100 mL。
储成于棕色瓶中,避光保存。
0.25%抗坏血酸溶液:称取抗坏血酸 0.1 g,加水溶解后定容至 100 mL,现配现用,或者密封,冻存于-20 o C。
茚三酮反应液:取50 ml 2% 茚三酮,加入5 ml 0.25%的Vc,使用蒸馏水稀释到100 ml,密封储存在棕色瓶中。
亮氨酸标准液:称取 100 mg 亮氨酸(纯度不低于 99%)溶于 100 mL 水中,作为母液,此时亮氨酸的浓度为1 mg/mL。
茚三酮标准曲线制作溶液中氨基酸的浓度如果低于20 μg/ml,茚三酮显色反应将不能发生,故先配制不同浓度的氨基酸标准液,取十支试管,标号为1,2,3……10,按照下表配制1 2 3 4 5 6 7 8 9 10 11 120.4 0.5 0.6 0.7 0.8 0.9 1 1.1 1.2 1.3 1.4 1.5 1000 μg/ml亮氨酸超纯水 ml 9.6 9.5 9.4 9.3 9.2 9.1 9 8.9 8.8 8.7 8.6 8.5 亮氨酸 终浓度μg/ml 405060708090100110120130140150使用螺旋盖(内垫)试管分别取上述浓度的氨基酸标准液1ml,空白对照使用1ml 超纯水替代氨基酸标准液,然后向各个试管中加入0.5 ml 的茚三酮反应液和0.5 ml 的磷酸缓冲液,盖好盖子悬紧,置于沸水浴中煮沸15 min,分别加入3 ml 的超纯水,斡旋混匀,测定吸光度,绘制标准曲线取一支中等程度显色的试管进行紫外和可见波段的全波长扫描,结果如下图所示3004005006007008000.00.10.20.30.40.50.60.7吸光度波长(nm )403 nm565 nm选择565 nm 作为其最大吸收波长,测定各管的吸光度,弃去吸光度大于1的值 茚三酮终浓度(μg/mL) 565 nm 的吸光度 20 0.037 25 0.114 30 0.226 35 0.347 40 0.412 45 0.538 500.62155 0.692 60 0.754 65 0.834 700.968使用origin 8.5 绘制散点图并进行线性拟合,结果如下图所示0.00.20.40.60.81.0O D 565氨基酸浓度(μg/mL )注意事项:1. 茚三酮比色受测定环境中的pH 影响很大,故每次测定前需要将样品溶液的pH 值调整到中性(pH7左右),2. 茚三酮不光可以与氨基酸反应,与蛋白质同样可以反应,因此需要在测定前去除溶液中的蛋白质,因此正确做法是:向样品溶液中加入等体积等0.6 mol/L 三氯乙酸,斡旋震荡,静置10 min 后,3000 rpm 离心10 min,取上清调整pH 值至中性pH7左右,再进行测定,3. 稀释倍数的确定:因为标准曲线的测定范围为20-70 μg/mL,即20-70 mg/L,所以在不清楚你所要检测样品中氨基酸的浓度时,最好取部分样品稀释10倍和100倍,分别检测原液、十倍稀释液和100倍稀释液的OD565,发现哪个水平下OD565落在标准曲线的范围内,从而判断需要对样品稀释多少倍4. 标准曲线测定时最好选择密封性较好的试管(螺旋盖硅胶内垫),同时需要检查气密性,防止水浴蒸发导致计量误差或者使用10 mL 具塞比色管,以方便在水浴之后可以准确补水。

比色分析赖氨酸一、茚三酮显色液的制备1、分析纯茚三酮10g,分析纯二水氯化铜13.4g,柠檬酸盐缓冲液125ml,分析纯乙二醇甲醚375ml混合溶解后定容到1L,储存于冰箱。
2、柠檬酸盐缓冲液的制备柠檬酸10.6g和固体NaOH4.2g溶解于200ml蒸馏水并混合均匀,用盐酸调PH至1.3后,加蒸馏水定容250ml,放入冰箱。
二、标准赖氨酸溶液的制备1、取赖氨酸盐酸液标准品于105℃烘干3小时;2、制备标准溶液(1g/dl)取1g/dl-----2ml加入98ml水=20mg/dl3ml加入97ml水=30mg/dl4ml加入96ml水=40mg/dl5ml加入95ml水=50mg/dl存于冰箱里,使用期限不得超过一个月。
赖氨酸标准曲线:用标准赖氨酸溶液20、30、40、50mg/dl依次测定并绘制标准曲线,赖氨酸=(OD+0.138 )×稀释倍数÷10000.218范围=20~50mg/dl(OD=0.298~0.952)三、样品溶液的制备1、样品溶液赖氨酸的浓度必须稀释到2020~50mg/dl之间;2、取1、制备的样品于离心机离心5分钟(转速大于2500);3、取离心分离后的上清液进行分析;4、标准曲线和样品的测定步骤取0、20、30、40、50mg/ml溶液各1ml并且分别加入1.0ml茚三酮显色液于沸水中加热15分钟,冰水冷却10分钟后加8.0ml的纯水再用分光光度计于475nm处测定;取酸样品溶液的上清液1.0ml并且加入1.0ml茚三酮显色液于沸水中加热15分钟,冰水冷却10分钟后加8ml的纯水再用分光光度计于475nm处测定;然后把上面的数据记录下来。
5、根据数据得到不同的斜率值,如:LYS酸度=33.590×OD+7.3四、OD值的测定开722分光光度计,调整波长562nm预热20min;空白:调节到“T”档,在“开合”状态下分别显示0和100,反复数次,直到稳定为止;样品:调节档“A”,放入样品(0.2ml样品+5ml水),调节波长到1和0.001为准,然后测定。

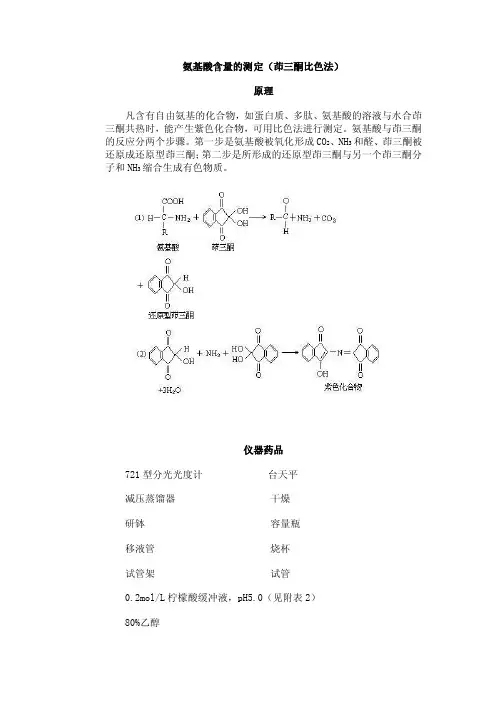
氨基酸含量的测定(茚三酮比色法)原理凡含有自由氨基的化合物,如蛋白质、多肽、氨基酸的溶液与水合茚三酮共热时,能产生紫色化合物,可用比色法进行测定。
氨基酸与茚三酮的反应分两个步骤。
第一步是氨基酸被氧化形成CO2、NH3和醛、茚三酮被还原成还原型茚三酮;第二步是所形成的还原型茚三酮与另一个茚三酮分子和NH3缩合生成有色物质。
仪器药品721型分光光度计台天平减压蒸馏器干燥研钵容量瓶移液管烧杯试管架试管0.2mol/L柠檬酸缓冲液,pH5.0(见附表2)80%乙醇10mmol/L KCN:称取0.1638gKCN溶于蒸馏水中,稀释至250ml备用(注意:KCN剧毒!)KCN-乙二醇甲醚-茚三酮溶液*:称取1.25g重结晶茚三酮溶于25ml 经重蒸馏的乙二醇甲醚中使成5%溶液。
将2.5ml10mmol/L KCN溶液用乙二醇甲醚溶液稀释至125ml充分混合。
然后将125mlKCN—乙二醇甲醚溶与25ml茚三酮-乙二醇甲醚溶液相混合,置试剂瓶待用,正常情况下应为浅黄色。
标准氨基酸溶液:称取亮氨酸20mg溶于10ml蒸馏水中,则得浓度为200μg/ml的母液。
上述所有试剂必须放在草酸保护的干燥器中,以免被空气中的NH3所污染。
乙二醇甲醚(CH3OCH2CH2OH, methyl cellusolve)的处理:将5g硫酸亚铁加在500g乙二醇甲醚中,振摇1─2小时。
过滤除去硫酸亚铁(若滤液混浊没有关系),再在蒸馏瓶中蒸馏,收集沸点121─125℃部分,此时应为透明无色液体。
KCN-乙二醇甲醚-茚三酮溶液配制后必须隔夜才能应用。
配制后1星期内稳定,若超过1星期则灵敏度降低,不宜作定量。
茚三酮重结晶:即使AR级的茚三酮,由于保管不当,常带微红色,配成溶液后也带红色,影响比色测定,故需重结晶一次方可应用。
5g茚三酮溶于15ml热蒸馏水中,加入0.25g活性炭,轻轻摇动,若溶液太稠不易操作,可酌量加水5─10ml,30分钟后用滤纸过滤,滤液放冰箱中过液,次晨即见微黄色结晶出现,过滤,再以1ml冷水洗涤结晶,置于干燥器中干燥,最后装入棕色试剂瓶中保存。



茚三酮比色法测定水中微量氨含量应贤强【摘要】在一定酸度和温度条件下,氨能与茚三酮和还原性茚三酮反应生成蓝紫色化合物.依据此原理,通过系列条件试验,确定了显色剂、还原剂、缓冲液的加入量和显色时间,建立了不使用剧毒试剂(氯化高汞)测定水中微量氨含量的比色分析法.通过标准曲线试验、精密度试验、回收率试验和对比试验,验证了该测定方法准确、可靠.%Under fixed acidity and temperature conditions, ammonia can react with ninhydrin and reductive ninhydrin to give a bluish violet compound. Based on this principle and through a series of conditional tests, the developer, reducer, buffering solution additions and development time are ascertained, and the colorimetric analytical process is established to determine the trace ammonia content in water without the use of highly toxic reagent ( mercuric chloride). The determination method is verified to be accurate and reliable by the use of the standard curve, precision, percent recovery and contrast tests.【期刊名称】《化肥工业》【年(卷),期】2011(038)003【总页数】4页(P27-30)【关键词】茚三酮;比色法;测定;氨含量【作者】应贤强【作者单位】重庆建峰化工股份有限公司,涪陵,408601【正文语种】中文目前,水中微量氨含量的测定方法采用纳氏试剂比色法,其纳氏试剂的配制需用氯化高汞(HgCl2),而氯化高汞试剂为剧毒品,所以存在采购和运输的问题。


通常所说的赖氨酸指的是L-赖氨酸盐酸盐,蛋氨酸指的是DL-蛋氨酸,是畜禽饲料中广泛应用的两种氨基酸添加剂,是高价饲料原料,掺假情况严重,有可能掺入面粉、麦乳精、淀粉、葡萄糖粉、滑石粉、轻质碳酸钙等廉价低质物质,给饲料企业造成很大的经济损失,掌握赖氨酸和蛋氨酸的真假鉴别方法十分必要。
1感官鉴别法赖氨酸盐酸盐为白色或淡黄或淡褐色粉末或无规则小颗粒状,无味或稍有特异酸味,带有甜酸味,无口涩感;掺假赖氨酸通常色泽异常,气味不正,个别有氨水刺激或芳香气味,口尝有杂质样涩感,口味不正。
蛋氨酸为纯白或微带黄色,有光泽结晶,呈半透明小结晶状或成针状物,具有反光性,手感滑腻,有特殊的臭味,用食指蘸一点,放在舌尖上有甜味。
掺假的蛋氨酸为黄色或灰色,多呈粉末状,无光泽或少光泽,有怪味和涩感,若有掺入麦乳精,则特别甜。
2物理鉴别法2.1溶解性赖氨酸易溶于水,难溶于乙醇和乙醚;蛋氨酸溶于稀盐酸和稀氢氧化钠溶液,略难溶于水,难溶于乙醇,不溶于乙醚。
取2~5g赖氨酸或蛋氨酸样品加入100mL水中,搅拌5min后静置,若有沉淀或飘浮物为伪劣产品。
2.2吸附性用铝制或塑料小匙插入蛋氨酸中转动几下取出,可见闪光的结晶像针一样有规则地吸附于匙的表面。
假蛋氨酸无此现象。
2.3灼烧方法赖氨酸及蛋氨酸点燃后,立刻散发出类似燃烧羽毛时产生的难闻的特殊臭味,且能迅速燃尽,基本无残渣。
燃烧产生的烟为碱性气体,可使湿的pH试纸变蓝。
燃烧不完全,有明显的残渣,或燃烧时不产生此种气味或气味较淡,则为伪劣产品。
3化学鉴别法3.1茚三酮反应法取赖氨酸样品0.5~1g(蛋氨酸样品0.1g),溶于100mL蒸馏水中,取此溶液5ml,加入0.1%茚三酮溶液1mL,加热3min,再加蒸馏水20mL,静置15min,溶液呈红紫色,则为真品。
3.2碘试剂法取少量赖氨酸或蛋氨酸样品置于表面皿中,滴加数滴碘水试剂(或医用碘酒),真品颜色不变。
取样品约2~5g,加蒸馏水100mL溶解,滴加碘-碘化钾溶液(碘化钾1g、碘0.3g溶于100mL水中),摇动,若溶液变蓝色,则说明样品中掺入面粉或其他植物成分。
茚三酮鉴定氨基酸概述1.茚三酮简介茚三酮(Ninhydrine),又称水合茚三酮,水合茚满三酮,为白色或浅黄色结晶性粉末。
茚三酮是一种用于检测氨或者一级胺和二级胺的试剂。
当与这些游离胺反应时,能够产生深蓝色或者紫色的物质,叫做Ruhemann紫。
茚三酮常用来检测指纹,这是由于指纹表面所蜕落的蛋白质和肽中含有的赖氨酸残基,其上的一级胺被茚三酮检测。
在室温条件下,它是一种白色的固体物质,溶于乙醇和丙酮。
茚三酮可以看作是是二氢茚-1,2,3-三酮的水合物。
1901 年,茚三酮被成功研制出来以后主要用于生物医学领域,1954年,瑞典科学家Oden 和Hofsten 将其应用于潜在汗液手印的显现。
茚三酮与汗液中的氨基酸、多肽、蛋白质等发生反应, 生成蓝紫色的手印纹线。
茚三酮也可以用于蛋白质的氨基酸分析。
除去脯氨酸之外的大多数氨基酸,水解之后可与茚三酮反应。
水解中某些氨基酸的侧链也会被降解。
因此对于那些与茚三酮不反应或者发生其他反应的氨基酸需要另作分析。
其余的氨基酸经过色谱分离后可以比色定量。
在分析化学反应的薄层色谱(TLC)中,它可以用于检测所有的胺类,氨基甲酸酯类,在经过充分热处理后可以检测酰胺类物质。
2.实际运用2.1指纹鉴别汗液手印中的汗液成分绝大多数是水(约99%以上),其余是少量的无机物和有机物,有机物中包括了人体所含有的各种氨基酸。
茚三酮与手印汗液中的氨基酸发生显色反应而现出手印。
二氧化碳中的碳原子来源于氨基酸当茚三酮与氨基酸反应时可以释放CO2的羧基碳。
在考古研究中,这个反应用于释放古老骨骼中羧基碳用于稳定同位素分析,以帮助重现古代生物的食物结构。
用一种标记底物处理的土壤,随后利用茚三酮与氨基酸的反应释放羧基胺,可以证明这种底物是否被吸收进微生物蛋白质。
这种方法成功的发现了一些氨氧化细菌(也叫做硝化细菌)利用土壤中的尿素作为碳源。
法医常用茚三酮溶液分析诸如纸张等多孔表面上的潜指纹。
手指所分泌的细微汗液聚集于独特的手指纹路表面,也即含有氨基酸的指纹,经过茚三酮处理可以将氨基酸指尖纹路变为可见的紫色。
茚三酮测赖氨酸的原理茚三酮是一种常用的荧光染料,它可以被应用于生物医学研究领域中的许多实验中,包括测定赖氨酸。
测定赖氨酸的方法主要基于茚三酮与赖氨酸之间的化学反应,并通过测量荧光信号的强度来定量赖氨酸的浓度。
赖氨酸是一种重要的氨基酸,广泛存在于生物体内,尤其是在蛋白质中。
测定赖氨酸的方法非常重要,可以帮助科研人员了解蛋白质的组成和结构特征,对于生物学研究和药物开发有着重要的意义。
茚三酮在氢氧化钠(NaOH)存在下可以与赖氨酸发生环合反应,生成一种带有强荧光的产物。
具体反应机理如下:首先,将茚三酮溶解在NaOH溶液中,此时茚三酮会被氢氧根离子(OH^-)参与质子转移反应,生成一个负离子A^-。
这个负离子A^-非常稳定,具有强荧光特性。
接下来,茚三酮的负离子A^-会与赖氨酸产生酸碱中和反应。
茚三酮的负离子带有正电荷,可以与赖氨酸的负电荷结合,形成稳定的环状结构。
这个环状结构形成后,茚三酮的荧光特性会发生显著改变。
一般来说,茚三酮溶液中的荧光会因内部结构的空间约束而猝灭,导致荧光强度降低。
但是与赖氨酸反应后,形成的环状结构可以有效地保护茚三酮分子的荧光发射,使得荧光强度大幅度增加。
通过测量茚三酮-赖氨酸产物的荧光强度,可以得出赖氨酸浓度的信息。
一般来说,茚三酮的荧光峰位在约420nm附近,可以使用紫外光谱仪或荧光仪来测量荧光信号的强度。
使用茚三酮测定赖氨酸的方法具有灵敏度高、快速简便、操作方便和比较准确的特点,被广泛应用于实验室中的赖氨酸测定实验。
此外,这种方法还可以同时测定其他一些氨基酸,例如苏氨酸和组氨酸等。
需要注意的是,在实际操作中,茚三酮的使用量和NaOH的浓度需要根据样品条件进行优化。
过高或过低的浓度都可能对实验结果产生干扰。
此外,茚三酮和赖氨酸的反应也会受到pH值、温度和离子强度等因素的影响,因此需要进行适当的实验条件优化和控制。
总之,茚三酮可以与赖氨酸发生特异反应,生成强荧光产物,通过测量荧光信号的强度可以定量测定赖氨酸的浓度。
实验五、维生素C的定量测定(碘量法)一、目的:掌握测定维生素C含量的方法二、原理:利用碘酸钾作氧化剂,即在一定量的盐酸酸性试液中加碘化钾-淀粉指示剂,用已知的浓度的碘酸钾滴定,滴入的碘酸钾释放出游离的碘,此碘液被维生素C还原,直到VC 完全氧化后,再滴入碘酸钾(KIO3)时,因无VC的作用,游离的碘可使淀粉指示剂呈蓝色。
即为终点。
反应如下:KIO3+5KI+6HCI→6KCI+3H2O+3I2C 6H8O6+I2= C6H6O6+2HI抗坏血酸脱氢抗坏血酸三、材料:梨、苹果、桔子四、试剂、仪器滴定架+滴定管+沙网移液管(1ml) 2个(5ml) 2个三角瓶 1个容量瓶(25ml) 1个吸耳球 1个研钵 1套试剂如下:① 2%盐酸:取36.6%的盐酸110ml 加入到蒸馏水中,定容至2000ml即公式:36.6%·X=2%·Y,Y设定为1000或2000ml② 0.5%淀粉液:称取5克可溶性淀粉,先用水将淀粉调至浆状,后加水至1000ml 煮沸,或用煮沸的蒸馏水配制。
② 0.000167 mol/L 碘酸钾溶液:精确称取碘酸钾0.3568克,定容至1000ml,得到0.00167mol/L 碘酸钾溶液,再稀释10倍,得到0.000167mol/L 碘酸钾溶液。
(100ml 母液+蒸馏水至1000ml ) ④ 1%碘化钾,1克碘化钾+蒸馏水至100ml 五、方法与步骤 1、样品液制备①样品洗净,拭干水分,去皮、去核。
②称取5克放入研钵中,加入2%HCI 2ml ,研磨至浆状,用沙网过滤③移入容量瓶中,用2% 盐酸冲洗2~3次,后并入容量瓶中,用2%盐酸定容至25ml,摇匀,放置半小时(暗处) 2、滴定①在三角瓶中,用移液管注入1% KI 液 0.5ml 1% KI 液 0.5ml 0.5%淀粉液 1 ml 另空白对照试验 0.5%淀粉液 1 ml 样品提取液 5ml (共10ml ) 2%盐酸 5ml 蒸馏水 3.5ml 蒸馏水 3.5ml用0.000167mol/L 碘酸钾滴定,要一滴滴加入,并时时摇动三角瓶,至微兰色不褪为终点(1分钟不褪即可),记录所用碘酸钾毫升数。
茚三酮比色法测定赖氨酸含量一. 目的了解赖氨酸总含量的测定方法。
掌握用比色法测定谷物类样品中赖氨酸含量。
二. 原理蛋白质中的赖氨酸残基上具有一个游离的e-NH2,它与茚三酮起颜色反应呈蓝紫色,在波长570nm处其颜色的深浅在一定范围内与赖氨酸残基的含量成线性关系。
亮氨酸与赖氨酸的碳原子数目相同,它仅有的一个氨基(a-NH2)相当于蛋白质中赖氨酸残基上的e-NH2,因而可以用亮氨酸标准液制作标准曲线来测定蛋白质中赖氨酸的含量。
但计算浓度时必须乘上两种氨基酸的分子量之比(赖氨酸与亮氨酸分子量之比为1.11:1)。
式中W:样品质量C :样品中游离氨基酸的量,各种作物种子中游离氨基酸的含量大约是:玉米:0.01%,高粱:0.04%,水稻:0.01%,小麦:0.05%X :从标准曲线查得的赖氨酸的质量三. 实验材料及设备1. 材料玉米粉2. 仪器分光光度计分析天平恒温水浴3. 器材刻度试管:25mL×11移液管:1mL×1 2mL×2 20mL×1烧杯:250mL×2 50mL×1滴管:2洗耳球:2滤纸:f11cm研钵、漏斗、洗瓶、试管架、移液管架、玻棒:各1四. 试剂的配制1. 柠檬酸缓冲液(0.2mol/L,pH5.6)(参见附录二)2. 茚三酮试剂称3g茚三酮溶于100mL 95%乙醇中,溶解后加入160mg二氯化锡,搅拌溶解后加入100mL柠檬酸缓冲液中,搅匀备用。
3. 亮氨酸标准液(50mg/mL)准确称取5mg亮氨酸,用蒸馏水稀释定容到100mL,则得浓度为50mg/mL的标准液。
五. 操作步骤1. 样品液的制备(1) 取材:称取烘干、粉碎(过80目筛)的玉米粉0.3g(油料种子须经脱脂处理)。
(2) 提取:将称取的样品放入试管,准确加入20mL蒸馏水,摇匀。
读取样品悬液的总体积mL,置于80℃恒温水浴中提取20min。
(可间歇摇动)(3) 定容:冷却后,用蒸馏水将试管中悬液定容至(2)中悬液总体积刻度mL,,即最终样品液总定容体积仍为20mL,摇匀。
茚三酮比色法测定赖氨酸含量
一. 目的
了解赖氨酸总含量的测定方法。
掌握用比色法测定谷物类样品中赖氨酸含量。
二. 原理
蛋白质中的赖氨酸残基上具有一个游离的e-NH2,它与茚三酮起颜色反应呈蓝紫色,在波长570nm处其颜色的深浅在一定范围内与赖氨酸残基的含量成线性关系。
亮氨酸与赖氨酸的碳原子数目相同,它仅有的一个氨基(a-NH2)相当于蛋白质中赖氨酸残基上的e-NH2,因而可以用亮氨酸标准液制作标准曲线来测定蛋白质中赖氨酸的含量。
但计算浓度时必须乘上两种氨基酸的分子量之比(赖氨酸与亮氨酸分子量之比为1.11:1)。
式中W:样品质量
C :样品中游离氨基酸的量,各种作物种子中游离氨基酸的含量大约是:玉米:0.01%,高粱:0.04%,水稻:0.01%,小麦:0.05%
X :从标准曲线查得的赖氨酸的质量
三. 实验材料及设备
1. 材料
玉米粉
2. 仪器
分光光度计分析天平恒温水浴
3. 器材
刻度试管:25mL×11
移液管:1mL×1 2mL×2 20mL×1
烧杯:250mL×2 50mL×1
滴管:2
洗耳球:2
滤纸:f11cm
研钵、漏斗、洗瓶、试管架、移液管架、玻棒:各1
四. 试剂的配制
1. 柠檬酸缓冲液(0.2mol/L,pH5.6)(参见附录二)
2. 茚三酮试剂
称3g茚三酮溶于100mL 95%乙醇中,溶解后加入160mg二氯化锡,搅拌溶解后加入100mL柠檬酸缓冲液中,搅匀备用。
3. 亮氨酸标准液(50mg/mL)
准确称取5mg亮氨酸,用蒸馏水稀释定容到100mL,则得浓度为50mg/mL的标准液。
五. 操作步骤
1. 样品液的制备
(1) 取材:称取烘干、粉碎(过80目筛)的玉米粉0.3g(油料种子须经脱脂处理)。
(2) 提取:将称取的样品放入试管,准确加入20mL蒸馏水,摇匀。
读取样品悬液的总体积mL,置于80℃恒温水浴中提取20min。
(可间歇摇动)
(3) 定容:冷却后,用蒸馏水将试管中悬液定容至(2)中悬液总体积刻度
mL,,即最终样品液总定容体积仍为20mL,摇匀。
(4) 过滤:将提取液用滤纸过滤,收集滤液作为待测样(滤纸不能用蒸馏水湿润)。
2. 标准曲线制作及样品测定
取9支刻度试管,按下表所示顺序操作。
六. 结果处理
1. 由0~6号管的数据,以亮氨酸含量(mg)为横坐标,A570为纵坐标,在坐标纸上绘制标准曲线;
2. 求样品管A570的平均值570;
3. 由530从标准曲线中求样品管中赖氨酸的含量(mg);
4. 计算你所取生物材料中赖氨酸的含量(单位用mg/mg样重)。