高一化学必修一知识点:氧化还原反应(人教版)
- 格式:docx
- 大小:38.42 KB
- 文档页数:5

2.3氧化还原反应➢ 氧化还原反应基本概念1.特征:有元素化合价的升降。
(判断依据)2.本质:电子的转移。
3.规律:升失氧化还原剂,降得还原氧化剂。
✧ 还原剂,具有还原性,化合价升高,失去电子,被氧化,发生氧化反应,得到氧化产物。
✧ 氧化剂,具有氧化性,化合价降低,得到电子,被还原,发生还原反应,得到还原产物。
4.转移电子的表示方法:(1)双线桥 变价元素由反应物指向生成物,上方标明 得/失 变价元素原子数╳每个原子化合价改变量 如:① H 2 + CuO === Cu + H 2O ② MnO 2 + 4HCl(浓)=== MnCl 2 + Cl 2↑+2H 2O则①中1mol H 2反应的转移电子数为 。
②中生成1molCl 2的转移电子数为 。
注:转移电子数与反应中各物质系数成正比。
(2)单线桥 反应物中失电子元素指向得电子元素,上方直接标明转移电子数目,不需要写得/失。
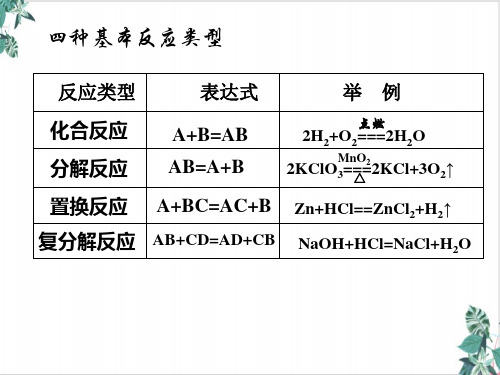
H 2 + CuO === Cu + H 2O5.氧化还原反应与四种基本反应类型的关系 :6. 常见的氧化剂和还原剂✧ 常见氧化剂:Cl 2、Br 2、O 2、O 3、浓H 2SO 4、HNO 3、KMnO 4、KClO 3、K 2Cr 2O 7、Fe 3+、HClO 、ClO -、MnO 2、H 2O 2、Na 2O 2等等等✧ 常见还原剂: 金属、S 2-、HS 、H 2S 、S 、SO 2、 SO 32-、 HSO 3-、 I - 、Fe 2+ 、Br - 、Cl -等等等➢ 题型1 概念理解判断( )1.有失去电子的反应为还原反应( )2.含有氧元素的物质是氧化剂( )3.氧化剂得到电子的数目和还原剂失去电子的数目一定相等( )4.有一种元素被氧化必定有另一种元素被还原( )5.有单质参与的反应一定是氧化还原反应( )6.置换反应不一定属于氧化还原反应( )7.在反应中不一定所以元素的化合价都发生变化( )8.在化学反应中,得电子越多的氧化剂,其氧化性越强➢ 题型2 转移电子数计算 1.下列表示反应中电子转移的方向和数目正确的是( )A .B .C .D .2.实验室常用KMnO 4和浓盐酸反应制备Cl 2化学方程式如下,2KMnO 4+16HCl (浓)=2KCl+2MnCl 2+5Cl 2↑氧化剂+还原剂→还原产物+氧化产物 硫碘铁溴+8H2O下列说法不正确的是()A.Cl2是氧化产物B.有0.8mol的HCl被氧化时,标况下生成Cl2 5.6LC.KMnO4是氧化剂D.每8mol HCl参加反应,转移电子的物质的量为5mol3.下列反应中水的作用是:(填序号)①2Na+2H2O==2NaOH+H2↑②2H2O==2H2↑+O2↑③Cl2+H2O==HCl+HClO④3NO2+H2O==2HNO3+NO ⑤2F2+2H2O==4HF+O2(1)水作只还原剂;(2)水只作氧化剂;(3)水既作氧化剂也作还原剂;(4)水既不是氧化剂也不是还原剂。




氧化还原反应的基本规律1、守恒规律氧化还原反应中,氧化剂得到电子总数等于氧化剂失去的电子总数,表现为化合价升高总数等于化合价降低总数。
2、强弱规律对于氧化还原反应“氧化剂+还原剂====还原产物+氧化产物”能进行,则满足:氧化性:氧化剂>氧化产物还原性:还原剂>还原产物3、价态规律当元素具有可变化合价时,一般情况下:例如,浓H2SO4中的S只具有氧化性,H2S中的S只具有还原性,单质S既具有氧化性也具有还原性。
4.先后规律在浓度相差不大的溶液中(1)如果一种氧化剂遇到了几种还原剂时,将按照还原性由强到的顾序依次反应。
例如:Zn、Fe同时加入盐酸中,还原性Zn>Fe,则Zn先与盐酸反应。
(2)如果一种还原剂遇到了几种氧化剂时,将按照氧化性由属到弱的顺序依次反应。
例如在含有Fe2+、Cu2+的溶液中加入锌粉,氧化性:Cu2+>Fe2+,则锌粉先与Cu2+反应,然后再与Fe2+反应5.归中规律例如:守恒法在金属与硝酸反应计算中的应用1、某稀硫酸和稀硝酸的混合溶液中c(NO3-)+c(SO42-)=2.5mol/L,取200mL该混合酸,则能溶解铜的最大质量为()A. 12.8gB. 19.2gC. 32.0gD. 38.4g通过离子方程式进行计算2、锌和某浓度的HNO3反应时,若参加反应的锌与HNO3的物质的量之比为2:5,产物有硝酸锌、X和水,则X可能是()A、NH4NO3B、N2OC、N2O3D、NO23、将38.4g铜与150mL一定浓度的硝酸反应,铜完全溶解,产生的NO和NO2混合气体在标准状况下的体积为11.2L,请回答:①NO2的体积为___L.②若铜与硝酸刚好反应完全,则原硝酸溶液的浓度为___mol•L-1.4、在某100 mL的混合液中,硝酸和硫酸的物质的量浓度分别是0.4 mol/L、0.1 mol/L,向该混合液中加入1.92 g铜粉,加热,待充分反应后,所得溶液中铜离子物质的量浓度是()A.0.15 mol/L B.0.225 mol/L C.0.30 mol/L D.0.45 mol/L5、R2O6n-在一定条件下可以把Mn2+氧化成MnO4-,若反应后R2O6n-转变为RO3n-.又知反应中氧化剂与还原剂的物质的量之比为5:2,则n值为()6、已知2Fe2++Br2═2Fe3++2Br−往100mL溴化亚铁溶液中缓慢通入2.24L(标准状况)氯气,反应完成后溶液中有1/3的溴离子被氧化成溴单质。





高一化学氧化还原反应的知识点氧化还原反应是化学中的重要概念之一,也是高中化学课程中的核心内容之一。
它涉及到物质的电荷转移和原子的氧化态变化。
本文将介绍高一化学氧化还原反应的知识点,帮助同学们更好地理解和掌握这一重要概念。
一、氧化还原反应的基本概念在化学中,氧化还原反应是指物质中电荷转移的过程。
其中,被氧化物失去电子,被还原物得到电子。
根据这个定义,氧化剂是指能够接受电子的物质,而还原剂是指能够提供电子的物质。
二、氧化还原反应的特征1.原子的氧化态发生变化在氧化还原反应中,物质中某些原子的氧化态会发生变化。
被氧化物的原子的氧化态会增加,而还原剂的原子的氧化态会减少。
2.电子的转移氧化还原反应涉及到电子的转移。
被氧化物会失去电子,而还原剂会接受这些电子。
三、氧化还原反应的符号表示氧化还原反应可以使用半反应式来表示。
半反应式指示了原子或离子在氧化还原反应中的氧化态变化和电子转移。
例如,对于还原剂A和氧化剂B反应的情况,可以表示为:A → A+ + e-B+ + e- → B在半反应式中,箭头的左侧代表氧化剂的原子或离子,箭头右侧代表还原剂的原子或离子。
箭头上方的小数字表示氧化剂或还原剂在电子转移过程中失去或获得的电子数目。
四、常见的氧化还原反应类型1.金属与非金属的反应金属与非金属的反应通常涉及非金属原子从阴离子化合物中转移到金属原子形成阳离子化合物的过程。
例如,铁(Fe)与硫(S)的反应可以表示为:2Fe + 3S → Fe2S3在这个反应中,硫原子从S2-离子转移到铁原子上,形成Fe2+和S2-之间的离子化合物。
2.酸和碱的反应酸和碱的反应也是氧化还原反应。
在酸和碱反应的过程中,酸质子被还原剂(一般是碱)接受,形成水和盐。
例如,硫酸与氢氧化钠的反应可以表示为:H2SO4 + 2NaOH → Na2SO4 + 2H2O在这个反应中,硫酸作为酸质子的提供者失去质子,被氢氧化钠接受,生成水和硫酸钠。
五、氧化还原反应的应用氧化还原反应广泛应用于日常生活和工业生产中。



第一章 物质及其变化 第一节 氧化还原反应 第1讲 氧化还原反应概念及表示【讲】知识点1多角度认识氧化还原反应 1.从得失氧的角度认识氧化还原反应氧化反应:物质得到氧的反应叫做氧化反应,如:S + O 2SO 2 C + O 2CO 2还原反应:物质失去氧的反应叫做还原反应,如:2CuO +C=====高温2Cu +CO 2↑对于反应2CuO +C=====高温2Cu +CO 2↑:(1)氧化铜失去氧,发生还原反应,被碳还原,铜单质是 还原 产物,氧化铜是 氧化 剂。
(2)碳得到氧,发生氧化反应,被氧化铜氧化,二氧化碳是 氧化 产物,碳是 还原 剂。
失去氧的物质,发生还原反应,被还原,对应产物是还原产物,本身是氧化剂。
得到氧的物质,发生氧化反应,被氧化,对应产物是氧化产物,本身是还原剂。
氧化还原反应:一种物质得到氧发生氧化反应,同时另一种物质失去氧发生还原反应的反应。
2.从元素化合价升降的角度认识氧化还原反应(特征) (1)对于有氧元素参加的反应,分析化合价变化2CuO +C=====高温2Cu +CO 2↑ CuO +H 2=====△Cu +H 2O Fe 2O 3+3CO=====高温2Fe+3CO 2①碳化合价 升高 ,碳 得 氧,碳发生 氧化 反应,碳被氧化铜 氧化 ,二氧化碳是 氧化 产物,碳是 还原剂 剂。
②)氧化铜化合价 降低 ,氧化铜 失 氧,氧化铜发生 还原 反应,氧化铜被碳 还原 ,铜单质是 还原 产物,氧化铜是 氧化剂 剂。
化合价降低的物质,发生还原反应,被还原,对应产物是还原产物,本身是氧化剂。
化合价升高的物质,发生氧化反应,被氧化,对应产物是氧化产物,本身是还原剂。
氧化还原反应:凡是有元素 变化 的反应(2)对于无氧元素参加的反应Fe +CuSO 4=====△Cu +FeSO 4:①铁元素元素化合价 升高 ,铁单质发生 氧化 反应,铁单质被 氧化 ,FeSO 4是 氧点燃点燃化产物 ,铁单质是 还原剂 剂。


三一文库()/高一〔高一化学必修一知识点:氧化还原反应(人教版)〕一、概念判断:1、氧化还原反应的实质:有电子的转移(得失)2、氧化还原反应的特征:有化合价的升降(判断是否氧化还原反应)3、氧化剂具有氧化性(得电子的能力),在氧化还原反应中得电子,发生还原反应,被还原,生成还原产物。
4、还原剂具有还原性(失电子的能力),在氧化还原反应中失电子,发生氧化反应,被氧化,生成氧化产物。
5、氧化剂的氧化性强弱与得电子的难易有关,与得电子的多少无关。
6、还原剂的还原性强弱与失电子的难易有关,与失电子的多少无关。
7、元素由化合态变游离态,可能被氧化(由阳离子变单质),也可能被还原(由阴离子变单质)。
8、元素最高价态有氧化性,但不一定有强氧化性;元素最低价态有还原性,但不一定有强还原性;阳离子不一定只有氧化性(不一定是最高价态,,如:Fe2+),阴离子不一定只有还原性(不一定是最低价态,如:SO32-)。
9、常见的氧化剂和还原剂:10、氧化还原反应与四大反应类型的关系:【同步练习题】1.Cl2是纺织工业常用的漂白剂,Na2S2O3可作为漂白布匹后的“脱氯剂”。
S2O32-和Cl2反应的产物之一为SO42-。
下列说法不正确的是()A.该反应中还原剂是S2O32-B.H2O参与该反应,且作氧化剂C.根据该反应可判断氧化性:Cl2>SO42-D.上述反应中,每生成lmolSO42-,可脱去2molCl2答案:B点拨:该反应方程式为:S2O32-+4Cl2+5H2O===2SO42-+8Cl-+10H+,该反应中氧化剂是Cl2,还原剂是S2O32-,H2O参与反应,但既不是氧化剂也不是还原剂,故选B。
2.(2011#河南开封高三一模)分析如下残缺的反应:RO3-+________+6H+===3R2↑+3H2O。
下列叙述正确的是()A.R一定是周期表中的第ⅤA族元素B.R的原子半径在同周期元素原子中最小C.上式中缺项所填物质在反应中作氧化剂D.RO3-中的R元素在所有的反应中只能被还原答案:B点拨:RO3-中R为+5价,周期表中ⅤA、ⅦA元素均可形成RO3-离子,A错误;据元素守恒,反应中只有R、H、O三种元素,则缺项一定为R-,且配平方程式为RO3-+5R-+6H+===3R2↑+3H2O,据此可得R为ⅦA元素,B正确;R-中R处于最低价态,只能作还原剂,C错误;RO3-中R 元素处于中间价态,在反应中既可被氧化又可被还原,D项错。

氧化还原反应1.化学反应中的四种基本类型的反应 (1)化合反应定义:由两种或两种以上的物质生成一种物质的反应,叫做化合反应。
通式:A +B=AB如:2H 2+O 2=点燃2H 2OCaCO 3+CO 2+H 2O =Ca(HCO 3)2 (2)分解反应定义:由一种物质生成两种或两种以上其他物质的反应,叫做分解反应。
通式:AB=A +B 如:2KClO 3=MnO2MnO2<2-2KCl +3O 2↑NH 4HCO 32- NH 3↑+H 2O ↑+CO 2↑ (3)置换反应定义:由一种单质跟一种化合物起反应,生成另一种单质和另一种化合物的反应,叫做置换反应。
通式:A +BC=AC +B 如:Fe +CuSO=FeSO 4+Cu C +2CuO 2- ∆ 2Cu +CO 2↑ (4)复分解反应定义:由两种化合物互相交换成分,生成另外两种化合物的反应,叫做复分解反应。
通式:AB +CD=AD +CB如:Ba(OH)2+H 2SO=BaSO 4↓+2H 2O BaCl 2+Na 2SO=BaSO 4↓+2NaClMgCl 2+2NaOH=Mg(OH)2↓+2NaClCaCO 3+2HClCaCl 2+H 2CO 3CO 2↑+H 2O32232CO H CAL HCL Caco +=+2.氧化反应、还原反应是氧化反应还原反应物质失去氧的反应CuO + H 22-Cu +H 2O ,CuO 失去氧变成了单质铜,氧化铜发生了还原反应课本知识导学运用课本知识诠解 重要提示本节教材主要包括以下几部分内容 1.化学反应的分类方法初中学习的化学反应的两种分类方法不能较深入地反应化学反应的本质,也不能包括所有的化学反应。
化学反应从不同的角度有不同的分类方法。
化学反应的常见 分类方法: (1)依据反应前后 物质种类的变化 化合反应 分解反应 置换反应 复分解反应 (2)依据参加 反 应的微粒形 式(3)依据反应 中是 否有电子转移(4)依据反应的能量转化方 式2.四种基本反应类型比较化合反应分解反应置换反应复分解反应化合反应 分解反应 置换反应 复分解反应离子反应 分子反应氧化还原反应 非氧化还原反放热反应吸热反应3.氧化还原反应1.化学反应从不同的角度有不同的分类方法。

第04讲 氧化还原的基本概念知识图谱氧化还原反应的基本概念知识精讲一.氧化还原反应1.氧化还原反应的特征(1)反应过程中得氧与失氧再次认识我们初中学过的以下反应22CuO H Cu H O ++△2323CO+Fe O 2Fe+3CO 高温失去氧原子过程:CuO →Cu ,Fe 2O 3→Fe ;得到氧原子过程:H 2→H 2O ,CO →CO 2我们常把失去氧(O )原子的过程称为还原反应,得到氧(O )原子的过程称为氧化反应 (2)化合价的变化,我们常把化合价降低的反应称为还原反应,化合价升高的反应称为氧化反应 氧化还原反应的重要特征——化合价发生变化反应前后元素化合价发生变化的反应称为氧化还原反应 2.氧化还原反应的本质以Na 和Cl 2反应为例Na 原子将1个e 给了Cl 原子,Na 失去1e 后变为Na +,化合价升高,Cl 得到1e 后变为Cl ,化合价降低 由此可知:化合价升高本质为失去电子,化合价降低为得到电子另,非金属元素之间化合价升降本质为共用电子对的偏移(后面学习) 故:氧化还原的本质物质在反应的过程中,电子的得失或电子对的偏移。
二.有关氧化还原反应的概念及关系1.氧化剂: 定义:得到电子(或电子对偏向)的物质表现:所含元素化合价降低,被还原2.还原剂: 定义:失去电子(或电子对偏离)的物质表现:所含元素化合价升高,被氧化3.氧化性:氧化性是物质得电子的性质,越容易得到电子的物质,氧化性越强。
4.还原性:还原性是物质失电子的性,越容易失去电子的物质,还原性越强。
5.氧化产物:反应物中的某元素发生氧化反应的对应生成物。
6.还原产物:反应物中的某元素发生还原反应的对应生成物。
说明:在氧化还原反应中,氧化剂和还原剂可以是同一反应物,氧化产物和还原产物也可以是同一生成物。
相互关系为:总结:升—失—氧 降—得—还三.常见的氧化剂和还原剂1.在氧化还原反应过程中,氧化剂得电子,化合价降低,具有氧化性。
高一化学必修一知识点:氧化还原反应(人教版)
【导语】以下是作者为大家推荐的有关高一化学必修一知识点:
氧化还原反应(人教版),如果觉得很不错,欢迎分享~感谢你的浏览
与支持!一、概念判定:
1、氧化还原反应的实质:有电子的转移(得失)
2、氧化还原反应的特点:有化合价的升降(判定是否氧化还原反应)
3、氧化剂具有氧化性(得电子的能力),在氧化还原反应中得电子,产生还原反应,被还原,生成还原产物。
4、还原剂具有还原性(失电子的能力),在氧化还原反应中失电子,产生氧化反应,被氧化,生成氧化产物。
5、氧化剂的氧化性强弱与得电子的难易有关,与得电子的多少无关。
6、还原剂的还原性强弱与失电子的难易有关,与失电子的多少无关。
7、元素由化合态变游离态,可能被氧化(由阳离子变单质),
也可能被还原(由阴离子变单质)。
8、元素价态有氧化性,但不一定有强氧化性;元素态有还原性,
但不一定有强还原性;阳离子不一定只有氧化性(不一定是价态,,如:
Fe2+),阴离子不一定只有还原性(不一定是态,如:SO32-)。
9、常见的氧化剂和还原剂:
10、氧化还原反应与四大反应类型的关系:
【同步练习题】
1.Cl2是纺织工业常用的漂白剂,Na2S2O3可作为漂白布匹后的
“脱氯剂”。
S2O32-和Cl2反应的产物之一为SO42-。
下列说法不正确
的是()
A.该反应中还原剂是S2O32-
B.H2O参与该反应,且作氧化剂
C.根据该反应可判定氧化性:Cl2>SO42-
D.上述反应中,每生成lmolSO42-,可脱去2molCl2
答案:B
点拨:该反应方程式为:S2O32-+4Cl2+5H2O===2SO42-+8Cl-+10H+,该反应中氧化剂是Cl2,还原剂是S2O32-,H2O参与反应,但既不是氧
化剂也不是还原剂,故选B。
2.(2011•河南开封高三一模)分析以下残缺的反应:
RO3-+________+6H+===3R2↑+3H2O。
下列叙述正确的是()
A.R一定是周期表中的第ⅤA族元素
B.R的原子半径在同周期元素原子中最小
C.上式中缺项所填物质在反应中作氧化剂
D.RO3-中的R元素在所有的反应中只能被还原
答案:B
点拨:RO3-中R为+5价,周期表中ⅤA、ⅦA元素均可形成RO3-离子,A毛病;据元素守恒,反应中只有R、H、O三种元素,则缺项一定为
R-,且配平方程式为RO3-+5R-+6H+===3R2↑+3H2O,据此可得R为ⅦA
元素,B正确;R-中R处于态,只能作还原剂,C毛病;RO3-中R元素处
于中间价态,在反应中既可被氧化又可被还原,D项错。
3.已知KH和H2O反应生成H2和KOH,反应中1molKH()
A.失去1mol电子
B.得到1mol电子
C.失去2mol电子
D.没有电子得失
答案:A
点拨:KH中H为-1价,KH+H2O===KOH+H2↑
置换反应一定是氧化还原反应;复分解反应一定不是氧化还原反应;化合反应和分解反应中有一部分是氧化还原反应。
例、在H+、Fe2+、Fe3+、S2-、S中,只有氧化性的是
________________,只有还原性的是________________,既有氧化性又
有还原性的是___________。
二、氧化还原反应的表示:(用双、单线桥表示氧化还原反应的电子转移情形)
1、双线桥:“谁”变“谁”(还原剂变成氧化产物,氧化剂变成
还原产物)
例:
2、单线桥:“谁”给“谁”(还原剂将电子转移给氧化剂)
例:
三、氧化还原反应的分析
1、氧化还原反应的类型:
(1)置换反应(一定是氧化还原反应)
2CuO+C=2Cu+CO2SiO2+2C=Si+2CO
2Mg+CO2=2MgO+C2Al+Fe2O3=2Fe+Al2O3
2Na+2H2O=2NaOH+H2↑2Al+6H+=2Al3++3H2↑
2Br-+Cl2=Br2+2Cl–Fe+Cu2+=Fe2++Cu
(2)化合反应(一部分是氧化还原反应)
2CO+O2=2CO23Mg+N2=Mg3N2
2SO2+O2=2SO32FeCl2+Cl2=2FeCl3
(3)分解反应(一部分是氧化还原反应)
4HNO3(浓)=4NO2↑+O2↑+2H2O2HClO=2HCl+O2↑
2KClO3=2KCl+3O2↑
(4)部分氧化还原反应:
MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O
Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O
Cu+2H2SO4(浓)=CuSO4+SO2↑+2H2O
(5)自身氧化还原反应:(歧化反应)
Cl2+H2O=HCl+HClO3S+6OH-=2S2-+SO32-+3H2O
2Na2O2+2H2O=4NaOH+O2↑;2Na2O2+2CO2=2Na2CO3+O2
2Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O
(6)同种元素不同价态之间的氧化还原反应(归中反应)
2H2S+SO2=3S+3H2O
5Cl–+ClO3-+6H+=3Cl2↑+3H2O
(7)氧化剂、还原剂、氧化产物、还原产物不止一种的氧化还原反应:
2KNO3+S+3C=K2S+N2↑+3CO2↑
2KMnO4=K2MnO4+MnO2+O2↑
2、氧化还原反应分析:
(1)找四物:氧化剂、还原剂、氧化产物、还原产物
(2)分析四物中亮的关系:特别是歧化反应、归中反应、部分氧化
还原反应
(3)电子转移的量与反应物或产物的关系
例:根据反应:8NH3+3Cl2==6NH4Cl+N2,回答下列问题:
(1)氧化剂是_______,还原剂是______,氧化剂与还原剂的物质
的量比是____________;
(2)当有68gNH3参加反应时,被氧化物质的质量是____________g,生成的还原产物的物质的量是____________mol。