多肽偶联方案
- 格式:doc
- 大小:24.00 KB
- 文档页数:1

多肽是少于100个氨基酸脱水缩合形成的化合物,分子结构介于氨基酸和蛋白质之间,具有很高的生物活性。
随着多肽在药物研发、食品研究以及在化妆品领域的广泛应用(特别是生物制药的发展),多肽合成已然成为化学生物学研究的一个重要且不断增长的领域。
多肽合成反应1)末端氨基酸N端脱保护2)激活待添加氨基酸(C端脱保护)3)偶联成具有酰胺功能的肽4)重复上述步骤添加更多的氨基酸,直到得到目的肽多肽化学合成方法1)固相合成(SPPS):在聚合珠或树脂上从C端(羧基端)向N端(氨基端)固相合成多肽。
*Boc多肽合成法经典的多肽固相合成法,以Boc作为氨基酸α-氨基的保护基,苄醇类作为侧链保护基,Boc的脱除通常采用三氟乙酸(TFA)进行。
多肽合成时将已用Boc保护好的N-α-氨基酸共价交联到树脂上,TFA切除Boc保护基,N 端用弱碱中和。
肽链的延长通过二环己基碳二亚胺(DCC)活化、偶联进行,最终采用强酸氢氟酸(HF)法或三氟甲磺酸(TFMSA)将合成的目标多肽从树脂上解离。
在Boc多肽合成法中,为了便于下一步的多肽合成,反复用酸进行脱保护,一些副反应被带入实验中,例如多肽容易从树脂上切除下来,氨基酸侧链在酸性条件不稳定等。
FMOC-苯甘氨酸102410-65-1BOC-L-4-甲基苯丙氨酸80102-26-7BOC-L-羟脯氨酸13726-69-7*Cbz-氨基酸及衍生物CBZ-L-赖氨酸甲酯盐酸盐27894-50-42)偶联试剂:*活性酯/添加剂N-羟基硫代琥珀酰亚胺钠盐106627-54-71H-苯并三唑-1-基氧三吡咯烷基鏻六氟磷酸盐128625-52-5Fmoc-His(Trt)-Wang resin 100-200 mesh, 1%DVB,Substitution 0.3-0.8mmol/g。

1.1.1多肽合成按照多肽合成常规操作,合成来源于上海楚肽生物科技有限公司(Apeptide CO.,Ltd.) HPLC检测纯度为95%。
多肽C端增加的半胱氨酸残基用于以其巯基连接于偶联剂上。
1.1.2 合成多肽与载体的偶联载体蛋白选择BSA(Roche公司),用SPDP(PIERCE公司)连接法将合成的多肽与BSA进行偶联:4.6mgSPDP溶解于740ulDMSO,终浓度为20mM。
0.1008gBSA溶解于2ml PBS-EDTA溶液中,室温静置1h。
HiTrap TM Deaslting column脱盐柱洗脱多余的SPDP。
4mg多肽加入偶联好的BSA-SPDP体系中室温过夜。
1.1.3 抗多肽抗体的制备选体重1. 5~2 kg的健康雄性新西兰大白兔,按常规操作卡介苗活化其免疫系统。
将偶联的BSA-多肽过滤除菌,100mg(2ml)加等体积的不完全佐剂,充分混悬。
在新西兰大白兔背部多点皮下注射,4周后加强免疫,其后每隔2周进行1次加强免疫,注射途径与初次免疫相同,共两次后,检测效价。
耳源静脉采血、分离血清。
1.1.4 多肽抗体的纯化Protein G柱分离纯化IgG抗体:PBSpH7.4平衡Protein G亲和柱,以0.1M Gly-HCl pH3.0洗脱,PBSpH7.4透析,分装,-20℃保存。
1mM预冷的HCl充分膨胀Sepharose 4FF(GE公司)后,15个体积的1mMHCl清洗去残留的蔗糖,每次清洗2min。
偶联缓冲液0.1MNaHCO3 pH8.3 0.5M NaCl平衡2次。
多肽溶于偶联缓冲液,调节pH值到pH8.3后,加入凝胶,室温混旋3h。
加入1M预冷的乙醇胺混旋2h阻断未偶联上的活化位点。
50mM Tris-HCl pH8.0,1MNaCl 溶液与50mM Gly-HCl pH3.5,1M NaCl 交替清洗8次。
PBS缓冲液平衡10倍体积。
装柱,平衡,上样后以0.1MGly-HCl pH2.2洗脱,PBS透析,分装,-20℃冻存。

多肽偶联核素技术概述说明以及解释1. 引言1.1 概述多肽偶联核素技术(Peptide-Linked Radiopharmaceutical Technology)是一种将多肽与核素结合的技术,用于诊断和治疗癌症等疾病。
多肽作为药物载体具有良好的选择性靶向特性,能够靶向特定的受体或细胞表面分子,并通过连接核素的方式实现药物传送、图像显示或放射治疗等目的。
近年来,这一技术在医学领域取得了显著进展,并被广泛应用于临床。
1.2 文章结构本文旨在全面介绍多肽偶联核素技术的原理、应用以及其在癌症治疗中的应用。
文章主要包括五个部分:引言、多肽偶联核素技术的原理和应用、多肽偶联核素技术在癌症治疗中的应用、多肽偶联核素技术的优势和不足以及结论及展望。
在引言部分,将对多肽偶联核素技术进行概述,并说明文章结构。
1.3 目的本文旨在深入探讨多肽偶联核素技术的原理和应用,特别是在癌症治疗中的应用。
通过对多肽偶联核素技术的综述,希望能够加深对这一技术的理解,为进一步开发和改进该技术提供参考。
此外,还将重点讨论多肽偶联核素技术在放射治疗和同位素治疗中的具体应用,并探讨其优势、不足以及未来发展方向。
通过本文的阐述,期望可以推动多肽偶联核素技术在临床医学中更广泛、更有效地应用。
2. 多肽偶联核素技术的原理和应用2.1 多肽偶联核素技术简介多肽偶联核素技术是一种利用合成的多肽与放射性或磁性同位素进行特定结合的技术。
通过将靶向特定受体或组织的多肽与放射性核素或磁性荧光染料等连接起来,可以实现对癌症细胞或其他疾病相关位点的准确诊断和治疗。
2.2 多肽选择性靶向药物输运系统的发展历程多肽选择性靶向药物输运系统的发展经历了多个阶段。
最早期的方法是以复杂的抗体为基础,然而抗体自身存在较大体积和高成本的问题。
随后,研究人员开始利用更小、更具可行性的多肽作为靶向配体,通过改变配体序列来提高结合亲和力,并且采取各种化学修饰手段来增强稳定性和生物可用性。

多肽偶联的生产工艺流程英文回答:Peptide conjugation is a process used in the production of peptides with attached molecules or functional groups. This process involves the covalent attachment of a specific molecule to a peptide sequence, resulting in a peptide conjugate with enhanced properties or specific functionalities.The production process of peptide conjugates typically involves several steps. Here is a general overview of the process:1. Design and synthesis of the peptide: The first step is to design and synthesize the peptide sequence. This can be done using solid-phase peptide synthesis (SPPS) or recombinant DNA technology, depending on the complexity and length of the peptide.2. Activation of the peptide: Once the peptide is synthesized, it needs to be activated to create a reactive site for conjugation. This can be achieved by introducing a specific functional group, such as a carboxyl group or an amine group, to the peptide.3. Selection and preparation of the molecule to be conjugated: The next step is to select the molecule or functional group that will be attached to the peptide. This molecule can be a drug, a fluorescent dye, a targeting ligand, or any other molecule of interest. The molecule is then prepared for conjugation by introducing a reactive group that can react with the activated peptide.4. Conjugation reaction: The activated peptide and the prepared molecule are mixed together in a suitable reaction buffer or solvent. The reaction conditions, such as temperature, pH, and reaction time, are optimized to ensure efficient conjugation. The reactive groups on the peptide and the molecule react with each other, forming a covalent bond and resulting in the formation of the peptide conjugate.5. Purification and characterization: After the conjugation reaction, the peptide conjugate needs to be purified to remove any unreacted peptide or molecule. Thisis typically done using techniques such as chromatographyor filtration. The purified peptide conjugate is then characterized using analytical techniques, such as mass spectrometry or nuclear magnetic resonance (NMR), toconfirm its structure and purity.6. Evaluation of the conjugate's properties: The final step is to evaluate the properties of the peptide conjugate, such as its stability, solubility, bioactivity, and pharmacokinetics. This can be done through in vitro and in vivo studies to assess the conjugate's potentialapplications in various fields, such as drug delivery, diagnostics, or therapeutics.中文回答:多肽偶联是一种在多肽生产中常用的过程,用于在多肽序列上连接分子或功能基团。

多肽tat化学偶联引言。
多肽tat是一种具有神经透过性的多肽,可以穿过细胞膜并在细胞内部发挥作用。
由于其独特的特性,多肽tat已经成为药物输送和生物医学应用中的研究热点。
化学偶联技术是一种重要的手段,可以将多肽tat与其他分子或药物进行结合,以实现特定的生物学功能。
本文将探讨多肽tat化学偶联在药物输送和生物医学应用中的潜在用途。
多肽tat的特性。
多肽tat是源自人类免疫缺陷病毒(HIV)的一种多肽,其氨基酸序列为YGRKKRRQRRR。
由于其富含阳离子氨基酸,多肽tat具有良好的细胞透过性,能够穿过细胞膜并进入细胞内部。
这使得多肽tat成为一种理想的药物输送载体,可以用于输送各种药物或生物分子到细胞内部,从而发挥治疗或诊断作用。
多肽tat的化学偶联。
化学偶联是一种将两种分子通过共价键连接在一起的技术。
在多肽tat的化学偶联中,常用的偶联方法包括酰胺键形成、酯键形成、亲核取代反应等。
通过这些化学偶联方法,可以将多肽tat与药物、生物标记物或其他功能分子进行结合,从而赋予多肽tat特定的生物学功能。
多肽tat化学偶联在药物输送中的应用。
多肽tat化学偶联在药物输送中具有广泛的应用前景。
通过将多肽tat与药物进行化学偶联,可以提高药物的细胞内摄取率,增强药物的生物利用度,减少药物的副作用,并实现靶向输送。
例如,多肽tat可以与抗癌药物偶联,使其能够穿过血脑屏障并进入脑组织,从而用于治疗脑部肿瘤。
此外,多肽tat还可以与核酸药物偶联,用于基因治疗和RNA干扰治疗等领域。
多肽tat化学偶联在生物医学应用中的潜在用途。
除了药物输送外,多肽tat化学偶联还具有广泛的生物医学应用潜力。
例如,多肽tat可以与荧光染料偶联,用于细胞成像和组织标记。
此外,多肽tat还可以与诊断试剂偶联,用于生物标记物检测和疾病诊断。
在组织工程和再生医学领域,多肽tat还可以与生物材料偶联,用于促进组织修复和再生。
结论。
多肽tat化学偶联是一种重要的技术手段,可以赋予多肽tat 特定的生物学功能,拓展其在药物输送和生物医学应用中的潜在用途。

多肽偶联原理及步骤英文回答:Peptide coupling is a fundamental process in organic chemistry that involves the formation of a peptide bond between two amino acids or peptide fragments. This reaction is commonly used in the synthesis of peptides and proteins.The principle behind peptide coupling is the nucleophilic attack of the amino group of one amino acid or peptide fragment on the carbonyl group of another amino acid or peptide fragment. This reaction is typically catalyzed by a coupling reagent, such as dicyclohexylcarbodiimide (DCC) or N,N'-diisopropylcarbodiimide (DIC), which activates the carboxyl group of one amino acid or peptide fragment and facilitates the formation of the peptide bond.The steps involved in peptide coupling can be summarized as follows:1. Activation of the carboxyl group: The carboxyl group of one amino acid or peptide fragment is activated by a coupling reagent. This activation involves the formation of an acyl-oxazolone intermediate, which is highly reactive and prone to nucleophilic attack.2. Nucleophilic attack: The amino group of another amino acid or peptide fragment attacks the activated carboxyl group, resulting in the formation of a peptide bond. This step is typically facilitated by a base, such as N,N-diisopropylethylamine (DIPEA), which helps deprotonate the amino group and increase its nucleophilicity.3. Coupling completion: After the nucleophilic attack, the resulting peptide bond is stabilized through the removal of the coupling reagent and any protecting groups that were used during the synthesis. This step ensures the formation of a stable and biologically active peptide or protein.For example, let's consider the synthesis of adipeptide, consisting of alanine and glycine. The firststep would involve the activation of the carboxyl group of alanine using a coupling reagent like DCC. The activated alanine would then react with the amino group of glycine, resulting in the formation of the alanine-glycine dipeptide. Finally, any protecting groups and the coupling reagent would be removed to obtain the desired dipeptide.中文回答:多肽偶联是有机化学中的一个基本过程,涉及两个氨基酸或多肽片段之间的肽键形成。

一、Frdbio –SH介导多肽与载体偶联1. cKLH载体蛋白与sulfo-SMCC的偶联(以偶联20mg多肽为例,根据实验实际偶联量,所有试剂体积作同比缩放)1.1 称取20mg cKLH(Frdbio,Cat No.: BCJ0002),溶于2ml超纯水,配成【10 mg/ml cKLH溶液】。
1.2 称取10 mg Sulfo-SMCC(Frdbio)于2ml超纯水配成【5mg/ml Sulfo-SMCC溶液】。
1.3 将以上两种溶液等体积混匀,室温(25℃)反应60 min或者37℃反应30 min,磁力搅拌器慢速均匀搅动反应,避免产生气泡。
1.4 反应完后将以上反应溶液装入10kD透析袋,在PBS(pH7.2)溶液中透析除去过多Sulfo-SMCC,每隔3h换液,至少换3~4次,确保透析完全,即为【活化的cKLH载体】(有条件的也可以用sephdex-G25分子筛色谱分离或超滤管。
活化的cKLH要尽快使用,不可久放。
)2. 多肽的偶联偶联前需检测多肽中-SH活性。
2.1 Ellman试剂法检测多肽-SH状态:方法:在96孔酶标板中,10μl多肽+100μl Ellman试剂,用分光光度计在96孔酶标板中412nm进行测量,OD >0.15时,多肽SH正常,如果OD<0.15,说明多肽被氧化或者自我交联,不可使用。
偶联完成之后,透析前用上述同样方法检测DO<0.03时,说明多肽已经80%以上全部偶联,可继续添加多肽;如果OD>0.03,说明多肽过量未全部偶联。
如果没有Nano分光光度计,直接观察颜色,颜色变黄,说明游离—SH过量。
2.2 称取20mg多肽溶解于5ml交联缓冲液(0.1M PB,0.15M NaCl)中,配成【4mg/ml的多肽溶液】(对于难溶肽,可用≤30%的DMSO溶解),一般我们只偶联5~10mg多肽,等比例缩小体积即可。
2.3 将第1.4步透析好的cKLH与第5步配好的【4mg/ml多肽溶液】混合,室温(25℃)4h。

试剂edc多肽偶联反应化学式全文共四篇示例,供读者参考第一篇示例:试剂edc多肽偶联反应是一种常用的化学方法,用于将多肽与其他化合物或生物分子进行共价结合。
本文将介绍edc的化学结构和作用机制,以及其在多肽偶联反应中的应用。
让我们来了解一下edc的结构。
edc的全称是1-乙基-3-(3-二甲氨基丙胺)碳二亚胺,化学式为C8H17N3O2。
这种化合物是一种活性羧酸偶联试剂,它的作用是促进多肽和其他生物分子之间的偶联反应。
在edc的作用下,多肽中的羧基与其他分子中的氨基或羟基结合,形成新的共价键。
接下来,让我们来了解一下edc的作用机制。
在水溶液中,edc会首先与多肽中的羧基反应,形成一个活性的酯键中间体。
这个中间体会很快与其他分子中的氨基或羟基发生亲核取代反应,从而形成新的酯键或酰胺键。
整个反应过程只需要简单的操作步骤,反应条件温和,且反应产率较高。
让我们来讨论一下edc在多肽偶联反应中的应用。
由于edc具有高效的偶联能力和良好的反应条件,因此在生物医药领域中被广泛应用于多肽偶联反应。
可以利用edc将多肽与药物分子或标记分子偶联,用于药物传递或生物标记实验。
还可以利用edc将多肽与蛋白质或多肽片段进行偶联,用于研究生物分子间的相互作用。
试剂edc多肽偶联反应是一种简单高效的化学手段,可以实现多肽与其他生物分子之间的共价结合。
通过了解edc的结构和作用机制,以及其在多肽偶联反应中的应用,我们可以更好地理解和应用这种化学方法,推动生物医药领域的研究和发展。
【字数不足,暂时只能提供以上内容,如需更多内容请补充】。
第二篇示例:试剂EDC多肽偶联反应是一种常用的生物化学技术,可以用于将多肽与其他生物分子(例如荧光染料、抗原、酶等)结合起来,以实现特定的生物学实验目的。
本文将介绍试剂EDC多肽偶联反应的化学机制、重要应用及实验步骤等内容。
一、化学式及机理试剂EDC(1-ethyl-3-(3-dimethylaminopropyl) carbodiimide)是一种常用的偶联试剂,可以促进两个生物分子的共价结合。

小分子和多肽偶联小分子和多肽偶联是一种常见的生物化学研究方法,通过将小分子化合物与多肽分子结合,可以改变多肽的性质和功能。
这种偶联技术在药物研发、生物传感器、分子诊断等领域具有重要应用价值。
小分子和多肽的偶联可以通过多种化学反应实现。
其中,最常用的方法是通过偶联剂将小分子与多肽分子连接起来。
常见的偶联剂包括活性酯、酰胺、胺反应试剂等。
这些偶联剂能够与多肽分子中的氨基酸残基反应,形成稳定的化学键。
通过这种偶联反应,可以将小分子与多肽分子紧密结合,形成新的化合物。
小分子和多肽的偶联可以改变多肽的生物活性和稳定性。
多肽作为药物分子往往具有较短的半衰期和较低的生物利用度,限制了其在体内的应用。
而小分子化合物往往具有较长的半衰期和较高的生物利用度,具有更好的药物性质。
通过将小分子与多肽偶联,可以提高多肽的生物稳定性和药物活性,从而扩大其应用范围。
小分子和多肽的偶联还可以实现多肽的定向传递。
多肽分子往往具有特异性的靶向作用,可以与特定的受体结合。
通过将小分子与多肽偶联,可以将小分子的药物作用靶向到特定的组织或细胞。
这种定向传递的策略可以提高药物的疗效,减少副作用。
小分子和多肽的偶联在生物传感器领域也具有重要应用。
生物传感器是一种能够检测特定分子或生物事件的装置,具有高灵敏度和高选择性。
通过将小分子与多肽偶联,可以将多肽的靶向性和小分子的检测特异性相结合,实现对特定分子的灵敏检测。
这种偶联技术在疾病诊断、环境监测等领域有着广泛的应用前景。
小分子和多肽的偶联是一种重要的生物化学研究方法,可以改变多肽的性质和功能。
通过偶联技术,可以提高多肽的生物稳定性和药物活性,实现药物的定向传递,以及构建高灵敏度的生物传感器。
这种偶联技术在生物医药领域具有广阔的应用前景,有望为新药研发和疾病诊断提供新的思路和方法。

cdi活化法偶联多肽CDI活化法偶联多肽的方法是一种常用的合成策略,广泛应用于多肽化学领域。
CDI活化法的特点包括操作简便,反应条件温和且具有较高的反应效率,适用于不同长度和结构的肽链合成。
CDI活化法偶联多肽的实质是通过使用二氯代咪唑(CDI)作为活化剂,将肽酰胺与胺基或羟基化合物进行偶联反应,形成肽键。
CDI活化剂具有较高的反应活性,能够有效促进底物之间的偶联反应,从而实现多肽的合成。
CDI活化法偶联多肽的步骤一般分为活化、偶联和脱保护三个阶段。
首先,将CDI活化剂与肽酰胺底物在碱性条件下进行反应,生成活性中间体。
活化的过程中,CDI活化剂能够与肽酰胺发生酰胺交换反应,从而形成酰胺中间体,并保留底物的端基保护基团。
接下来,将活化的酰胺中间体与胺基或羟基化合物进行偶联反应。
偶联反应的条件需要根据底物的具体性质进行调节,一般在中性或弱酸性条件下进行。
在活化剂的作用下,底物的末端基团与反应物发生nucleophilic attack 反应,从而形成新的肽键。
偶联反应的时间和温度需要根据具体的反应物和反应条件进行优化,以保证反应的效率和选择性。
最后,通过脱除保护基团来得到纯化的多肽产物。
一般采用氢氟酸处理或其他脱保护试剂进行脱保护反应,将底物中的保护基团去除。
脱保护的条件需要谨慎选择,以避免对肽链的不必要修饰或损坏。
CDI活化法偶联多肽具有一定的优点和适用性。
首先,CDI活化剂操作简便,反应条件温和,有利于底物的保护基团的稳定。
其次,CDI活化剂具有较高的反应效率,能够在较短的时间内完成多肽的合成。
此外,CDI活化法适用于不同长度和结构的肽链合成,具有较好的普适性。
总之,CDI活化法偶联多肽是一种有效的肽合成策略,具有操作简便、反应条件温和和较高的反应效率等优点。
它在多肽化学领域具有广泛的应用前景,并为合成复杂多肽分子提供了一种有效的方法。
因此,研究者可以根据自己的需要选择CDI活化法作为多肽合成的方法,以实现高效、快速和可控的多肽合成。
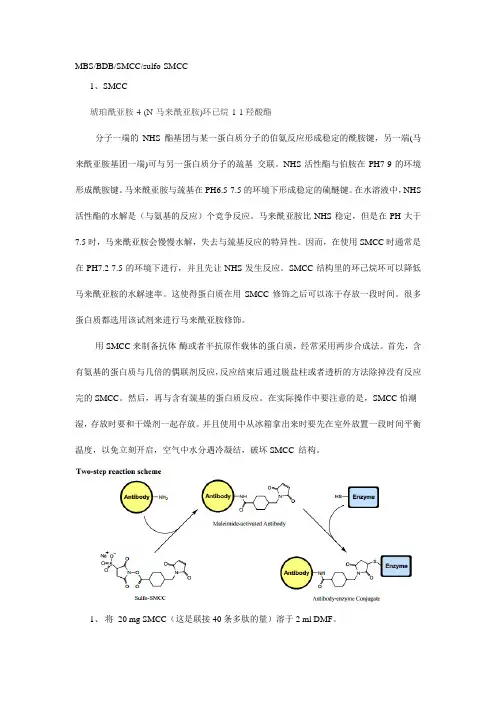
MBS/BDB/SMCC/sulfo-SMCC1、SMCC琥珀酰亚胺-4-(N-马来酰亚胺)环已烷-1-1羟酸酯分子一端的NHS酯基团与某一蛋白质分子的伯氨反应形成稳定的酰胺键,另一端(马来酰亚胺基团一端)可与另一蛋白质分子的巯基交联。
NHS活性酯与伯胺在PH7-9的环境形成酰胺键。
马来酰亚胺与巯基在PH6.5-7.5的环境下形成稳定的硫醚键。
在水溶液中,NHS 活性酯的水解是(与氨基的反应)个竞争反应。
马来酰亚胺比NHS稳定,但是在PH大于7.5时,马来酰亚胺会慢慢水解,失去与巯基反应的特异性。
因而,在使用SMCC时通常是在PH7.2-7.5的环境下进行,并且先让NHS发生反应。
SMCC结构里的环己烷环可以降低马来酰亚胺的水解速率。
这使得蛋白质在用SMCC修饰之后可以冻干存放一段时间。
很多蛋白质都选用该试剂来进行马来酰亚胺修饰。
用SMCC来制备抗体-酶或者半抗原作载体的蛋白质,经常采用两步合成法。
首先,含有氨基的蛋白质与几倍的偶联剂反应,反应结束后通过脱盐柱或者透析的方法除掉没有反应完的SMCC。
然后,再与含有巯基的蛋白质反应。
在实际操作中要注意的是,SMCC怕潮湿,存放时要和干燥剂一起存放。
并且使用中从冰箱拿出来时要先在室外放置一段时间平衡温度,以免立刻开启,空气中水分遇冷凝结,破坏SMCC 结构。
1、将20 mg SMCC(这是联接40条多肽的量)溶于2 ml DMF。
2、将0.8 ml KLH加入到25 ml圆底烧瓶中,补加1×PBS(pH 7.2)使蛋白终浓度为15mg/ml。
3、将溶解好的SMCC溶液缓慢滴加到120 mg KLH 蛋白体系中,室温搅拌反应1h。
4、用1 L 1×PBS (PH 7.4) 溶液于4℃下透析6 小时,除去游离的SMCC。
5、将透析后的KLH蛋白倒入50 ml离心管中,通过离心管的刻度确定其体积,根据反应前加入的KLH蛋白的量来计算透析后蛋白的浓度,然后根据其浓度将2.5 mg KLH-SMCC溶液转移到5 ml离心管中。
多肽偶联的生产工艺流程英文回答:Polypeptide Conjugation Manufacturing Process.1. Raw Material Preparation.Synthetic peptides and proteins are synthesized using solid-phase peptide synthesis (SPPS) or recombinant DNA technology. The raw materials used in SPPS include amino acids, coupling reagents, and solvents.2. Peptide Synthesis.Peptides are synthesized by sequential addition of amino acids to a growing peptide chain. The amino acids are activated using coupling reagents and added to the peptide chain. The reaction is repeated until the desired peptide sequence is obtained.The crude peptide is purified using techniques such as high-performance liquid chromatography (HPLC) orpreparative electrophoresis. The purified peptide is then characterized using mass spectrometry and other analytical methods.4. Conjugation.The purified peptide is conjugated to a carrier molecule. The carrier molecule can be a protein, antibody,or other biomolecule. The conjugation reaction is typically performed using chemical cross-linkers or enzymatic methods.5. Purification.The conjugated product is purified using techniquessuch as HPLC or ultrafiltration. The purified conjugate is then characterized using mass spectrometry and other analytical methods.The conjugated product is formulated into a suitable dosage form. The formulation may include excipients such as buffers, stabilizers, and preservatives. The dosage form can be a liquid, powder, or lyophilized solid.7. Quality Control.The final product is subjected to quality control testing to ensure that it meets the specifications for purity, potency, and safety. The testing may include assays for peptide content, conjugation efficiency, and biological activity.中文回答:多肽偶联生产工艺流程。
多肽偶联蛋白方法English: Peptide coupling is a method commonly used in protein chemistry for synthesizing peptides and proteins. The most widely used method for peptide coupling is the solid-phase synthesis, which involves anchoring the C-terminal amino acid to a solid support and sequentially adding amino acids while protecting the functional groups. This method allows for the synthesis of long peptides and proteins in a stepwise manner. Another method for peptide coupling is solution-phase synthesis, which involves coupling protected amino acids in solution, followed by deprotection and purification steps. The choice of peptide coupling method depends on the specific requirements of the synthesis, such as the length of the peptide or protein, the presence of difficult sequences, and the need for high purity. Overall, peptide coupling methods play a crucial role in the synthesis of peptides and proteins for various applications in biomedical research, pharmaceuticals, and biotechnology.中文翻译: 多肽偶联是蛋白化学中常用的合成肽和蛋白质的方法。
多肽偶联bsa原理及步骤多肽偶联BSA,这事儿啊,就像是给小珠子串上大珠子,还得串得稳稳当当的。
那咱们先得知道啥是多肽,啥是BSA。
多肽呢,就像是一条由好多小珠子(氨基酸)串起来的小链子,有自己独特的结构和功能。
BSA呢,就是牛血清白蛋白,这就好比是一个大珠子,个头大,还能给别的东西提供个“挂靠”的地方。
那为啥要把多肽和BSA偶联起来呢?这就跟搭伙过日子似的。
多肽自己有时候太单薄,功能发挥不出来或者不稳定。
和BSA一结合,就像有了个靠山,稳定性增强了,功能也能更好地发挥。
而且在一些检测或者研究里,这样的偶联物可有用了。
比如说在免疫检测里,就像在一群人中找特定的人,这个偶联物就像是给要找的那个人穿上了一件特别显眼的衣服,让人一眼就能认出来。
现在说说这偶联的原理吧。
这就像是一种特殊的黏合。
在分子层面上,有很多化学键在起作用。
有的是通过共价键,就像是两个小零件焊接在一起,牢固得很。
多肽上的一些基团和BSA上的基团就像两个小爪子,互相抓住对方,紧紧地连在一起。
这可不是随随便便就能抓上的,得满足一定的条件,就像两个人要牵手,得看对眼儿,还得站在合适的位置才行。
那具体步骤是啥样的呢?第一步,得先把材料准备好。
多肽和BSA都得是纯净的,不能有杂质捣乱。
这就好比做饭,食材得干净新鲜。
如果有杂质,就像饭里有沙子,那这偶联肯定做不好。
多肽的纯度要是不够,就像拿一把生锈的钥匙去开锁,可能根本就打不开那扇需要偶联的“门”。
BSA要是不纯,就像地基没打好,房子怎么能盖得稳呢?第二步,要选择合适的偶联方法。
这就像选交通工具,不同的路得开不同的车。
有的方法适合这个多肽和BSA的组合,有的就不行。
常见的方法有戊二醛法。
这个戊二醛就像是一个小桥梁,一头连着多肽,一头连着BSA。
它能和多肽上的氨基还有BSA 上的氨基发生反应,就像小桥梁的两端有小钩子,钩住两边的东西。
不过在这个过程中,得控制好戊二醛的量。
量太多了,就像桥建得太宽,可能会把不需要连接的东西也连上,那就乱套了;量太少呢,就像桥太窄,连接不牢固,风一吹就断了。
量子点和多肽偶联方法说实话量子点和多肽偶联这事儿,我一开始也是瞎摸索。
我试过直接把量子点和多肽放在一起,就像把盐和糖随便混在一起那样,心想说不定就能偶联上呢,结果当然是失败的,这就像做菜随便把东西一放,根本做不出好菜,两者之间几乎没有任何有效的结合。
后来我想,会不会需要一个连接子呢?就像建桥需要桥墩一样。
我找了些常用的化学连接子,先把量子点修饰上连接子的一端,再把多肽接上连接子的另一端。
可是这个过程也是困难重重。
比如说在修饰量子点的时候,很容易因为反应条件控制不好,要么化学反应没发生,要么量子点的性质都被破坏了。
有一次,试剂的量加多了一点,量子点的荧光性一下子就变得特别弱,感觉就像一个灯泡突然暗了好多,那次真的是个教训,让我意识到反应条件里每一个微小的因素都很关键。
我还试过利用静电作用,我知道量子点可能会带一定的电荷,部分多肽也会带电荷。
我就试着调节溶液的pH值,想让它们俩产生静电吸引从而达到偶联。
一开始我以为只要让一个带正电一个带负电就行,但是实际操作中发现没那么简单。
溶液中还有其他离子,这些离子会干扰静电吸引。
有时候加多了某种离子,就像在本来平静的球场上突然挤进好多捣乱的人一样,量子点和多肽就没办法好好靠近进行偶联了。
再后来,我发现有一种生物正交反应好像比较靠谱。
这就像给量子点和多肽安排了一场专属的相亲会,在特定的小环境里,它们俩能比较高效地偶联。
但是这个反应的试剂很难找,而且反应需要严格的无氧环境,就像娇贵的花朵一样要精心呵护这个反应环境才行。
不好确定的地方是,不同类型的量子点和多肽可能需要做很多微调。
可能这个在这种量子点和这种多肽上成功的方法,换一个就会失败。
我觉得大家要是做这个实验,一定要小心记录每一个步骤,每一个反应条件,多尝试几种办法,不要在一棵树上吊死,毕竟像我这样瞎撞了好久才稍微有点门道的例子太多了。
然后再说到沉淀的问题,有时候偶联过程中或者之后会出现沉淀。
这就不好了,说明可能是溶解性的问题或者是生成了不想要的复合物。
多肽偶连常用氨基酸反应终点判断方法摘要:一、多肽偶连简介二、常用氨基酸反应终点判断方法1.肽键形成2.氨基酸缩合反应3.脱水缩合4.检测方法三、方法优缺点分析四、实际应用案例五、未来发展趋势与应用前景正文:一、多肽偶连简介多肽偶连,又称多肽连接,是指将两个或多个氨基酸分子通过共价键连接在一起形成一个新的肽链。
在生物化学和生物技术领域,多肽偶连技术具有重要意义,广泛应用于蛋白质工程、药物研发和生物传感器等领域。
多肽偶连的关键步骤之一是判断反应终点,以确保肽链的正确连接和稳定性。
二、常用氨基酸反应终点判断方法1.肽键形成在多肽偶连过程中,肽键的形成是关键。
通过监测反应体系中游离氨基酸的浓度变化,可以判断肽键是否形成。
此外,还可以通过紫外吸收光谱、荧光光谱等方法检测肽键的形成。
2.氨基酸缩合反应氨基酸缩合反应是多肽偶连的基础。
通过监测反应液的酸碱度、温度等条件,可以判断氨基酸缩合反应的进行程度。
此外,还可以通过观察反应液的透明度、测定反应液的折射率等方法来判断氨基酸缩合反应的终点。
3.脱水缩合脱水缩合是氨基酸缩合反应的关键步骤之一。
在脱水缩合过程中,氨基酸分子失去一个水分子,形成肽键。
可以通过测定反应液中水分子的浓度变化,判断脱水缩合反应的终点。
4.检测方法(1)质谱法:质谱法具有高灵敏度和高分辨率,可以对多肽进行分子量测定,从而判断反应终点。
(2)核磁共振(NMR):通过检测氨基酸残基之间的相互作用,判断肽链的结构和稳定性。
(3)电泳法:电泳法可以对多肽进行分离和纯化,从而判断反应终点。
三、方法优缺点分析优点:各种方法具有较高的准确性和可靠性,可以为多肽偶连反应提供有效的判断依据。
缺点:部分方法操作复杂,需要专业的实验设备和技能。
此外,有些方法对反应条件敏感,需要在严格控制的条件下进行。
四、实际应用案例在药物研发领域,多肽偶连技术常用于制备抗体药物偶联物(ADC)。
通过监测反应终点,可以确保ADC的稳定性和疗效。
多肽的连接方式多肽连接是指将两个或多个氨基酸序列连接起来形成更长的氨基酸序列,其中包含的肽键数量多于单个氨基酸分子内的肽键数量。
这种连接方式是生物体内大分子蛋白质合成的关键步骤,同时也是生物活性肽类合成的基础。
1. 谷氨酰胺连接法谷氨酰胺连接法是通过谷氨酰胺酶调解将一段氨基酸序列与另一段氨基酸序列进行连接。
该方法为胞质基化学反应,靠经过多步反应形成临时硫化数。
最后发生消化反应脱掉硫化物,从而将两端氨基酸连接起来。
这种方法是生物界中最常用的肽键连接方式,其优点是步骤直观、反应效率高。
2. 亚硫酸盐连接法亚硫酸盐连接法独立于谷氨酰胺连接法的步骤。
该方法是利用亚硫酸氢盐对氨基酸进行还原,从而生成活泼的亚硫酸盐,然后将两端的氨基酸接在一起。
由于该反应消耗亚硫酸氢盐,难以实现对大规模反应的应用,但是该方法仍然被广泛的应用于小规模化学合成反应中。
3. 氰化苄连接法氰化苄连接法是另外一种连接方法,它利用肽键上的酰胺基、酸、羧基和氨基活泼性较高,向氰基亲化进攻来进行连接。
这种方法效率较高,特别是对具有C端支链或N端缺脱羧基的氨基酸连接具有高效性。
4. 银离子连接法银离子连接法是将两段具有硫醇基团的氨基酸通过在银盐存在的条件下产生硫代酰化反应进行连接。
这种连接方式的优点在于实现的条件比较简单,同时也可以避免谷氨酰胺酶和其他化学剂的滥用。
综上所述,多肽连接方式众多,各自以自己独特的方式形成肽键连接。
当然,每种连接方式都有其各自的局限性,同时也具有自己深入发展的历史和潜在影响。
随着人们对化学的深入研究和实现条件的不断改进,将有更加有效且优美的多肽连接方式不断涌现出来。
多肽合成时, 先了解多肽的位点. 如果是炭末端多肽,直接用ALPHA氨基作为连接点. 如果是氨基末端的多肽, 得在多肽的炭末端加一个半胱氨酸(提供-SH基团)
赖氨酸Lys提供游离-NH2 天冬氨酸D 提供游离-COOH 谷氨酸E 提供游离-COOH 半胱氨酸C 提供游离-SH
标记到BSA 羧基端。
1、BSA稀释到1mg/mL(66KD,100个羧基), 缓冲液为50mM MES(pH 6.0)+0.5M NaCl;
2、搅拌条件下,迅速加入2mM EDC(母液为:50mg/ml 0.25mol/ml)和5mM sulfo-NHS
(母液为:50mg/ml);室温反应15min;
3、搅拌条件下,加入20mM巯基乙醇(约1/600),室温反应10min(如果蛋白对巯基乙醇
敏感,请改用脱盐柱),活化完毕;
4、目标多肽稀释到适当浓度(考虑与BSA 有效羧基的mol数成一定比例),缓冲液为
100mM PB7.5。
5、搅拌条件下,室温反应2hr;
6、透析至pbs 。