合金的相结构与结晶资料
- 格式:ppt
- 大小:4.61 MB
- 文档页数:163






第四章合金的相结构与结晶4-1合金的相结构✧合金:金属与金属或金属与非金属熔合在一起,仍然具有金属特征的物质。
例 Fe-C Au-Cu Al-Si Pb-Sn✧组元:合金中最基本的,独立的物质元素、化合物。
例钢铁中的Fe Fe3C✧相:合金中具有相同结构、相同成分,与其他部分有界面分开的部分。
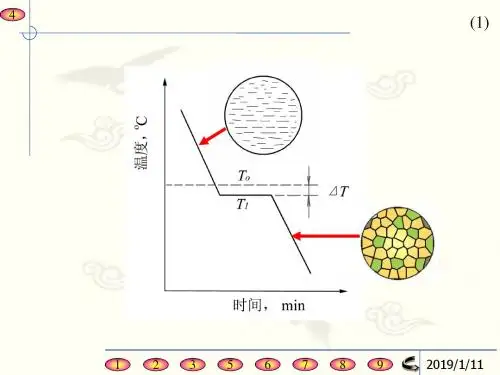
✧组织:在显微镜下观察相的大小、形态、分布特征。
组织是显微尺度,结构是原子尺度。
一、固溶体——溶质原子溶于固态金属中所形成的均匀新相。
根据溶质原子的位置可分为置换固溶体和间隙固溶体置换固溶体——溶质原子取代溶剂原子位置的固溶体。
无限固溶体有限固溶体间隙固溶体——溶质原子添于溶剂原子间隙之中。
✧必是有限固溶体✧因为溶质尺寸小!✧当d质/d剂<0.59时,形成间隙固溶体!元素 H B C N O原子半径(Å ) 0.46 0.97 o.77 0.71 0.60固溶体的性能✧机械性能随着溶解度的提高,强度、硬度提高,塑性、韧性下降。
原因:1)溶质原子引起晶格畸变,增加了位错移动阻力。
2)溶质原子易在位错线附近聚集,使位错运动困难。
固溶强化:通过溶入某种溶质元素形成固溶体而使强度、硬度提高的现象。
✧物理性能溶解度提高,导电率下降。
Ag是最好的导体,但在空气中会产生AgS,发黑。
加入Cu,抗腐蚀能力提高,导电率下降。
二、金属间化合物——合金组元相互作用形成的晶格类型和特性完全不同于任一组元的新相。
✧正常价化合物——严格遵守化合价规律的化合物。
由元素周期表中相距较远,电负性相差较大的两元素组成。
可用确定的化学式表示。
硬度高,脆性大。
是合金中的强化相。
例: Mg2Si Mg2Sn MnS等。
✧电子化合物——不遵守化合价规律但符合于一定电子浓度的化合物。
电子浓度:化合物中价电子数与原子数之比。
电子化合物主要以金属键结合,具有明显的金属特征,可以导电。
熔点、硬度高,塑性差,是有色金属中的重要强化相。
✧ 间隙化合物——由过渡族金属元素与碳、氮、氢、硼等原子半径较小的非金属元素形成的化合物。