三大平衡常数
- 格式:ppt
- 大小:457.00 KB
- 文档页数:24


溶液中的平衡常数【学习目标】掌握平衡常数的计算与应用合作探究一:平衡常数的计算【例1】(2008·山东)25℃时,CO2溶于水达到平衡时,溶液的pH=5.6,c(H2CO3)=1.5×10-5mol·L-1。
则H2CO3HCO3-+H+的平衡常数K= 。
(已知:10-5.60=2.5×10-6,忽略水的电离及碳酸的第二级电离)【例2】25 ℃时,0.1 mol·L-1 CH3COONa溶液pH=9,该温度下CH3COOH的电离平衡常数K a=。
【例3】(2009·山东)25 ℃时,将a mol•L﹣1的氨水与b mol•L﹣1盐酸等体积混合(混合后溶液体积为混合前两溶液的体积之和)。
若混合溶液显中性,则c(NH4+) c(Cl﹣)(填“>”“<”或“=”),计算该温度下NH3•H2O的电离平衡常数K b=。
【例4】(2013·山东)25℃时,H2SO3HSO3-+H+的电离常数K a=1×10-2 mol·L-1,则该温度下NaHSO3的水解平衡常数K h= mol·L-1,若向NaHSO3溶液中加入少量的I2,则溶液中c(SO32-)c(HSO3-)将(填“增大”“减小”或“不变”)。
【例5】已知25℃时,K sp[Fe(OH)3]=3.0×10-39,该温度下反应Fe (OH)3+3H+Fe3++H2O的平衡常数K=___________。
【例6】(2015·全国I)向含有I-、Cl-离子的浓缩液中滴加AgNO3溶液,当AgCl开始沉淀时,溶液中c(I-)c(Cl-)=______________。
【已知K sp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17】【巩固练习】1.T℃下,NH3•H2O的电离常数K b为2.0×10-5 mol·L-1,NH4+的水解平衡常数K h为1.5×10-8 mol·L-1 (水解平衡也是一种化学平衡,其平衡常数即水解常数),则该温度下水的离子积常数为,请判断T25 ℃(填“>”“<”“=”)。

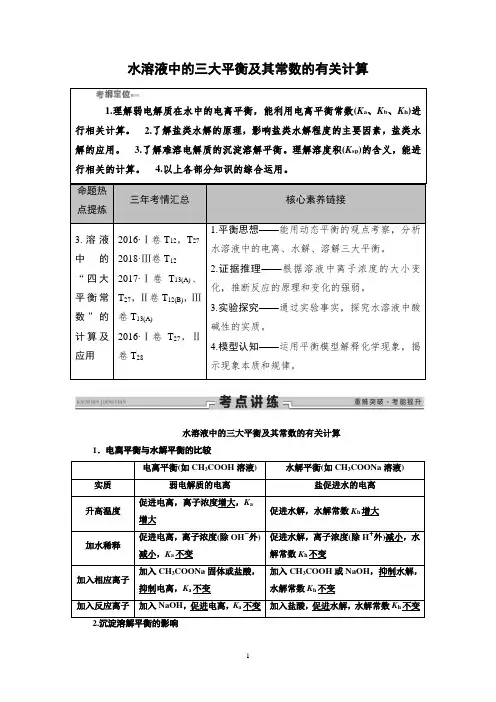
水溶液中的三大平衡及其常数的有关计算1.理解弱电解质在水中的电离平衡,能利用电离平衡常数(K a、K b、K h)进行相关计算。
2.了解盐类水解的原理,影响盐类水解程度的主要因素,盐类水解的应用。
3.了解难溶电解质的沉淀溶解平衡。
理解溶度积(K sp)的含义,能进行相关的计算。
4.以上各部分知识的综合运用。
命题热点提炼三年考情汇总核心素养链接3.溶液中的“四大平衡常数”的计算及应用2016·Ⅰ卷T12,T272018·Ⅲ卷T122017·Ⅰ卷T13(A)、T27,Ⅱ卷T12(B),Ⅲ卷T13(A)2016·Ⅰ卷T27,Ⅱ卷T281.平衡思想——能用动态平衡的观点考察,分析水溶液中的电离、水解、溶解三大平衡。
2.证据推理——根据溶液中离子浓度的大小变化,推断反应的原理和变化的强弱。
3.实验探究——通过实验事实,探究水溶液中酸碱性的实质。
4.模型认知——运用平衡模型解释化学现象,揭示现象本质和规律。
水溶液中的三大平衡及其常数的有关计算1.电离平衡与水解平衡的比较电离平衡(如CH3COOH溶液) 水解平衡(如CH3COONa溶液)实质弱电解质的电离盐促进水的电离升高温度促进电离,离子浓度增大,K a增大促进水解,水解常数K h增大加水稀释促进电离,离子浓度(除OH-外)减小,K a不变促进水解,离子浓度(除H+外)减小,水解常数K h不变加入相应离子加入CH3COONa固体或盐酸,抑制电离,K a不变加入CH3COOH或NaOH,抑制水解,水解常数K h不变加入反应离子加入NaOH,促进电离,K a不变加入盐酸,促进水解,水解常数K h不变(1)升高温度,沉淀、溶解平衡大部分右移,少部分左移。
(2)加少量水,溶解平衡右移,但离子浓度一般不变。
(3)加沉淀本身,溶解平衡不移动。
(4)加同离子可溶物,抑制溶解,溶解度减小,但K sp不变。
(5)加反应离子,促进溶解,溶解度增大,但K sp不变。

高三化学二轮复习—三大平衡常数1、理解化学平衡常数、电离平衡常数、溶度积的含义,会书写相应的表达式。
2、能利用化学平衡常数进行简单的计算。
3、知道平衡常数的应用。
一、自主复习: 1、平衡常数表达式:对于可逆反应:a A(g)+ b B(g) c C(g)+d D(g),其中a 、b 、c 、d 分别表示化学方程式中各反应物和生成物的化学计量数。
当在一定温度下达到化学平衡时,这个反应的平衡常数表达式为: 如CH 3COOH CH 3COO -+ H +,电离平衡常数 。
Fe(OH)3(s) Fe 3+(aq )+ 3OH -(aq ), 溶度积常数 。
2、平衡常数的意义:(1)化学平衡常数K 的大小能说明反应进行的程度(也叫反应的限度)。
K 值越大,表明反应进行得越 ;K 值越小,表示反应进行得越 。
(2)弱酸、弱碱的电离常数能够反映弱酸、弱碱酸碱性的相对强弱。
电离常数越大,弱酸(碱)的酸(碱)性越 , 反之,则越 。
(3)难溶电解质的K sp 的大小反映了难溶电解质在水中的溶解能力。
思考:根据下表的数据可以出什么结论? 结论:Ksp 和S 均可衡量物质在水中的溶解能力,只有相同类型的物质才有Ksp 越大S 越 的结论。
3、平衡常数的影响因素:平衡常数只与 有关。
若正反应是吸热反应,升高温度,K ;若正反应是放热反应,升高温度,K 。
二、平衡常数的应用1、利用K 值判断反应的热效应例1、现代炼锌的方法可分为火法和湿法两大类。
火法炼锌是将闪锌矿(主要含ZnS )通过浮选、焙烧使它转化为氧化锌,再把氧化锌和焦炭混合,在鼓风炉中加热至1373-1573K ,使锌蒸馏出来。
主要反应为:①焙烧炉中:2ZnS+3O 2=2ZnO+2SO 2 ②鼓风炉中:2C+O 2=2CO ③鼓风炉中:ZnO (s )+CO (g ) Zn(g)+CO 2(g )⑴请写出反应③的平衡常数表达式K= ,⑵若在其它条件不变时,在鼓风炉中增大CO 的浓度,平衡将向 移动,此时平衡常数 (填“增大”、“减小”或“不变”)。


化学五大平衡常数
1.酸碱平衡常数(Ka和Kb):酸的离解常数(Ka)和碱的离解常数(Kb)是描述酸碱反应平衡的重要参数。
它们可以用来计算酸或碱在溶液中的浓度,也可以用来预测反应的方向和平衡位置。
2. 配位平衡常数(Kf):配位平衡常数(Kf)描述了配位反应的平衡位置。
当金属离子与配体结合形成配位化合物时,Kf可以用来计算配位化合物的浓度,也可以用来预测反应的方向和平衡位置。
3. 溶解度平衡常数(Ksp):溶解度平衡常数(Ksp)描述了固体在溶液中的溶解度。
当固体在溶液中溶解时,Ksp可以用来计算其溶解度,也可以用来预测反应的方向和平衡位置。
4. 氧化还原电位(Eo):氧化还原电位(Eo)是描述氧化还原反应的重要参数。
它可以用来计算氧化还原反应的电动势,也可以用来预测反应的方向和平衡位置。
5. 晶体场分裂能(Dq):晶体场分裂能(Dq)是描述配位化合物中金属离子的能级分裂情况的参数。
它可以用来计算金属离子的能级,也可以用来预测反应的方向和平衡位置。
- 1 -。


高考的新宠“三大平衡常数”化学平衡常数、电离平衡常数、沉淀溶解平衡常数位于选修四《化学反应原理》部分,属于新课标的新增内容。
从近几年的高考中发现,化学平衡常数早已成为了高考命题的热点内容;电离平衡常数和沉淀溶解平衡常数也渐有“升温”的表现,因此,可以预测这“三大平衡常数”在今后的高考中,将继续成为今后高考的重点及热点。
下面将分类追踪透析。
一、化学平衡常数典例1、(2008年宁夏卷)将固体NH4I置于密闭容器中,在一定温度下发生下列反应:达到平衡时,c(H2)=0.5mol·L-1,c(HI)=4mol·L-1,则此温度下反应①的平衡常数为( )A.9 B.16C.20D.25解析:由平衡时氢气的浓度可求得反应②分解消耗HI的浓度,c(HI)= 0.5mol·L-1×2=1mol/L,故①式生成c(HI)= c(HI)平衡+ c(HI)分解= 4mol·L-1+1mol/L =5mol·L-1,c(NH3)平衡= c(HI)①= 5mol·L-1,根据化学平衡常数公式K= c(NH3)平衡×c(HI)平衡=5 mol/L×4mol·L-1,故答案选C。
点评:本题考查的是应用化学平衡常数公式求算化学平衡常数。
学生易错选D,原因是将①式生成的c(HI)= 5 mol/L代入了公式中进行了求算,而未带入平衡时HI的浓度(4mol·L-1)。
因此,在求算化学平衡常数时,一定要严格的按照化学平衡常数的含义进行。
方法规律:①对于一般的可逆反应:mA(g)+ nB(g) pC(g)+qD(g),其中m、n、p、q分别表示化学方程式中个反应物和生成物的化学计量数。
当在一定温度下达到化学平衡时,这个反应的平衡常数公式可以表示为:,各物质的浓度一定是平衡时的浓度,而不是其他时刻的.②在进行K值的计算时,固体和纯液体的浓度可视为“1”。


解读“三大平衡常数”,2010年高考的新爱化学平衡常数、电离平衡常数、沉淀溶解平衡常数属于选修四《化学反应原理》部分,是高考考试大纲新增内容。
从近几年的高考中发现,化学平衡常数早已成为了高考命题的热点内容;电离平衡常数和沉淀溶解平衡常数也渐有“升温”的表现,因此,可以预测这“三大平衡常数”在2010年的高考中,将继续成为高考考查的重点及热点。
下面将分类追踪透析。
一、考查化学平衡常数例1.(08年山东理综·14)高温下,某反应达到平衡,平衡常数)H ()CO ()O H ()CO (222c c c c K ⋅⋅=。
恒容时,温度升高,H 2浓度减小。
下列说法正确的是( ) A .该反应的焓变为正值B .恒温恒容下,增大压强,H 2浓度一定减小C .升高温度,逆反应速率减小D .该反应的化学方程式为CO +H 2OCO 2+H 2答案:A解析:由平衡常数的表达式可得,该反应化学方程式应为CO 2+H 2CO+H 2O ,故D 错;由题意知,温度升高,平衡向正反应移动,说明正反应为吸热反应,故该反应的焓变为正值,A 正确;恒温恒容下,增大压强,H 2浓度一定增大而不会减小,故B 错;C 项,升高温度,正逆反应速率都会增大,故C 错。
例2.(08年宁夏理综·12)将固体NH 4I 置于密闭容器中,在一定温度下发生下列反应: ①NH 4I(s)NH 3(g)+HI(g);②2HI(g)H 2(g)+I 2(g)达到平衡时,c (H 2)=0.5mol·L -1,c (H I )=4mol·L -1,则此温度下反应①的平衡常数为 A .9B .16C .20D .25答案:C解析:由平衡时氢气的浓度可求得反应②分解消耗HI 的浓度,c(HI)= 0.5mol·L -1×2=1mol/L ,故①式生成c(HI)= c(HI)平衡+ c(HI)分解= 4mol·L -1+1mol/L =5mol·L -1,c(NH 3)平衡= c (HI)①= 5mol·L -1,根据化学平衡常数公式K= c(NH 3)平衡×c (HI)平衡=5 mol/L×4mol·L -1,故答案选C 。
各种平衡常数的名词解释平衡常数是化学反应中的一个重要指标,用于描述反应物与生成物之间的平衡状态。
在化学反应中,当反应物与生成物之间达到一种稳定状态时,反应会停止,此时反应物与生成物的浓度不再发生明显变化,这种状态被称为平衡态。
平衡常数可以通过平衡态下反应物与生成物的浓度关系来计算,它是一种衡量反应偏向性的指标,能够帮助我们理解反应的趋势与性质。
一、酸碱平衡常数酸碱平衡常数是描述酸碱反应平衡状态的一个重要参数。
在酸碱反应中,酸与碱之间会发生中和反应,生成水和盐。
酸碱平衡常数(Ka和Kb)可以通过浓度关系来计算。
酸的平衡常数Ka是酸解离产生H+离子的能力的度量,即酸的强弱程度。
Ka越大,表示酸越强,它可以通过酸解离度(酸解离产生的H+离子的浓度与初始酸浓度之比)来计算。
例如,对于强酸HCl,其酸解离度接近100%,因此其Ka值非常大。
而对于弱酸CH3COOH,其酸解离度较小,因此其Ka值较小。
碱的平衡常数Kb是指碱在水中产生OH-离子的能力的度量,即碱的强弱程度。
Kb越大,表示碱越强,它可以通过碱解离度(碱解离产生的OH-离子的浓度与初始碱浓度之比)来计算。
二、溶解平衡常数溶解平衡常数是描述溶解过程中固体物质与溶液之间的平衡状态的一个参数。
在溶解过程中,溶质与溶剂之间发生相互作用,形成溶液。
一些物质能够完全溶解于溶液中,称为易溶性物质;而一些物质只能部分溶解,称为难溶性物质。
溶解平衡常数Ksp是溶解过程中溶解物的离解程度的度量。
对于一个难溶性物质MX,其溶解反应可以表示为MX(s) ⇌ M+(aq) + X-(aq),Ksp可以通过溶解度积(M+离子与X-离子的浓度的乘积)来计算。
溶解平衡常数的大小与溶解度有关,溶解度越大,溶解平衡常数Ksp越大。
三、氧化还原平衡常数氧化还原反应是化学反应中常见的一类反应,涉及物质的电子转移过程。
在氧化还原反应中,氧化剂接受电子,而还原剂失去电子。
氧化还原平衡常数K是描述氧化还原反应平衡状态的一个参数。
溶液中的平衡常数【学习目标】掌握平衡常数的计算与应用合作探究一:平衡常数的计算【例1】(2008·山东)25℃时,CO2溶于水达到平衡时,溶液的pH=5.6,c(H2CO3)=1.5×10-5mol·L-1。
则H2CO3HCO3-+H+的平衡常数K= 。
(已知:10-5.60=2.5×10-6,忽略水的电离及碳酸的第二级电离)【例2】25 ℃时,0.1 mol·L-1 CH3COONa溶液pH=9,该温度下CH3COOH的电离平衡常数K a=。
【例3】(2009·山东)25 ℃时,将a mol•L﹣1的氨水与b mol•L﹣1盐酸等体积混合(混合后溶液体积为混合前两溶液的体积之和)。
若混合溶液显中性,则c(NH4+) c(Cl﹣)(填―>‖―<‖或―=‖),计算该温度下NH3•H2O的电离平衡常数K b=。
【例4】(2013·山东)25℃时,H2SO3HSO3-+H+的电离常数K a=1×10-2 mol·L-1,则该温度下NaHSO3的水解平衡常数K h= mol·L-1,若向NaHSO3溶液中加入少量的I2,则溶液中c(SO32-)c(HSO3-)将(填―增大‖―减小‖或―不变‖)。
【例5】已知25℃时,K sp[Fe(OH)3]=3.0×10-39,该温度下反应Fe (OH)3+3H+Fe3++H2O的平衡常数K=___________。
【例6】(2015·全国I)向含有I-、Cl-离子的浓缩液中滴加AgNO3溶液,当AgCl开始沉淀时,溶液中c(I-)c(Cl-)=______________。
【已知K sp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17】【巩固练习】1.T℃下,NH3•H2O的电离常数K b为2.0×10-5 mol·L-1,NH4+的水解平衡常数K h为1.5×10-8 mol·L-1 (水解平衡也是一种化学平衡,其平衡常数即水解常数),则该温度下水的离子积常数为,请判断T25 ℃(填―>‖―<‖―=‖)。
2020年高三化学下学期二轮提升训练:——溶液中“四大平衡常数”的理解和应用【知识补漏】1.三大平衡常数对比电离平衡水解平衡沉淀溶解平衡举例NH3·H2O NH+4+OH-NH+4+H2ONH3·H2O+H+PbI2(s)Pb2+(aq)+2I-(aq)平衡表达式Kb=c NH+4·c OH-c NH3·H2OKb=错误!Ksp=c(Pb2+)·c2(I-)影响平衡常数的因素内因:弱电解质的相对强弱外因:温度,温度越高,电离程度越大,平衡常数越大盐的水解程度随温度的升高而增大,K b随温度的升高而增大内因:难溶电解质在水中的溶解能力外因:K sp与温度有关浓度对平衡的影响电离平衡、水解平衡、沉淀溶解平衡同化学平衡一样都为动态平衡,平衡的移动符合平衡移动原理(勒夏特列原理),浓度对平衡常数没影响①加水均能促进三大平衡正向移动;②加入与电解质溶液中相同的微粒,都能使平衡逆向移动;③三大平衡都不受压强的影响。
2.“三大常数”间的两大等式关系(1)CH3COONa、CH3COOH溶液中,K a、K h、K w的关系是K w=K a·K h。
(2)M(OH)n悬浊液中K sp、K w、pH间关系,M(OH)n(s)M n+(aq)+n OH-(aq)Ksp =c(M n+)·c n(OH-)=c OH-n·c n(OH-)=c n+1OH-n=1n⎝⎛⎭⎪⎫K w10-pHn+1。
3.溶液中的“四大常数”使用常见的错误(1)K a、K h、K w、K sp数值不随其离子浓度的变化而变化,只与温度有关,K a、Kh、K w随着温度的升高而增大。
在温度一定时,平衡常数不变,与化学平衡是否移动无关。
(2)K w常误认为是水电离的c(H+)与c(OH-)的乘积。
(3)只有常温下水的离子积K w=1.0×10-14 mol2·L-2(4)误认为只要K sp越大,其溶解度就会越大。
平衡常数的计算公式平衡常数是描述一个反应物中活性粒子的密度的量,能够反映反应的条件和环境。
它确定了反应物的行为和性能。
此可见,平衡常数的计算公式十分重要,下面由文章旨在介绍平衡常数的计算公式以及它在化学反应中的重要性。
一般情况下,平衡常数的计算公式可以分为三种,即:气体平衡常数、液体平衡常数和固体平衡常数。
对气体的平衡常数的计算公式为:Kc=P/P0其中,Kc表示平衡常数,P是该反应系统的平衡态气体的压力,而P0则是反应开始时,该反应系统的压力。
而液体的平衡常数计算公式为:Ks=Cs/C0,其中Ks表示平衡常数,Cs是反应系统在平衡态时的溶液浓度,而C0则代表反应开始时,该反应系统的溶液浓度。
最后,固体的平衡常数计算公式为:Kf=n/n0,其中Kf代表平衡常数,n表示反应系统在平衡态时,固体物质的摩尔质量,而n0则代表反应开始时,该反应系统的固体物质的摩尔质量。
可以看出,不同实际状况下,平衡常数都可以由以上公式得出,但在实际应用中还有一些注意事项。
例如,在计算气体平衡常数时,应考虑温度及风力等因素的影响;而计算液体平衡常数时,应考虑溶液的PH值和温度等因素的影响;在计算固体平衡常数时,应考虑物质的pH值、温度和时间等因素的影响。
平衡常数在化学反应中有着重要的作用,它能够控制反应的速率,因此,熟练掌握平衡常数的计算公式对于更好地了解、控制反应及其结果十分重要。
平衡常数的计算方法有很多种,但最简单有效的方法是拟合法。
拟合法可以在不改变反应物和反应条件的情况下,根据反应双方的浓度随时间变化趋势,计算出平衡常数。
这种方法虽说有点复杂,但能够完美地反映反应的过程,从而给出精确的计算结果。
另外,平衡常数的计算还可以采用经验法。
经验法是根据大量的实验数据,运用统计学原理,拟合合理的公式。
经验法比拟合法快很多,但由于公式的相对简单,得出的结果的精确性可能会有所差别。
此外,对于某些复杂的反应,可以采用数值模拟法计算平衡常数,它由反应动力学理论支撑,可以完整地描述反应过程,而不需要将复杂的结果拟合到特定的公式中。
三大平衡与三大常数电离平衡、水解平衡、沉淀溶解平衡是溶液中的三大平衡。
这三种平衡都遵循勒夏特列原理——当只改变体系的一个条件时,平衡向能够减弱这种改变的方向移动。
知识精讲1.抓住“四因素”突破弱电解质的电离平衡弱电解质的电离是可逆过程,在分析外界条件对电离平衡的影响时,要灵活运用勒夏特列原理,结合实例进行具体分析。
一般考虑以下几个方面的影响:(1)溶液加水稀释:弱电解质溶液的浓度越小,电离程度越大;但在弱酸溶液中c(H+)减小,弱碱溶液中c(OH-)减小。
(2)加热:电离是吸热的,加热使电离平衡向右移动,溶液中弱电解质分子数减小,溶液中离子浓度增大。
(3)同离子效应:当向弱电解质溶液中加入的物质含有与弱电解质相同的离子时,由于同种离子的相互影响,使电离平衡向左移动,弱电解质的电离程度减小。
(4)加入能反应的物质:当向弱电解质溶液中加入的物质能和弱电解质电离出的离子反应时,电离平衡向右移动,参加反应的离子浓度减小,其他的离子浓度增大。
2.“用规律”、“抓类型”突破盐类水解问题(1)规律:难溶不水解,有弱才水解,无弱不水解;谁弱谁水解,越弱越水解,都弱都水解;谁强显谁性,同强显中性,弱弱具体定;越弱越水解,越热越水解,越稀越水解。
(2)类型:①强碱弱酸盐,阴离子水解,其水溶液呈碱性,如醋酸钠水解的离子方程式为CH3COO-+H2O==CH3COOH+OH-;多元弱酸酸根分步水解,如碳酸钠水解的离子方程式为CO2-3+H2O==HCO-3+OH-、HCO-3+H2O==H2CO3+OH-。
②强酸弱碱盐,阳离子水解,其水溶液呈酸性,如氯化铵、氯化铝水解的离子方程式分别为NH+4+H2O ==H++NH3·H2O、Al3++3H2O==Al(OH)3+3H+。
③NaCl等强酸强碱盐不水解,溶液呈中性。
④弱酸弱碱盐双水解,其溶液的酸碱性取决于弱酸和弱碱的相对强弱。
当K a=K b时,溶液显中性,如CH3COONH4;当K a>K b时,溶液显酸性,如HCOONH4;当K a<K b时,溶液显碱性,如NH4HCO3。