氯的含氧酸及其盐汇编
- 格式:ppt
- 大小:2.46 MB
- 文档页数:14

第四章非金属及其化合物第12讲富集在海水中的元素——卤素(精讲)【考情分析】本讲内容与化工生产、日常生活、科学技术等方面有着广泛的联系,如氯碱工业、漂白粉应用、饮用水消毒、环境保护等,往往与氧化还原反应、离子反应、化学实验方案的设计与评价等知识结合出现。
预计今后:1.以氯单质及其重要化合物的性质、用途设计选择题;2.以制取氯气设计有关实验题;3.根据同主族元素性质的相似性设计信息题,考查溴、碘及其重要性质和用途。
【核心素养分析】1.宏观辨识与微观探析:能从宏观和微观相结合的视角分析与解决实际问题,在卤素学习过程中,使用“宏观—微观—结合”来认识物质及其递变规律,形成科学的方法论。
2.科学探究与创新意识:能和同学交流实验探究的成果,提出进一步探究或改进氯及其化合物的制备及性质实验的设想,培养勇于质疑和批判的创新精神。
认识科学探究是进行科学发现、创造和应用的科学实践活动;能从问题和假设出发,依据探究目的,设计探究方案,获得卤素单质的提取方法。
3.科学态度与社会责任:认识氯及其化合物对环境的影响,形成绿色环保的意识。
关注与化学有关的社会热点问题。
了解环境保护与资源开发的关系.具有绿色化学观念。
勇于承担责任,权衡利弊,积极参与化学问题的社会决策。
【网络构建】【知识梳理】智能点一氯气及其重要化合物(一)氯气1.物理性质【特别提醒】实验室里闻有毒气体及未知气体气味的方法是:用手在瓶口轻轻扇动,仅使极少量气体飘进鼻孔。
2.化学性质1)从氯的原子结构认识氯气的氧化性:依据氯气的氧化性完成下列方程式: (1)与金属反应①Fe :2Fe +3Cl 2=====点燃2FeCl 3,棕红色烟。
②Cu :Cu +Cl 2=====点燃CuCl 2,棕黄色烟。
(2)与非金属反应H 2:H 2+Cl 2=====点燃2HCl ,苍白色火焰; H 2和Cl 2的混合气体光照时会发生爆炸。
(3)与还原性无机化合物反应:①与碘化钾溶液反应:Cl 2+2KI===2KCl +I 2。

卤素的含氧酸及其盐Cl、Br、I具有不同价态的含氧酸。
X: 采取SP3杂化:O的2P电子与卤素3d空轨道间形成d-pπ键。
由于稳定性原因,只有常见的氯的含氧酸研究得多。
一、次卤酸1. 化学性质(1) 酸性因为随半径增大,分子中 H— O—X,X—O 结合力减小,X 对 H+斥力变小,导致酸性减小。
(2) 热稳定性HXO都不稳定,仅存在于水溶液中,从Cl到I稳定性减小,分解方式:脱水分解:由上式可知,ClO是HClO的酸酐。
BrO-室温下发生歧化分解,只有在273K2-盐。
可见XO-的歧时才有BrO- 存在, 323 ~ 353K时,BrO-完全转变成BrO3化速率与温度有关,温度升高,歧化速率增大。
IO-歧化速率更快,溶液中不存在次碘酸盐,HIO几乎不存在。
(3) 氧化性HXO不稳定,表明HXO的氧化性很强。
XO-盐比HXO酸稳定性高,所以经常用其盐在酸性介质中做氧化剂。
2.HXO的制备1)次氯酸酐Cl2O溶于水制得HClO步骤:将Cl2通到新制干燥的HgO表面,加热制得Cl2O从体系中除去HCl可使平衡右移,可采用下法。
在Cl2水中加入新生成的HgO或碳酸盐减压蒸馏得到HClO。
工业上采用电解冷的稀NaCl溶液的方法。
同时搅拌电解液,使产生的氯气与NaOH充分反应制得次氯酸钠减压蒸馏得HClO。
将阳极产生的Cl2通入阴极区NaOH中。
二、亚卤酸及其盐1.性质亚卤酸中仅存在HClO2,酸性大于HClO,Ka=5.0HClO2不稳定,ClO2-在溶液中较稳定,具有强氧化性,NaClO2盐较稳定,加热,撞击爆炸分解,在溶液中受热分解。
2. 制备方法1)过滤除去BaSO4可制得纯净HClO2,但HClO2不稳定,很快分解。
可见ClO2不是HClO2的酸酐,ClO2冷凝时为红色液体。
2) ClO2与碱作用可得到亚氯酸盐和氯酸盐。
首先制取ClO2,其方法用SO2还原NaClO33) Na2O2(H2O2)与ClO2作用制备纯NaClO2。

上海高考化学三年(2020-2022)模拟题分类汇编-22卤素及其化合物(1)一、单选题1.(2022·上海浦东新·统考模拟预测)进行下列封管实验都产生明显现象,其中不涉及化学反应的是A .B .C .D .2.(2022·上海浦东新·统考模拟预测)将pH 传感器、氯离子传感器、氧气传感器分别插入盛有氯水的广口瓶中,用强光照射,测得的实验数据如图所示。
下列说法正确的是A .图甲中pH 减小是由于光照促进了HClO 的电离B .图乙中()Clc -增大主要是由于反应消耗了水C .图丙中氧气的体积分数增大是由于HClO 的分解D .该体系中存在两个电离平衡和两个化学平衡3.(2022·上海奉贤·一模)常温下,在pH=1的无色溶液中,能大量共存的一组离子是A .K +、Na +、SO 23-、Br -B .Na +、K +、ClO -、NO 3-C .K +、Cl -、Fe 3+、SO 24-D .Al 3+、Na +、Cl -、NO 3-4.(2022·上海金山·统考一模)实验室用盐酸和二氧化锰制备2Cl ,有关说法正确的是A .增大盐酸的浓度能加快反应速率B .用稀盐酸则反应速率较慢A.大理石和稀盐酸C.Cu和浓硝酸A .溶液中氯离子浓度C .生成氧气物质的量8.(2022·上海杨浦·统考一模)不能由单质化合生成的物质是A .2Cu SB .3SO 9.(2022·上海金山·统考二模)下列有关实验室制取22尾气处理C .氯水久置后pH 值减小,漂白性减弱D .干燥的氯气不能使鲜花褪色18.(2022·上海黄浦·统考二模)下列物质中既含有氯离子又含有氯分子的是A .氯水B .液氯C .次氯酸D .氯化钠19.(2022·上海黄浦·统考二模)84消毒液(含NaClO )与洁厕灵(含浓盐酸)不能混用,会发生反应产生有毒的气体,该反应中A .NaClO 为还原剂B .HCl 仅体现酸性C .2Cl 既是氧化产物也是还原产物D .2H O 是还原产物20.(2022·上海嘉定·统考一模)某些物质若混合使用可以增加使用效果,下列做法正确的是A .氯化铵与草木灰混合使用提高肥效B .84消毒液与含盐酸的洁厕灵混合使用提高杀菌效果C .二氧化硫与新制氯水混合使用提高漂白效果D .高锰酸钾溶液和稀硫酸混合使用增加氧化性21.(2022·上海嘉定·统考二模)测定“84”消毒液中次氯酸钠的浓度可用下面方法:取10.00 mL 消毒液,调节pH 后,以淀粉为指示剂,用0.100mol·L -1 KI 溶液进行滴定,当溶液出现稳定浅蓝色时为滴定终点。

素养说明:氯的氧化物、含氧酸及含氧酸盐是近几年高考实验探究新宠,通过对含氯化合物的性质探究,能培养学生变化观念的核心素养。
1. 氯的常见氧化物的性质(1)一氧化二氯性质:是次氯酸的酸酐,溶于水产生不稳定的次氯酸并最终变为盐酸外观与性状:黄棕色气体,有刺激性气味。
制法:用新制备的黄色氧化汞与氯气反应可制得一氧化二氯:2HgO+2Cl2===Cl2O+HgCl2·HgO同样也可以用氯气与潮湿的碳酸钠反应来制取:2Na2CO3+H2O+2Cl2===2NaCl+2NaHCO3+Cl2O(2)二氧化氯物理性质:是一种黄绿色到橙黄色的气体,极易溶于水。
制取:Cl2+2NaClO2===2ClO2↑+2NaCl或:5NaClO2+4HCl===4ClO2↑+5NaCl+2H2O用途:是一种广谱、高效的灭菌剂。
(3)Cl2O3、Cl2O5、Cl2O7分别为HClO2、HClO3、HClO4的酸酐。
2.氯的含氧酸(1)氯的含氧酸的种类氯的含氧酸有:HClO(次氯酸)、HClO2(亚氯酸)、HClO3(氯酸)、HClO4(高氯酸)。
(2)氯的含氧酸的性质酸性:HClO4>HClO3>HClO2>HClO氧化性:HClO>HClO2>HClO3>HClO43.氯的含氧酸盐(1)NaClO2(亚氯酸钠)性质:黄绿色液体,呈碱性,是一种强氧化剂,遇酸放出ClO2气体。
用途:是一种高效氧化剂漂白剂。
主要用于棉纺、亚麻、纸浆漂白、食品消毒、水处理、杀菌灭藻和鱼药制造。
(2)氯酸钾(KClO3)性质:是一种白色晶体,有毒,在冷水中溶解度较小,易溶于热水。
是强氧化剂。
用途:可用作制造炸药,也可用来制造火柴、烟火。
[题型专练]1.(2018·山东济宁教学质量检测,12)Cl2O是黄棕色具有强烈刺激性气味的气体,是一种强氧化剂,易溶于水且会与水反应生成次氯酸,与有机物、还原剂接触或加热时会发生燃烧并爆炸。
一种制取Cl2O的装置如图所示。

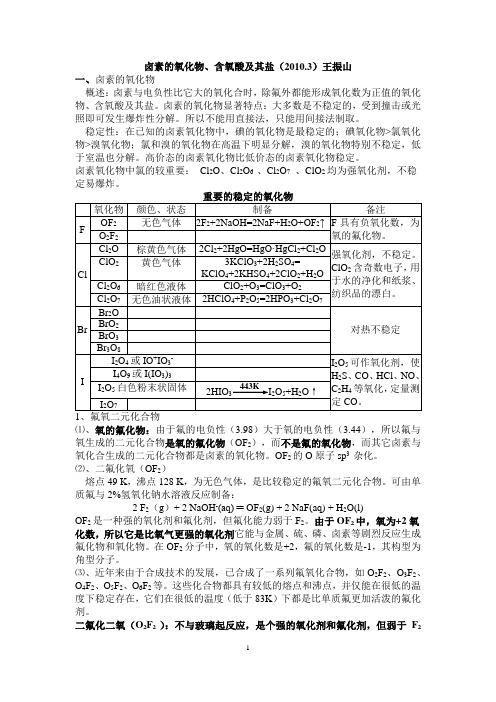
卤素的氧化物、含氧酸及其盐(2010.3)王振山一、卤素的氧化物概述:卤素与电负性比它大的氧化合时,除氟外都能形成氧化数为正值的氧化物、含氧酸及其盐。
卤素的氧化物显著特点:大多数是不稳定的,受到撞击或光照即可发生爆炸性分解。
所以不能用直接法,只能用间接法制取。
稳定性:在已知的卤素氧化物中,碘的氧化物是最稳定的;碘氧化物>氯氧化物>溴氧化物;氯和溴的氧化物在高温下明显分解,溴的氧化物特别不稳定,低于室温也分解。
高价态的卤素氧化物比低价态的卤素氧化物稳定。
卤素氧化物中氯的较重要:Cl2O、Cl2O6 、Cl2O7、ClO2均为强氧化剂,不稳定易爆炸。
⑴、氧的氟化物:由于氟的电负性(3.98)大于氧的电负性(3.44),所以氟与氧生成的二元化合物是氧的氟化物(OF2),而不是氟的氧化物,而其它卤素与氧化合生成的二元化合物都是卤素的氧化物。
OF2的O原子sp3杂化。
⑵、二氟化氧(OF2)熔点49 K,沸点128 K,为无色气体,是比较稳定的氟氧二元化合物。
可由单质氟与2%氢氧化钠水溶液反应制备:2 F2(g)+ 2 NaOH-(aq) ═ OF2(g) + 2 NaF(aq) + H2O(l)OF2是一种强的氧化剂和氟化剂,但氟化能力弱于F2。
由于OF2中,氧为+2氧化数,所以它是比氧气更强的氧化剂它能与金属、硫、磷、卤素等剧烈反应生成氟化物和氧化物。
在OF2分子中,氧的氧化数是+2,氟的氧化数是-1,其构型为角型分子。
⑶、近年来由于合成技术的发展,已合成了一系列氟氧化合物,如O2F2、O3F2、O4F2、O5F2、O6F2等。
这些化合物都具有较低的熔点和沸点,并仅能在很低的温度下稳定存在,它们在很低的温度(低于83K)下都是比单质氟更加活泼的氟化剂。
二氟化二氧(O2F2 ):不与玻璃起反应,是个强的氧化剂和氟化剂,但弱于F2本身:比OF2、ClF3有更强的氟化作用,能在OF2、ClF3不能完成的反应中将金属钚和钚的化合物氧化:Pu(s) + 3O2F2(g) →PuF6(g) + 3O2(g) 该反应用来从废核燃料中以挥发性PuF6的形式除去强放射性的金属Pu。

1.5 卤素含氧酸及其盐1.5.1 系统命名含氧酸是指酸根中含有氧原子的酸,即以氧原子为成酸元素的配位体的酸,例如HClO3,H2SO4,HNO3,H2CO3中的成酸元素分别是Cl、S、N、C它们的配位原子是氧,所以这些酸都属于含氧酸的范畴。
含氧酸的命名规则主要参考国际纯粹和应用化学联合会(简称IUPAC)1970年公布的《无机化学命名法》。
见表1—8表1—8 卤素含氧酸的命名需要说明几点:1.关于正酸,含氧酸中只含有一个成酸元素的原子,而且该成酸元素的氧化态是该元素最常见的氧化态。
最常见氧化态有的与它在元素周期表中所在族的族数相同,有的则与族数不相同。
如硫酸中硫的氧化态为+6,它处于第Ⅵ族,而正氯酸中氯的氧化态为+5,然而它处于第Ⅶ族。
2.关于高酸是指含氧酸成酸元素的氧化态比正酸的成酸元素为高。
称之为高酸。
如高氯酸的成酸元素氯的氧化态为+7,而正氯酸的成酸元素氯的氧化态为+5。
3.关于原酸是指成酸元素氧化数和羟基酸数目相同的酸。
如H4SiO4为原硅酸。
原酸失去一个或二个以上的水分子,即生成正酸。
譬如H5PO5原磷酸,倘若失一份水生成H3PO4为正磷酸。
H6TeO6为原碲酸,失去二份水生成H2TeO4为正碲酸。
自一个分子正酸缩去一分水而成的酸为偏酸,如HIO4为偏高碘酸。
也所以称为三缩原碘酸。
4.关于亚酸与次酸,卤素含氧酸成酸元素的氧化态,有两种氧化态比正酸的成酸元素的氧化态低,那么氧化态较低的一种含氧酸称为亚酸,如HOClO为亚氯酸,氧化态更低的一种含氧酸称为次氯酸HOCl。
如果仅有一种比正酸较低的氧化态,则称为亚酸,如H3AsO3为亚砷酸。
1.5.2存在状态卤素含氧酸的存在状态见表1—9。
a.只有在水溶液中稳定存在。
b.采用真空蒸馏,在有脱水剂存在时所得到无水纯液体酸—高氯酸。
c.碘酸HIO3、偏高碘酸(HIO4)、正高碘酸(HO)5IO为固体酸,为无色晶体。
熔融时分解为HIO3:表1—9 卤素的含氧酸在真空中加热到353K,(HO)5IO部分失水,生成焦高碘酸:2H5IO6H4I2O9+3H2O在真空(约1620Pa)中,焦高碘酸加热到373K,生成偏高碘酸:H5IO6HIO4+2H2O正高碘酸根[IO6]5-其结构如图1—9所示:图1-9 [IO6]5-离子的结构正八面体型。

《氯及其化合物》氯的化合物稳定性氯是一种常见的化学元素,在自然界中广泛存在,并且形成了多种化合物。
这些氯的化合物在不同的条件下表现出不同的稳定性,这对于理解和应用它们具有重要意义。
首先,我们来看看氯化氢(HCl)。
氯化氢是一种无色有刺激性气味的气体。
在常温常压下,氯化氢相对稳定,但在有水存在的情况下,它会迅速溶解形成盐酸溶液。
盐酸是一种强酸,具有较强的腐蚀性。
氯与金属形成的化合物中,氯化钠(NaCl)是最为常见和稳定的。
氯化钠就是我们日常生活中所熟知的食盐,其化学性质非常稳定。
在正常的环境条件下,氯化钠不易发生分解或变质。
这是因为钠离子和氯离子之间的离子键较强,需要较高的能量才能打破。
再说说氯化银(AgCl)。
氯化银是一种白色沉淀,在光照条件下会逐渐分解变黑。
这一特性使得氯化银在摄影中曾被广泛应用。
其不稳定性主要源于银离子对光的敏感性。
接下来是氯酸钾(KClO₃)。
氯酸钾是一种强氧化剂,具有一定的不稳定性。
在受到撞击、摩擦或加热时,可能会发生剧烈的分解反应,释放出氧气。
因此,在储存和使用氯酸钾时,需要格外小心,遵循严格的安全规定。
次氯酸(HClO)是一种较弱且不稳定的酸。
它在溶液中容易分解为盐酸和氧气。
次氯酸具有强氧化性,常用于消毒和漂白。
但由于其不稳定性,通常需要现用现配。
氯酸(HClO₃)和高氯酸(HClO₄)也是氯的含氧酸。
氯酸具有较强的氧化性和不稳定性,而高氯酸则相对较为稳定。
影响氯的化合物稳定性的因素有很多。
首先是化学键的类型和强度。
离子键通常比共价键更稳定,例如氯化钠中的离子键使其具有较高的稳定性。
而共价键的强度则取决于原子之间的共用电子对的分布和结合方式。
环境条件也起着重要作用。
温度、光照、湿度等都可能影响化合物的稳定性。
例如,光照会导致氯化银分解。
化合物的浓度和纯度也会对稳定性产生影响。
杂质的存在可能会促进或抑制某些化学反应,从而改变化合物的稳定性。
在实际应用中,了解氯的化合物的稳定性至关重要。

全国通用2020_2022三年高考化学真题分项汇编:专题05 元素及其化合物2022年高考真题1.(2022·浙江卷)下列消毒剂的有效成分属于盐的是A .高锰酸钾溶液B .过氧乙酸溶液C .双氧水D .医用酒精 【答案】A【解析】A .高锰酸钾溶液的有效成分为KMnO 4,其在水溶液中电离出K +和-4MnO ,故KMnO 4属于盐,A 符合题意;B .过氧乙酸溶液的有效成分是CH 3COOOH ,在水溶液中电离出CH 3COOO -和H +,即水溶液中的阳离子全部为H +,故其属于酸,不合题意;C .双氧水是由H 和O 组成的化合物,故其属于氧化物,C 不合题意;D .医用酒精的有效成分为CH 3CH 2OH ,其属于有机物,不属于盐,D 不合题意; 故答案为:A 。
2.(2022·浙江卷)下列说法不正确...的是 A .晶体硅的导电性介于导体和绝缘体之间,常用于制造光导纤维B .高压钠灯发出的黄光透雾能力强、射程远,可用于道路照明C .氧化铝熔点高,常用于制造耐高温材料D .用石灰右-石膏法对燃煤烟气进行脱硫,同时可得到石膏【答案】A【解析】A .晶体硅的导电性介于导体和绝缘体之间,是良好的半导体材料,可用于制造晶体管、集成电路等,而二氧化硅常用于制造光导纤维,A 错误;B .钠的焰色反应为黄色,可用作透雾能力强的高压钠灯,B 正确;C .耐高温材料应具有高熔点的性质,氧化铝熔点高,可用作耐高温材料,C 正确;D .石灰石的主要成分为碳酸钙,石灰石-石膏法脱硫过程中发生反应:CaCO 3=高温CaO+CO 2↑,SO 2+CaCO 3=CaSO 3+CO 2,2CaSO 3+O 2=2CaSO 4,得到了石膏,D 正确;答案选A 。
3.(2022·浙江卷)下列说法正确的是A .工业上通过电解六水合氯化镁制取金属镁B .接触法制硫酸时,煅烧黄铁矿以得到三氧化硫C .浓硝酸与铁在常温下不能反应,所以可用铁质容器贮运浓硝酸D .“洁厕灵”(主要成分为盐酸)和“84消毒液”(主要成分为次氯酸钠)不能混用【答案】D【解析】A .六水合氯化镁没有自由移动的离子,不能导电,工业上通过电解熔融的无水氯化镁制取金属镁,A 不正确;B .接触法制硫酸时,煅烧黄铁矿只能得到二氧化硫,二氧化硫在接触室经催化氧化才能转化为三氧化硫,B 不正确;C .在常温下铁与浓硝酸发生钝化反应,在铁表面生成一层致密的氧化物薄膜并阻止反应继续发生,所以可用铁质容器贮运浓硝酸,C 不正确;D .“洁厕灵”(主要成分为盐酸)和“84消毒液”(主要成分为次氯酸钠)不能混用,若两者混用会发生归中反应生成氯气,不仅达不到各自预期的作用效果,还会污染环境,D 正确; 综上所述,本题选D 。



系列一 主族非金属专题9 氯的氧化物及其含氧酸一、氯的氧化物-ClO 21. ClO 2的制取(1)实验室制法把氯酸钠、亚硫酸钠和稀H 2SO 4混合水浴加热可制得黄棕色的ClO 2气体,化学方程式为2NaClO 3+Na 2SO 3+H 2SO 4=====△2ClO 2↑+2Na 2SO 4+H 2O 。
①可以用SO 2代替Na 2SO 3;②要避光,否则会使ClO 2分解;②控制水浴温度和加入H 2SO 4的速度,使ClO 2均匀生成。
(2)工业制法①氯酸钠与浓盐酸反应法:2NaClO 3+4HCl(浓)===2NaCl +Cl 2↑+2ClO 2↑+2H 2O②亚氯酸钠与Cl 2反应法:2NaClO 2+Cl 2===2NaCl +2ClO 2③草酸还原法:H 2C 2O 4+2NaClO 3+H 2SO 4===Na 2SO 4+2CO 2↑+2ClO 2↑+2H 2O④亚氯酸钠与盐酸反应法:5NaClO 2+4HCl===5NaCl +4ClO 2↑+2H 2O2.ClO 2的性质常温下为黄绿色或黄红色气体,其液体为红褐色,固体为浅红色,熔点-59 ℃,沸点11 ℃。
主要用于自来水的消毒、木质纸浆的漂白。
二氧化氯具有杀菌能力强、对人体及动物没有危害以及对环境不造成二次污染等特点。
(1)ClO 2不是HClO 2的酸酐,它在碱中发生歧化:2ClO 2+2OH===ClO -2+ClO -3+H 2O(2)ClO 2极不稳定,温度稍高、浓度稍大则发生爆炸分解成单质,2ClO 2===Cl 2+2O 2,若用空气、二氧化碳、氮气等稀释时,爆炸性会降低。
(3)光照条件下在中性水溶液中,ClO 2会发生歧化分解,形成盐酸和氯酸的混合物6ClO 2+3H 2O=====光HCl+5HClO 3(4)氧化作用:ClO 2属强氧化剂,其氧化能力是Cl 2的2.6倍。
①ClO 2能把Mn 2+氧化成MnO 2:2ClO 2+5Mn 2++6H 2O===5MnO 2+12H ++2Cl -②ClO 2能把Fe 2+氧化成Fe 3+:ClO 2+5Fe 2++4H +===5Fe 3++Cl -+2H 2O③ClO 2在pH 为5~9的区间内,很快将硫化物(S 2-)氧化成SO 2-4,即8ClO 2+5S 2-+4H 2O===5SO 2-4+8Cl -+8H +④ClO 2能把废水中的CN -氧化成无毒气体:2ClO 2+2CN -===2CO 2+N 2+2Cl -二、氯的含氧酸-HClO(次氯酸)、HClO 2(亚氯酸)、HClO 3(氯酸)、HClO 4(高氯酸)。


一、拓展点——氯的氧化物及含氧酸1.ClO 2的制备(1)实验室制法把氯酸钠、亚硫酸钠和稀H 2SO 4混合水浴加热可制得黄棕色的ClO 2气体,化学方程式为2NaClO 3+Na 2SO 3+H 2SO 4=====△2ClO 2↑+2Na 2SO 4+H 2O 。
[说明] ①可以用SO 2代替Na 2SO 3;②要避光,否则会使ClO 2分解;②控制水浴温度和加入H 2SO 4的速度,使ClO 2均匀生成。
(2)工业制法①氯酸钠与浓盐酸反应法:2NaClO 3+4HCl(浓)===2NaCl +Cl 2↑+2ClO 2↑+2H 2O②亚氯酸钠与Cl 2反应法:2NaClO 2+Cl 2===2NaCl +2ClO 2③草酸还原法:H 2C 2O 4+2NaClO 3+H 2SO 4===Na 2SO 4+2CO 2↑+2ClO 2↑+2H 2O④亚氯酸钠与盐酸反应法:5NaClO 2+4HCl===5NaCl +4ClO 2↑+2H 2O2.ClO 2的性质常温下为黄绿色或黄红色气体,其液体为红褐色,固体为浅红色,熔点-59 ℃,沸点11 ℃。
(1)ClO 2见光或遇热水分解。
(2)氧化作用:ClO 2属强氧化剂,其氧化能力是Cl 2的2.6倍。
①ClO 2能把Mn 2+氧化成MnO 22ClO 2+5Mn 2++6H 2O===5MnO 2+12H ++2Cl -②ClO 2能把Fe 2+氧化成Fe 3+ClO 2+5Fe 2++4H +===5Fe 3++Cl -+2H 2O③ClO 2在pH 为5~9的区间内,很快将硫化物(S 2-)氧化成SO 2-4,即8ClO 2+5S 2-+4H 2O===5SO 2-4+8Cl -+8H + ④ClO 2能把废水中的CN -氧化成无毒气体2ClO 2+2CN -===2CO 2+N 2+2Cl -[示例1] ClO 2是一种高效安全的杀菌消毒剂。
![[整理]02:氯的氧化物和含氧酸及盐.](https://img.taocdn.com/s1/m/3a175b9603d276a20029bd64783e0912a2167c6a.png)
-------------------------- 元素化学02:氯的氧化物和含氧酸及盐 (时间:2.5 小时 满分:100 分)第一题(27 分)ClO 2 是氯的最重要氧化物 世界环保联盟将全面禁止在自来水中加氯,取而代之的是安全高效的杀菌消毒剂ClO 2。
ClO 2 是一种黄绿色,有刺激性气味的气体,熔点:-59℃,沸点:11.0℃。
℃。
1.干燥的ClO 2 分解中可生成Cl 2O ,后者可进一步分解为单质。
经测定:ClO 2 分子中Cl -O 键长为147pm ,Cl 2O 分子中的Cl -O 键长为170pm (与正常的单键是一致);键能D(Cl -O)=209kJ/mol 、D(Cl -Cl)=243kJ/mol 、D(O 2)=499kJ/mol 。
(1)从结构上解释Cl -O 长短不同的原因。
长短不同的原因。
(2)比较Cl 2O 与ClO 2 的键角大小,并解释。
的键角大小,并解释。
(3)说明为什么Cl 2O 分子能够自动地分解为单质。
分子能够自动地分解为单质。
2.ClO 2 是含单电子的物质分子,应具有二聚倾向。
但经测定它在气态、液态和固态均无二聚的作用。
何故? 3.ClO 2 为高效低毒的消毒剂,其消毒的效率是等物质的量的Cl 2 的多少倍。
的多少倍。
4.化学史上,从ClO 2 的制备到确定其化学式,经历了近百年。
的制备到确定其化学式,经历了近百年。
(1)1797 年Hoyle 在用浓H 2SO 4 和氯酸钾反应时得到一种具有爆炸性的黄色气体(ClO 2)。
写出反应方程式。
)。
写出反应方程式。
(2)1851 年Davy 使2 体积上述黄色气体完全分解,产物为3 体积气体,其中氧和氯体积比为2∶1。
为什么Davy 未能由此导出黄色气体的分子式为ClO 2 呢?呢?(3)1882 年,Pebal 测得黄色气体的密度后,测得黄色气体的密度后,确定其组成为确定其组成为ClO 2。

氯,CHLORINE,源自chloros,意为“绿黄”,1774年发现。
它能和其他元素化合的数目,差不多和氟一样多,只是略逊一筹而已。
它有足够的强烈作用力,能用来制造漂白剂,本身是一种消毒剂和有毒的气体。
纯氯通常是由电解食盐(NaCl)所收集来的。
氯的发现简史卡尔·威廉·舍勒(K.W.Scheele,1742-1786)在1774年,瑞典化学家舍勒(Scheele K W,1742-1786)在从事软锰矿的研究时发现:软锰矿与盐酸混合后加热就会生成一种令人窒息的黄绿色气体,这种气体微溶于水,使水显酸性。
能漂白有色花朵和绿叶,还能和各种金属发生反应。
当时,大化学家拉瓦锡认为氧是酸性的起源,一切酸中都含有氧。
舍勒及许多化学家都坚信拉瓦锡的观点,认为这种黄绿色的气体是一种化合物,是由氧和另外一种未知的基所组成的,所以舍勒称它为“氧化盐酸”。
但英国化学家戴维(Davy S H,1778-1829)却持有不同的观点,他想尽了一切办法也不能从氧化盐酸中把氧夺取出来,他怀疑氧化盐酸中根本就没有氧存在。
1810年,戴维以无可辩驳的事实证明了所谓的氧化盐酸不是一种化合物,而是一种化学元素的单质。
他将这种元素命名为“Chlorine”。
它的希腊文原意是“绿色”。
中文译名为氯。
汉弗莱·戴维(Humphry·Davy,1778—1829)氯单质及其性质氯气Cl2是一种黄绿色的气体,标准状况下,1LCl2重3.21g大约是同体积空气质量的倍。
Cl2极易液化,如果使之冷却至239K或常温时在0.6MPa下,氯气就会变成黄绿色油状液体。
液氯在172K还可以凝固成黄色固体。
氯气具有强烈的窒息气味,有毒!吸入少量时会刺激鼻腔和喉头黏膜,引起胸部疼痛和咳嗽,吸入大量就会窒息死亡。
发生氯气中毒时可吸入酒精和乙醚的混合蒸气作为解毒剂。
吸入氨水蒸气也有效。
氯气可用于纸浆和棉布的漂白,也可用于饮水的消毒。