基因敲除小鼠的构建_图文
- 格式:pptx
- 大小:7.56 MB
- 文档页数:15

基因敲除小鼠(Knockoutmice)制备技术方法基因敲除小鼠,人们使用复杂的方法使小鼠体内的某一个基因不表达,从而使小鼠呈现这个基因缺失的状态,可用于研究这个基因的功能。
但如果某个基因功能特别重要,这个基因缺失可能具有胚胎致死性,那我们就无法得到这种基因敲除的小鼠了,于是人们发明了条件性基因敲除技术。
这一技术可以实现在特定的时间、特定的细胞或组织内使某个基因沉默。
方法是首先在目的基因(就是打算敲除的那个基因)的两侧分别插入一段名为LoxP的DNA序列(LoxP序列是一段34bp的DNA序列,两端的13个碱基为回文序列,中间的8个碱基决定LoxP的方向。
然后我们需要用到一种带有Cre酶的转基因小鼠了。
Cre重组酶于1981年从P1噬菌体中发现,属于λ Int酶超基因家族。
Cre重组酶基因编码区序列全长1029bp(EMBL数据库登录号X03453),编码38kDa蛋白质。
是一种位点特异性重组酶,能介导两个LoxP位点(序列)之间的特异性重组,使LoxP位点间的基因序列被删除或重组。
LoxP(locus of X-over P1)序列来源于P1噬菌体,是有两个13bp反向重复序列和中间间隔的8bp序列共同组成,8bp的间隔序列同时也确定了LoxP的方向。
Cre 在催化DNA链交换过程中与DNA共价结合,13bp的反向重复序列是Cre酶的结合域。
其序列如下:5' - ATAACTTCGTATA - ATGTATGC - TATACGAAGTTAT - 3'3' - TATTGAAGCATAT - TACATACG - ATATGCTTCAATA - 5'Cre-LoxP系统的特性Cre重组酶介导两个LoxP位点间的重组是一个动态、可逆的过程,可以分成三种情况:1、如果两个LoxP位点位于一条DNA链上,且方向相同,Cre重组酶能有效切除两个LoxP位点间的序列;2、如果两个LoxP位点位于一条DNA链上,但方向相反,Cre重组酶能导致两个LoxP位点间的序列倒位;3、如果两个LoxP位点分别位于两条不同的DNA链或染色体上,Cre酶能介导两条DNA链的交换或染色体易位。
![建立基因敲除小鼠颈动脉粥样硬化模型[新版]](https://uimg.taocdn.com/7e07c982866fb84ae55c8d02.webp)



一、常规基因敲除鼠( Conventional Knockout )常规基因敲除是通过基因打靶,把需要敲除的基因的几个重要的外显子或者功能区域用 Neo Cassette 替换掉。
这样的小鼠其全身所有的组织和细胞中都不表达该基因产物。
此类基因敲除鼠一般用于研究某个基因在对小鼠全身生理病理的影响,而且这个基因没有胚胎致死性。
二、条件性基因敲除小鼠( Conditional Knockout )条件性基因敲除小鼠是通过基因打靶,把两个 loxP 位点放到目的基因一个或几个重要的外显子的两边。
该小鼠和表达 Cre 酶小鼠杂交之前,其目的基因表达完全正常。
当和组织特异性表达 Cre 酶的小鼠进行杂交后,可以在特定的组织或细胞中敲除该基因,而该基因在其他组织或细胞表达正常。
条件性基因敲除鼠适用范围为:( 1 )该基因有胚胎致死性;( 2 )用于研究该基因在特定的组织或细胞中的生理病理功能。
三、基因敲入小鼠( Knockin )基因敲入小鼠是通过基因打靶,把目的基因序列敲入到小鼠的相应基因位点,使用小鼠的表达调控元件指导目的基因表达。
此类基因敲入鼠一般用于药物的筛选,信号通路的研究等。
一、 ZFN 技术制作基因敲除鼠ZFN 能够识别并结合指定的基因序列位点,并高效精确地切断。
随后细胞利用天然的DNA 修复过程来实现 DNA 的插入、删除和修改,这样研究人员就能够随心所欲地进行基因组编辑。
这在过去是无法想象的,传统的基因敲除技术依赖细胞内自然发生的同源重组,其效率只有百万分之一,而 ZFN 的基因敲除效率能达到 10% 。
利用这些技术进行小鼠基因的定点敲除和敲入,可以把时间从一年缩短到几个月。
这项技术中设计特异性的 ZFN 是最关键的环节,目前研究者采用计算生物学方法设计高特异性的 ZFN,但 ZFN的脱靶( off target ),也就是把不该切的地方切了的问题仍是一个挑战。
也正因为这个原因,利用 ZFN 技术进行小鼠的基因修饰还无法完全取代传统技术。

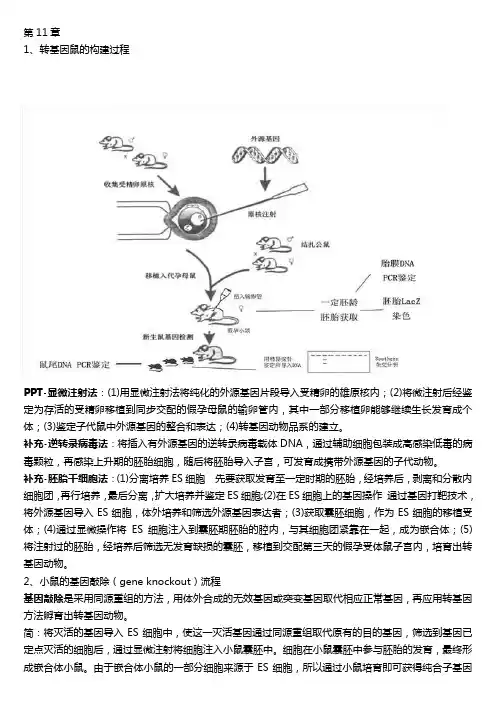
第11章1、转基因鼠的构建过程PPT-显微注射法:(1)用显微注射法将纯化的外源基因片段导入受精卵的雄原核内;(2)将微注射后经鉴定为存活的受精卵移植到同步交配的假孕母鼠的输卵管内,其中一部分移植卵能够继续生长发育成个体;(3)鉴定子代鼠中外源基因的整合和表达;(4)转基因动物品系的建立。
补充-逆转录病毒法:将插入有外源基因的逆转录病毒载体DNA,通过辅助细胞包装成高感染低毒的病毒颗粒,再感染上升期的胚胎细胞,随后将胚胎导入子宫,可发育成携带外源基因的子代动物。
补充-胚胎干细胞法:(1)分离培养ES细胞先要获取发育至一定时期的胚胎,经培养后,剥离和分散内细胞团,再行培养,最后分离,扩大培养并鉴定ES细胞;(2)在ES细胞上的基因操作通过基因打靶技术,将外源基因导入ES细胞,体外培养和筛选外源基因表达者;(3)获取囊胚细胞,作为ES细胞的移植受体;(4)通过显微操作将ES细胞注入到囊胚期胚胎的腔内,与其细胞团紧靠在一起,成为嵌合体;(5)将注射过的胚胎,经培养后筛选无发育缺损的囊胚,移植到交配第三天的假孕受体鼠子宫内,培育出转基因动物。
2、小鼠的基因敲除(gene knockout)流程基因敲除是采用同源重组的方法,用体外合成的无效基因或突变基因取代相应正常基因,再应用转基因方法孵育出转基因动物。
简:将灭活的基因导入ES细胞中,使这一灭活基因通过同源重组取代原有的目的基因,筛选到基因已定点灭活的细胞后,通过显微注射将细胞注入小鼠囊胚中。
细胞在小鼠囊胚中参与胚胎的发育,最终形成嵌合体小鼠。
由于嵌合体小鼠的一部分细胞来源于ES细胞,所以通过小鼠培育即可获得纯合子基因敲除小鼠。
繁:a.获取ES细胞b.基因载体的构建:把目的基因和与细胞内靶基因特异片段同源的DNA分子都重组到带有标记基因的载体上,此重组载体即为打靶载体。
c.将基因打靶载体通过一定的方式(常用电穿孔法)导入同源的胚胎干细胞(EScell)中,使外源DNA与胚胎干细胞基因组中相应部分发生同源重组,将打靶载体中的DNA序列整合到内源基因组中从而得以表达。