第六章稳定性同位素示踪法
- 格式:ppt
- 大小:321.50 KB
- 文档页数:43


稳定同位素标记引言稳定同位素标记被广泛应用于不同领域的科学研究中,包括地质学、环境科学、生物学等。
在这些研究中,稳定同位素的标记可以提供关于物质来源、代谢途径和地质过程的重要信息。
本文将探讨稳定同位素标记的原理、应用以及其在不同领域的作用。
稳定同位素标记的原理稳定同位素是指具有相同原子序数但不同质量数的同一种元素,其核外电子结构相同,但核内的中子数不同。
不同同位素之间的质谱值差异可以通过质谱仪进行精确测定,并用于稳定同位素标记。
稳定同位素标记的原理基于同位素的相对丰度稳定性。
相对于放射性同位素,稳定同位素具有长半衰期,不会放射出射线,并且相对丰度在地球上和生物体内具有稳定性。
因此,稳定同位素可以被用作标记物质的示踪剂,并提供关于物质来源、生物过程和地质过程的信息。
稳定同位素标记的应用稳定同位素标记在各个科学领域有着广泛的应用。
以下是几个主要领域的应用示例:1. 地质学稳定同位素标记被广泛用于研究地球历史和地质过程。
例如,通过测量岩石中不同同位素的丰度,可以确定岩石的形成时间和条件,揭示地壳演化的历史。
稳定同位素标记还用于研究地下水和地表水的起源和流动方式,以及地球气候的变化过程。
2. 环境科学稳定同位素标记在环境科学研究中也起着重要作用。
通过测量水体、土壤和大气中稳定同位素的丰度,可以追踪污染物的行为和传输途径。
稳定同位素标记还可以用于研究生态系统中物质循环和生物过程,如食物链和能量流动。
3. 生物学稳定同位素标记在生物学研究中有着广泛应用。
通过将稳定同位素标记物质引入生物体内,可以跟踪物质在生物体内的运动和转化过程。
例如,通过注入稳定同位素标记的氮气到植物叶片中,可以研究植物光合作用的速率和效率。
稳定同位素标记还可以应用于动物行为研究、食物链分析以及追踪动植物迁徙。
稳定同位素标记的示踪方法稳定同位素标记的示踪方法根据研究对象和目的的不同而有所差异。
以下是几种常见的示踪方法:1. 同位素比值法同位素比值法是最常用的稳定同位素标记方法之一。




化学反应中的同位素示踪实验同位素示踪实验是一种在化学反应中使用同位素标记物质的方法,通过追踪同位素的行为,可以了解反应发生的过程和机制。
同位素示踪实验在化学领域中具有重要的地位,广泛地应用于反应动力学、反应机理、生物化学等领域。
本文将展示同位素示踪实验的原理、应用以及相关技术。
一、同位素示踪实验的原理同位素示踪实验的原理是利用同位素在化学反应中的行为与稳定同位素的特性,通过追踪同位素的排布来了解反应的过程。
同位素是具有相同原子序数但不同中子数的同种元素,因此具有相似的化学性质。
在同位素示踪实验中,通常使用的同位素有氢的氘同位素(2H)、碳的碳-14同位素(14C)、氮的氮-15同位素(15N)等。
二、同位素示踪实验的应用1. 反应动力学研究同位素示踪实验在反应动力学研究中起到关键的作用。
通过追踪同位素标记物质的浓度随时间的变化,可以确定反应速率常数、反应级数和活化能等重要参数,从而揭示反应的动力学过程。
2. 反应机理研究同位素示踪实验可用于研究化学反应的机理。
通过引入标记同位素,在不同反应步骤中追踪同位素的转移和分布情况,可以揭示反应中是否存在中间体、裂解反应、交换反应等一系列的反应步骤,进而了解反应的机理。
3. 生物化学研究同位素示踪实验在生物化学研究中具有广泛的应用。
通过给生物体内引入同位素标记物质,可以追踪其在代谢途径中的转化过程,如糖的代谢、蛋白质合成等,从而揭示生物体内的代谢途径、信号转导机制等。
三、同位素示踪实验的技术与方法同位素示踪实验涉及到较多的技术与方法,包括同位素标记化合物的制备、同位素测定方法、标记物质的纯化与追踪等。
通常使用的同位素测定方法有质谱法、辐射测量法等。
1. 同位素标记化合物的制备同位素标记化合物的制备需要选择合适的同位素标记剂和反应条件。
例如,在有机化学反应中,可以使用氘代试剂、碳-14标记试剂等来引入同位素。
制备过程需要注意同位素标记化合物的选择、合成方法的优化以及纯化方法的选择。
![[讲解]同位素示踪法](https://uimg.taocdn.com/8456fb66dd88d0d232d46aaa.webp)
[讲解]同位素示踪法同位素示踪法同位素示踪法在高中生物学实验中的应用同位素示踪法是利用放射性核素作为示踪剂对研究对象进行标记的微量分析方法,即把放射性同位素的原子参到其他物质中去,让它们一起运动、迁移,再用放射性探测仪器进行追踪,就可知道放射性原子通过什么路径,运动到哪里了,是怎样分布的。
同位素示踪法是生物学实验中经常应用的一项重要方法,它可以研究细胞内的元素或化合物的来源、组成、分布和去向等,进而了解细胞的结构和功能、化学物质的变化、反应机理等。
用于示踪技术的放射性同位素一般是用于构成细胞化合物的重要元素,如3H、14C、15N、18O、32P、35S、131I等。
在高中生物学教材中有多处涉及到放射性同位素的应用,下面笔者对教材中的相关知识进行归纳如下:1 研究蛋白质或核酸合成的原料及过程把具有反射性的原子参到合成蛋白质或核酸的原料(氨基酸或核苷酸)中,让它们一起运动、迁移,再用放射性探测仪器进行追踪,就可知道放射性原子通过什么路径、运动到哪里以及分布如何。
2 研究分泌蛋白的合成和运输用3H标记亮氨酸,探究分泌性蛋白质在细胞中的合成、运输与分泌途径。
在一次性给予放射性标记的氨基酸的前提下,通过观察细胞中放射性物质在不同时间出现的位置,就可以明确地看出细胞器在分泌蛋白合成和运输中的作用。
例如,通过实验说明分泌蛋白在附着于内质网上的核糖体中合成之后,是按照内质网?高尔基体?细胞膜的方向运输的,从而证明了细胞内的各种生物膜在功能上是紧密联系的。
3 研究细胞的结构和功能用同位素标记氨基酸或核苷酸并引入细胞内,探测这些放射性标记出现在哪些结构中,从而推断该细胞的结构和功能。
4 探究光合作用中元素的转移利用放射性同位素18O、14C、3H作为示踪原子来研究光合作用过程中某些物质的变化过程,从而揭示光合作用的机理。
例如,美国的科学家鲁宾和卡门研究光合作用中释放的氧到底是来自于水,还是来自于二氧化碳。
他们用氧的同位素18O 分别标记H2O和CO2,使它们分别成为H218O和C18O2,然后进行两组光合作用实验:第一组向绿色植物提供H218O和CO2,第二组向同种绿色植物提供H2O和C18O2。



第六章同位素地球化学——稳定同位素第一节基本概念一、同位素的定义核素:是由一定数量的质子(P)和中子(N)构成的原子核。
核素具有质量、电荷、能量、放射性和丰度5中主要性质。
元素:具有相同质子数和中子数的核素.同位素:原子核内质子数相同而中子数不同的一类原子叫做同位素(isotope),他们处在周期表上的同一位置二、同位素的分类– 放射性同位素(radioactive isotope):原子核是不稳定的,它们能够白发地衰变成其他的同位素。
最终衰变为稳定的放射性成因同位素。
目前已知的放射性同位素达1200种左右,由于大部分放射性同位素的半衰期较短,目前已知自然界中存在的天然放射性同位素只有60种左右。
放射性同位素例子:238U→234Th+4He(α)+Q→206Pb;235U→207Pb;232Th→208Pb– 稳定同位素(stable isotope):原子核是稳定的,迄今还未发现它们能够自发衰变形成其他的同位素。
自然界中共有1700余种同位素,其中稳定同位素有260余种。
z轻稳定同位素,又称天然的稳定同位素,是核合成以来就保持稳定。
其特点是①原子量小,同—元素的各同位素间的相对质量差异较大;②轻稳定同位素变化主要原因是同位素分馏作用所造成的,其反应是可逆的。
如氢同位素(1H和2H)、氧同位素(16O和18O)、碳同位素(12C和13C)等。
z重稳定同位素,又称放射成因同位素(radiogenic isotope):稳定同位素中部分是由放射性同位素通过衰变后形成的稳定产物。
其特点是①原子量大,同—元素的各同位素间的相对质量差异小(0.7%~1.2%)环境的物理和化学条件的变化通常不导致重稳定同位素组成改变;②重稳定同位素变化主要原因是放射性同位素衰败引起,这种变化是单向的不可逆的。
如87Sr是由放射性同位素87Rb衰变而来的;三、同位素的丰度和原子量1.同位素丰度(isotope abundance) :可分为绝对丰度和相对丰度绝对丰度是指某一同位素在所有各种稳定同位素总量中的相对份额,常以该同位素与1H(取1H=1012)或28Si(取28Si=106)的比值表示。
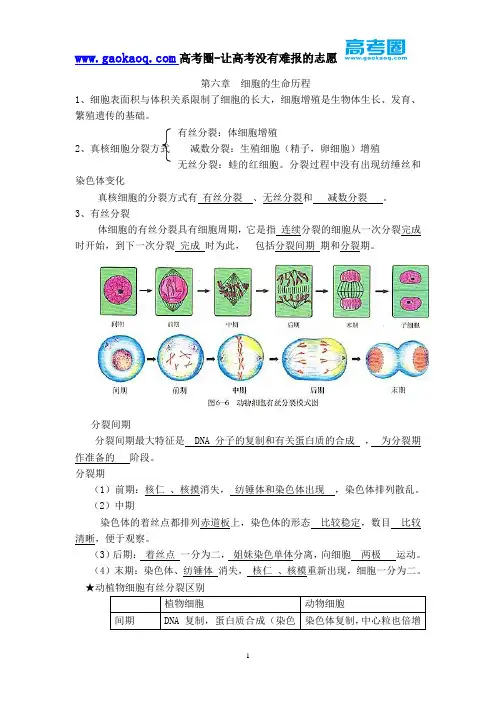
蛋白质生理需求量的稳定性同位素标记氨基酸示踪测定法齐孟文中国农业大学1.背景蛋白质的生理需求是指维持机体正常代谢所需蛋白营养量的临界值,是制定合理饮食和蛋白质营养摄入推荐的基础数据,因此对其准确的测定在营养学上具有重要意义。
传统的氮素平衡方法,由于难以准确测定各种途径的氮损失,所得到结果不够精确,而标记氨基酸代谢与蛋白质关系提供了一种量精确测定蛋白质理需求量的示踪方法。
2.原理2.1示踪研究模型 氨基酸蛋白质IC S E图.氨基酸代谢两库模型注:I 是食物摄入率;C 是蛋白质分解率;E 是排泄率,通过转变为代谢产物( E) 而排泄, 如脱氨、氧化, 最后生成尿素、氨等物质;S 是合成而结合到蛋白质的结合率。
当机体内的代谢处于平衡状态时,单位时间内进入氨基酸库的量与离开的量相等: Q = I+C = S + E, 如果单位时间内进出游离氨基酸代谢库的量以(Q ) 表示, 同时再测定E 和I 的值, 便可以计算出蛋白质的合成速率( S ) 和分解速率(C ) 。
该模型成立的基本假设为: 1 ) 在实验期间代谢库大小是恒定的;2 ) 实验期间示踪原子的再利用可忽略不计;3) 游离氨基酸代谢库的其它消除途径, 除C 和E 外可忽略或校正。
测定蛋白质的需求量是的基本假设是,当机体的蛋白质量未达到基本生理代谢需求时,氨基酸主要用来合成机体的蛋白质, 一旦蛋白质达到并且超过了生理需要量, 那么摄入的氨基酸将会被机体所氧化, 从而导致该氨基酸的氧化率迅速升高, 在氨基酸氧化率对应氨基酸摄入量水平的量效曲线的拐点处所对应的饮食蛋白质量即为基酸的生理需要量。
根据检测过程不同,具体分为两种方法。
2.2氨基酸直接氧化法通过给予受试者不同水平的氨基酸剂量来检测氨基酸的氧化率的变化, 进而确定机体与所需氨基酸适宜量相应蛋白质量的一方法。
稳定同位素示踪需要对标记氨基酸的最终分解产物进行测量, 标记的碳原子可能现在各种不同的代谢产物中, 这使得解释起来很困难, 而且标记的羧基碳可能最终不通过呼吸排出,而是参与其它合成反应。