液体样本蛋白提取方法
- 格式:pdf
- 大小:130.46 KB
- 文档页数:2

植物蛋白质提取方法汇总(本人经验总结)一、植物组织蛋白质提取方法1、根据样品重量(1g样品加入3.5ml提取液,可根据材料不同适当加入),准备提取液放在冰上。
2、把样品放在研钵中用液氮研磨,研磨后加入提取液中在冰上静置(3-4小时)。
3、用离心机离心8000rpm40min4℃或11100rpm20min4℃4、提取上清液,样品制备完成。
蛋白质提取液:300ml1、1Mtris-HCl(PH8)45ml2、甘油(Glycerol)75ml3、聚乙烯吡咯烷酮(Polyvinylpolypyrrordone)6g这种方法针对SDS-PAGE,垂直板电泳!二、植物组织蛋白质提取方法氯醋酸—丙酮沉淀法1、在液氮中研磨叶片2、加入样品体积3倍的提取液在-20℃的条件下过夜,然后离心(4℃8000rpm 以上1小时)弃上清。
3、加入等体积的冰浴丙酮(含0.07%的β-巯基乙醇),摇匀后离心(4℃8000rpm 以上1小时),然后真空干燥沉淀,备用。
4、上样前加入裂解液,室温放置30分钟,使蛋白充分溶于裂解液中,然后离心(15℃8000rpm以上1小时或更长时间以没有沉淀为标准),可临时保存在4℃待用。
5、用Brandford法定量蛋白,然后可分装放入-80℃备用。
药品:提取液:含10%TCA和0.07%的β-巯基乙醇的丙酮。
裂解液:2.7g尿素0.2gCHAPS溶于3ml灭菌的去离子水中(终体积为5ml),使用前再加入1M 的DTT65ul/ml。
这种方法针对双向电泳,杂质少,离子浓度小的特点!当然单向电泳也同样适用,只是电泳的条带会减少!三、组织:肠黏膜目的:WESTERN BLOT检测凋亡相关蛋白的表达应用TRIPURE提取蛋白质步骤:含蛋白质上清液中加入异丙醇:(1.5ml每1mlTRIPURE用量)倒转混匀,置室温10min离心:12000 g,10min,4度,弃上清加入0.3M盐酸胍/95%乙醇:(2ml每1mlTRIPURE用量)振荡,置室温20min离心:7500g,5 min,4度,弃上清重复0.3M盐酸胍/95%乙醇步2次沉淀中加入100%乙醇2ml充分振荡混匀,置室温20 min离心:7500g,5min,4度,弃上清吹干沉淀1%SDS溶解沉淀离心:10000g,10min,4度取上清-20度保存(或可直接用于WESTERN BLOT)存在的问题:加入1%SDS后沉淀不溶解,还是很大的一块,4度离心后又多了白色沉定,SDS结晶?测浓度,含量才1mg/ml左右。

蛋白提取方法1 材料和方法1.1 材料1.1.1 组织和细胞的来源:1.1.2 仪器设备机械组织匀浆器低温高速离心机(>40,000 g)超速离心机超生细胞破碎仪超纯水装置1.1.3 试剂三氯醋酸(TCA)丙酮二硫苏糖醇(DTT)尿素CHAPSPMSFEDTA乙醇磷酸考马斯亮蓝R350抑肽素A亮肽素试剂纯度均应是分析纯或以上。
1.1.4 溶液配制(1) PBS:NaCl 8 g, KCl 0.2 g, Na2HPO4 1.44 g, KH2PO4,溶于800 ml 水中,用HCl调pH至7.4,用纯水定容至1 L;(2) EDTA 储存液:18.61 g Na2EDTA?2H2O,溶于70 ml纯水中,用10 mol/L NaOH调节pH值至8.0 (约需2 g NaOH颗粒),定容为100 ml。
可高压灭菌后分装备用;(3) 亮肽素储存液(50 μg/ml,100×)10 mg/ml溶于水,-75℃保存;使用时配成50 μg/ml储液,-20℃保存;(4) 抑肽素储存液(70 μg/ml,100×)1 mg/ml溶于甲醇,-75℃保存;使用时配成70 μg/ml储液,-20℃保存;(5) PMSF储存液(10 mM, 100×):17.4 mg PMSF,溶于1ml异丙醇中,-20℃保存。
DTT 储存液(1 M):0.31 g DTT溶于2 ml H2O中,-20℃保存(DTT或含有DTT的溶液不能进行高压处理,可过滤除菌)。
(7) 裂解液:Lysis buffer A(9 M urea, 4% w/v CHAPS, 1% w/v DTT, 0.5% CA and a cocktail of protease inhibitors)Lysis buffer B(7 M urea, 2 M thiourea, 4% w/v CHAPS, 1% w/v DTT, 0.5% CA and a cocktail of protease inhibitors)Lysis buffer C40 mM Tris-base (pH 9.5) in ultrapure H2OLysis buffer D(8 M urea, 4% CHAPS, 40 mM Tris(base), 40 ml)Lysis buffer E(5 M urea, 2 M thiourea, 2% SB 3-10, 2% CHAPS, 1% w/v DTT, 0.5% CA and a cocktail of protease inhibitors)Lysis buffer F100 μL SDS sample solution (1% w/v SDS, 0.375 M Tris-HCl, pH 8.8, 50 mM DTT, 25% v/v glycerol)●CA、蛋白酶抑制剂混合物和DTT在临用前加入。


蛋白提取方法一、对于培养细胞样品:1.融解 Western 及 IP 细胞裂解液,混匀。
取适当量的裂解液,在使用前数分钟内加入 PMSF,使 PMSF的最终浓度为 1mM。
2.对于贴壁细胞:去除培养液,用 PBS、生理盐水或无血清培养液洗一遍 ( 如果血清中的蛋白没有干扰,可以不洗 ) 。
按照 6 孔板每孔加入100-200 微升(6cm培养皿 200-300ul )裂解液的比例加入裂解液。
用枪吹打数下,使裂解液和细胞充分接触。
通常裂解液接触细胞1-2秒后,细胞就会被裂解。
对于悬浮细胞:离心收集细胞,用手指把细胞用力弹散。
按照6 孔板每孔细胞加入 100-200 微升裂解液的比例加入裂解液。
再用手指轻弹以充分裂解细胞。
充分裂解后应没有明显的细胞沉淀。
如果细胞量较多,必需分装成50-100 万细胞/ 管,然后再裂解。
大团的细胞较难裂解充分,而少量的细胞由于裂解液容易和细胞充分接触,相对比较容易裂解充分。
3.在冰上充分裂解20-30min 后, 10000-14000g 离心 3-5 分钟,取上清,即可进行后续的PAGE、Western、免疫沉淀和免疫共沉淀等操作。
裂解液用量说明:通常 6 孔板每孔细胞加入100微升裂解液已经足够,但如果细胞密度非常高可以适当加大裂解液的用量到150 微升或 200微升。
二、对于组织样品:1.把组织剪切成细小的碎片。
2.融解 Western 及 IP 细胞裂解液,混匀。
取适当量的裂解液,在使用前数分钟内加入 PMSF,使 PMSF的最终浓度为 1mM。
3.按照每 20 毫克组织加入 100-200 微升裂解液的比例加入裂解液。
( 如果裂解不充分可以适当添加更多的裂解液,如果需要高浓度的蛋白样品,可以适当减少裂解液的用量。
)4.用玻璃匀浆器匀浆,直至充分裂解。
5.充分裂解后, 10000-14000g 离心 3-5 分钟,取上清,即可进行后续的 PAGE、Western、免疫沉淀和免疫共沉淀等操作。
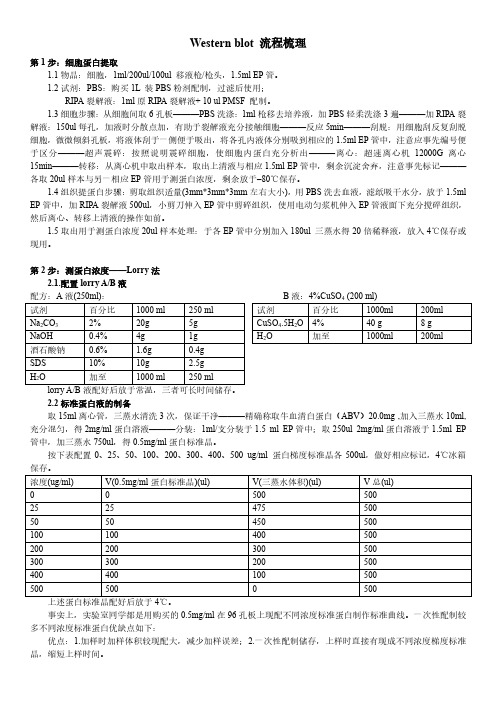
Western blot 流程梳理第1步:细胞蛋白提取1.1物品:细胞,1ml/200ul/100ul 移液枪/枪头,1.5ml EP管。
1.2试剂:PBS:购买1L 装PBS粉剂配制,过滤后使用;RIPA裂解液:1ml原RIPA裂解液+ 10 ul PMSF 配制。
1.3细胞步骤:从细胞间取6孔板———PBS洗涤:1ml枪移去培养液,加PBS轻柔洗涤3遍———加RIPA裂解液:150ul每孔,加液时分散点加,有助于裂解液充分接触细胞———反应5min———刮脱:用细胞刮反复刮脱细胞,微微倾斜孔板,将液体刮于一侧便于吸出,将各孔内液体分别吸到相应的1.5ml EP管中,注意应事先编号便于区分———超声震碎:按照说明震碎细胞,使细胞内蛋白充分析出———离心:超速离心机12000G 离心15min———转移:从离心机中取出样本,取出上清液与相应1.5ml EP管中,剩余沉淀舍弃,注意事先标记———各取20ul样本与另一相应EP管用于测蛋白浓度,剩余放于–80℃保存。
1.4组织提蛋白步骤:剪取组织适量(3mm*3mm*3mm左右大小),用PBS洗去血液,滤纸吸干水分,放于1.5ml EP管中,加RIPA裂解液500ul,小剪刀伸入EP管中剪碎组织,使用电动匀浆机伸入EP管液面下充分搅碎组织,然后离心、转移上清液的操作如前。
1.5取出用于测蛋白浓度20ul样本处理:于各EP管中分别加入180ul 三蒸水得20倍稀释液,放入4℃保存或现用。
第2步:测蛋白浓度——Lorry法2.1.配置lorry A/B液配方:A液(250ml):2.2标准蛋白液的制备取15ml离心管,三蒸水清洗3次,保证干净———精确称取牛血清白蛋白(ABV)20.0mg ,加入三蒸水10ml,充分混匀,得2mg/ml蛋白溶液———分装:1ml/支分装于1.5 ml EP管中;取250ul 2mg/ml蛋白溶液于1.5ml EP 管中,加三蒸水750ul,得0.5mg/ml蛋白标准品。

科技液体分层原理的应用1. 引言科技液体分层原理是指基于液体分层效应的一种技术应用。
液体分层是指不同密度的液体在受力作用下相互分层的现象。
这一原理在科技领域有广泛的应用,本文将介绍科技液体分层原理的应用领域和实例。
2. 应用领域2.1 医疗领域科技液体分层原理在医疗领域有着重要的应用。
以下是一些例子:- 离心技术:离心技术利用液体分层原理,对血液样本进行离心,分离出不同成分,如红细胞、血浆等,从而实现疾病的诊断和治疗。
- 肿瘤标志物检测:科技液体分层原理可以用于检测肿瘤标志物,通过离心等技术,将液体样本中的肿瘤细胞分离出来,进行进一步的分析和诊断。
- 药物传递系统:科技液体分层原理可以用于制备药物输送系统,通过控制药物在液体中的分层位置,实现药物的定向输送和释放。
2.2 食品工业科技液体分层原理在食品工业中也有着广泛的应用。
以下是一些例子: - 酒类加工:在酿酒过程中,科技液体分层原理可以用来分离出酒液中的杂质和沉淀物,从而提高酒品质量。
- 油脂加工:在食用油的制备中,科技液体分层原理可以用来分离出不同种类的油脂,从而实现不同油品的生产和提纯。
- 蛋白质分离:科技液体分层原理可以用来分离出食品中的蛋白质,从而提取出纯净的蛋白质,用作食品添加剂或其他用途。
2.3 环境保护科技液体分层原理在环境保护领域也有着重要的应用。
以下是一些例子: - 水质净化:科技液体分层原理可以用来分离出水中的悬浮物、重金属等有害物质,从而实现水质的净化和回收利用。
- 污水处理:科技液体分层原理可以用于处理污水中的有机物和无机盐等污染物,从而减少对环境的污染。
- 污染监测:科技液体分层原理可以用于监测环境中的污染物,通过分离出污染物,进行进一步的分析和评估。
3. 应用实例3.1 医疗领域实例在医疗领域,科技液体分层原理被广泛应用于疾病的诊断和治疗。
例如,通过离心技术可以将血液样本中的红细胞和血浆分离出来,从而实现对疾病的诊断。
细胞代谢组学样本要求引言细胞代谢组学是研究细胞内代谢物的种类和变化的一门科学。
通过对细胞内代谢产物的分析,可以了解细胞的生理状态、疾病发生机制以及药物作用等方面的信息。
在进行细胞代谢组学研究时,样本的选择和处理非常重要,合适的样本能够保证实验结果的准确性和可靠性。
样本类型在细胞代谢组学研究中,常用的样本类型包括细胞培养液、动物组织、人体生物体液等。
不同样本类型具有不同的特点和适用范围,选择合适的样本类型对于研究结果至关重要。
细胞培养液细胞培养液是指将细胞培养在含有营养物质和生长因子的液体培养基中得到的液体。
它具有以下优点: - 可以获得大量足够纯净的细胞代谢产物; - 可以通过调整培养条件来模拟不同生理状态下的代谢变化; - 可以方便地进行细胞处理和分离。
动物组织动物组织是指从动物体内取得的各种组织样本,可以是器官、肌肉、脑组织等。
它具有以下优点: - 可以反映不同器官或组织的代谢特点; - 可以研究某些疾病在特定组织中的代谢变化; - 可以通过对比正常和异常组织的代谢差异,揭示疾病发生机制。
人体生物体液人体生物体液包括血液、尿液、唾液等。
它具有以下优点: - 可以非侵入性地获取,对被试者无创伤; - 可以反映全身性的代谢状态; - 对于临床研究具有重要意义,可以用于早期诊断和治疗监测。
样本采集与处理在进行细胞代谢组学研究时,样本采集和处理是非常重要的环节。
不合适的采集和处理方法可能导致样本污染、代谢产物分解等问题,影响实验结果的准确性。
样本采集样本采集的方法应根据不同样本类型进行选择,一般包括以下几种常用方法: -细胞培养液:直接从细胞培养瓶中取出一定体积的培养液; - 动物组织:在动物体内取得需要研究的组织样本,注意避免污染和损伤; - 人体生物体液:通过合适的方法采集血液、尿液、唾液等生物体液。
样本处理样本处理的目的是提取和纯化代谢产物,常用的方法包括以下几种: - 蛋白质沉淀:用酸、醇等沉淀蛋白质,以去除干扰物质; - 液相萃取:利用溶剂将代谢产物从水相中萃取出来; - 固相萃取:利用固相吸附剂将代谢产物从样品中富集。
液体活检的检测方法液体活检是一种通过检测体液中的生物标记物来进行疾病诊断和监测的方法,近年来得到了广泛的关注和应用。
液体活检的检测方法主要包括血液、尿液、唾液、脑脊液等多种体液的检测方式,其中血液液体活检是目前应用最为广泛的一种方法。
本文将重点介绍液体活检的检测方法及其在临床诊断中的应用。
首先,血液液体活检是通过采集患者的血液样本,利用各种生化分析技术对其中的生物标记物进行检测和分析。
血液中的生物标记物包括但不限于肿瘤标志物、DNA、RNA、蛋白质等,它们可以反映出患者体内的疾病信息。
血液液体活检的检测方法主要包括酶联免疫吸附试验(ELISA)、质谱分析、核酸扩增技术(PCR)、流式细胞术等多种技术手段,这些方法可以对不同类型的生物标记物进行高灵敏度和高特异性的检测,为临床诊断提供了重要的辅助信息。
其次,尿液液体活检是通过采集患者的尿液样本,对其中的生物标记物进行检测和分析。
尿液中的生物标记物包括但不限于代谢产物、蛋白质、细胞等,它们可以反映出患者的肾脏功能、代谢情况、泌尿系统疾病等信息。
尿液液体活检的检测方法主要包括尿常规检查、尿液蛋白电泳、尿液细胞学检查等多种技术手段,这些方法可以对尿液中的生物标记物进行全面的检测和分析,为泌尿系统疾病的诊断和监测提供了重要的帮助。
再次,唾液液体活检是通过采集患者的唾液样本,对其中的生物标记物进行检测和分析。
唾液中的生物标记物包括但不限于DNA、RNA、蛋白质、细胞等,它们可以反映出患者口腔健康、消化系统疾病、自身免疫性疾病等信息。
唾液液体活检的检测方法主要包括唾液蛋白质组学分析、唾液DNA甲基化检测、唾液微生物组学分析等多种技术手段,这些方法可以对唾液中的生物标记物进行全面的检测和分析,为口腔和消化系统疾病的诊断和监测提供了重要的参考依据。
最后,脑脊液液体活检是通过腰椎穿刺采集患者的脑脊液样本,对其中的生物标记物进行检测和分析。
脑脊液中的生物标记物包括但不限于蛋白质、葡萄糖、细胞等,它们可以反映出患者神经系统疾病、脑膜炎、脑肿瘤等信息。
Western blot 流程梳理第1步:细胞蛋白提取1.1物品:细胞,1ml/200ul/100ul 移液枪/枪头,1.5ml EP管。
1.2试剂:PBS:购买1L 装PBS粉剂配制,过滤后使用;RIPA裂解液:1ml原RIPA裂解液+ 10 ul PMSF 配制。
1.3细胞步骤:从细胞间取6孔板———PBS洗涤:1ml枪移去培养液,加PBS轻柔洗涤3遍———加RIPA裂解液:150ul每孔,加液时分散点加,有助于裂解液充分接触细胞———反应5min———刮脱:用细胞刮反复刮脱细胞,微微倾斜孔板,将液体刮于一侧便于吸出,将各孔内液体分别吸到相应的1.5ml EP管中,注意应事先编号便于区分———超声震碎:按照说明震碎细胞,使细胞内蛋白充分析出———离心:超速离心机12000G 离心15min———转移:从离心机中取出样本,取出上清液与相应1.5ml EP管中,剩余沉淀舍弃,注意事先标记———各取20ul样本与另一相应EP管用于测蛋白浓度,剩余放于–80℃保存。
1.4组织提蛋白步骤:剪取组织适量(3mm*3mm*3mm左右大小),用PBS洗去血液,滤纸吸干水分,放于1.5ml EP管中,加RIPA裂解液500ul,小剪刀伸入EP管中剪碎组织,使用电动匀浆机伸入EP管液面下充分搅碎组织,然后离心、转移上清液的操作如前。
1.5取出用于测蛋白浓度20ul样本处理:于各EP管中分别加入180ul 三蒸水得20倍稀释液,放入4℃保存或现用。
第2步:测蛋白浓度——Lorry法2.1.配置lorry A/B液配方:A液(250ml):2.2标准蛋白液的制备取15ml离心管,三蒸水清洗3次,保证干净———精确称取牛血清白蛋白(ABV)20.0mg ,加入三蒸水10ml,充分混匀,得2mg/ml蛋白溶液———分装:1ml/支分装于1.5 ml EP管中;取250ul 2mg/ml蛋白溶液于1.5ml EP 管中,加三蒸水750ul,得0.5mg/ml蛋白标准品。