实验室制取溴苯PPT课件
- 格式:ppt
- 大小:146.00 KB
- 文档页数:9

制取溴苯和硝基苯制取溴苯需要用剧毒试剂──液溴为原料,因此不宜作为操作的实验,只要求根据反应原理设计出合理的实验方案。
下面是制取溴苯的实验方案与实验步骤:把苯和少量液态溴放在烧瓶里,同时加入少量铁屑作催化剂。
用带导管的瓶塞塞紧瓶口(跟瓶口垂直的一段导管可以兼起冷凝器的作用)。
在常温时,很快就会看到,在导管口附近出现白雾(由溴化氢遇水蒸气所形成)。
反应完毕后,向锥形瓶内的液体里滴入AgNO3溶液,有浅黄色溴化银沉淀生成。
把烧瓶里的液体倒在盛有冷水的烧杯里,烧杯底部有褐色不溶于水的液体。
不溶于水的液体是溴苯,它是密度比水大的无色液体,由于溶解了溴而显褐色。
注意事项:(1)装置特点:长导管;长管管口接近水面,但不接触(2)长导管的作用:导气;冷凝 [冷苯与溴](3)苯,溴,铁顺序加药品(强调:是液溴,不是溴水,苯与溴水只萃取,不反应)(4)铁粉的作用:催化(真正的催化剂是FeBr3)(5)提示观察三个现象:导管口的白雾;烧瓶中的现象;滴入硝酸银后水中生成的沉淀白雾是如何形成的?(长管口与水面位置关系为什么是这样)(6)将反应的混合物倒入水中的现象是什么?[有红褐色的油状液体沉于水底](7)溴苯的物理性质如何?[比水重,不溶于水,油状](8)如何除去溴苯中的溴?[水洗,再用10%烧碱溶液洗,再干燥,蒸馏](9)反应方程式2剧烈反应,有白雾生成,三颈烧瓶底部有褐色油状物出现,加NaOH溶液后有红褐色沉淀生成液体轻微翻腾,有气体逸出.导管口有白雾,溶液中生成浅黄色沉淀。
烧瓶底部有褐色不溶于水的液体1、如何检查装置气密性?2、冷凝管的作用?冷却水进出方向?用于导气和冷凝回流3、插入锥形瓶的长导管不伸入液面,为什么?溴化氢易溶于水,防止倒吸4、碱石灰干燥管的作用5、加NaOH作用是什么?6、能说明反应是取代反应的依据是?7、溴苯应该是无色、密度比水大的液体,但反应得到的溴苯却是褐色的液体,原因何在?能否用溴水与铁反应?(2)制取硝基苯的实验方案与实验步骤:①配制混和酸:先将1.5 mL浓硝酸注入大试管中,再慢慢注入2 mL浓硫酸,并及时摇匀和冷却。
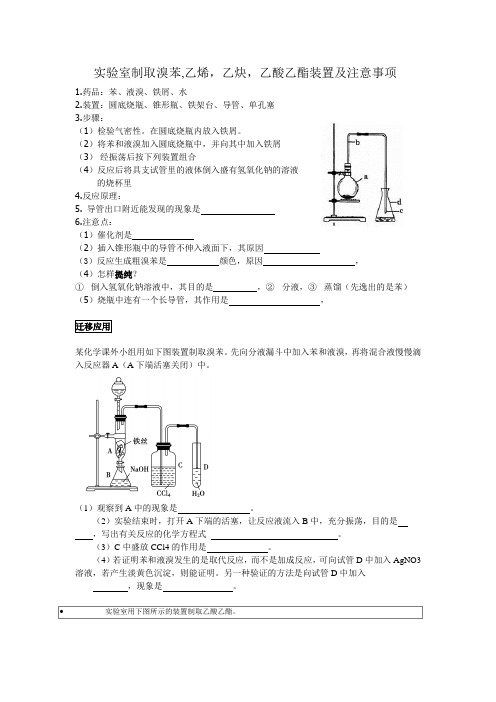
实验室制取溴苯,乙烯,乙炔,乙酸乙酯装置及注意事项1.药品:苯、液溴、铁屑、水2.装置:圆底烧瓶、锥形瓶、铁架台、导管、单孔塞3.步骤:(1)检验气密性。
在圆底烧瓶内放入铁屑。
(2)将苯和液溴加入圆底烧瓶中,并向其中加入铁屑(3) 经振荡后按下列装置组合(4)反应后将具支试管里的液体倒入盛有氢氧化钠的溶液的烧杯里4.反应原理:5. 导管出口附近能发现的现象是6.注意点: (1)催化剂是(2)插入锥形瓶中的导管不伸入液面下,其原因(3)反应生成粗溴苯是 颜色,原因 ,(4)怎样提纯?① 倒入氢氧化钠溶液中,其目的是 ,② 分液,③ 蒸馏(先逸出的是苯)(5)烧瓶中连有一个长导管,其作用是 ,迁移应用某化学课外小组用如下图装置制取溴苯。
先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A (A 下端活塞关闭)中。
(1)观察到A 中的现象是 。
(2)实验结束时,打开A 下端的活塞,让反应液流入B 中,充分振荡,目的是 ,写出有关反应的化学方程式 。
(3)C 中盛放CCl4的作用是 。
(4)若证明苯和液溴发生的是取代反应,而不是加成反应,可向试管D 中加入AgNO3溶液,若产生淡黄色沉淀,则能证明。
另一种验证的方法是向试管D 中加入 ,现象是 。
实验室用下图所示的装置制取乙酸乙酯。
(1)在大试管中配制一定比例的乙醇、乙酸和浓硫酸的混合液的方法是:将______________________________,然后轻轻振荡试管,使之混合均匀。
(2)装置中通蒸气的导管要插在饱和Na2CO3溶液的液面上,不能插入溶液中,目的是防止Na2CO3溶液的倒吸。
造成倒吸的操作上的原因是______________________________。
(3)浓硫酸的作用是:①_______________________________________________________________。
②_______________________________________________________________。


实验室常用溴和苯反应制取溴苯,得到粗溴苯后,要用如下的操作精制:①蒸馏②水洗③用干燥剂干燥④10%NaOH溶液洗⑤水洗,正确的操作顺序是B[ ]A.①②③④⑤B.②④⑤③①C.④②③①⑤D.②④①⑤③考点名称:物质的除杂•除杂的原则:(1)不增:不增加新的杂质(2)不减:被提纯的物质不能减少(3)易分:操作简便,易于分离气体除杂的原则:(1)不引入新的杂质(2)不减少被净化气体的量注意的问题:①需净化的气体中含有多种杂质时,除杂顺序:一般先除去酸性气体,如:氯化氢气体,CO2、SO2等,水蒸气要在最后除去。
②除杂选用方法时要保证杂质完全除掉,如:除CO2最好用NaOH不用Ca(OH)2溶液,因为Ca(OH)2是微溶物,石灰水中Ca(OH)2浓度小,吸收CO2不易完全。
方法:A. 杂质转化法:欲除去苯中的苯酚,可加入氢氧化钠,使苯酚转化为苯酚钠,利用苯酚钠易溶于水,使之与苯分开B. 吸收洗涤法;欲除去二氧化碳中混有的少量氯化氢和水,可使混合气体先通过饱和碳酸氢钠溶液,再通过浓硫酸即可除去C. 沉淀过滤法:欲除去硫酸亚铁溶液中混有的少量硫酸铜,加入少量铁粉,待充分反应后,过滤除去不溶物即可D. 加热升华法:欲除去碘中的沙子,即可用此法E. 溶液萃取法:欲除去水中含有的少量溴,可采用此法F. 结晶和重结晶:欲除去硝酸钠溶液中少量的氯化钠,可利用二者的溶解度不同,降低溶液温度,使硝酸钠结晶析出,可得到纯硝酸钠晶体G. 分馏蒸馏法:欲除去乙醚中少量的酒精,可采用多次蒸馏的方法H. 分液法:欲将密度不同且又互不相溶的液体混合物分离,可采用此法,如将苯和水分离K. 渗析法:欲除去胶体中的离子,可采用此法。
如除去氢氧化钠胶体中的氯离子•常见物质除杂总结:原物所含杂质除杂质试剂除杂质的方法(1)N2(O2)-------灼热的铜丝网洗气(2)CO2(H2S)-------硫酸铜溶液洗气(3)CO(CO2)-------石灰水或烧碱液洗气(4)CO2(HCl)-------饱和小苏打溶液洗气(5)H2S(HCl)-------饱和NaHS溶液洗气(6)SO2(HCl)-------饱和NaHSO3溶液洗气(7)Cl2(HCl)-------饱和NaCl溶液洗气(8)CO2(SO2)-------饱和小苏打溶液洗气(9)碳粉(MnO2)-------浓盐酸加热后过滤(10)MnO2(碳粉)-------加热灼烧(11)碳粉(CuO)-------盐酸或硫酸过滤(12)Al2O3(Fe2O3)-------NaOH溶液(过量),再通CO2过滤、加热固体(13)Fe2O3(Al2O3)-------NaOH溶液过滤(14)Al2O3(SiO2)-------盐酸NH3·H2O过滤、加热固体(15)SiO2(ZnO)-------盐酸过滤(16)CuO(ZnO)-------NaOH溶液过滤(17)BaSO4(BaCO3)-------稀硫酸过滤(18)NaOH(Na2CO3)-------Ba(OH)2溶液(适量)过滤(19)NaHCO3(Na2CO3)-------通入过量CO2(20)Na2CO3(NaHCO3)-------加热(21)NaCl(NaHCO3)-------盐酸蒸发结晶(22)NH4Cl[(NH4)2SO4]-------BaCl2溶液(适量)过滤(23)FeCl3(FeCl2)-------通入过量Cl2(24)FeCl3(CuCl2)-------铁粉、Cl2过滤(25)FeCl2(FeCl3)-------铁粉过滤(26)Fe(OH)3胶体(FeCl3)-------(半透膜)渗析(27)CuS(FeS)-------稀盐酸或稀硫酸过滤(28)I2(NaCl)------升华(29)NaCl(NH4Cl)-------加热(30)KNO3(NaCl)-------蒸馏水重结晶(31)乙烯(SO2、H2O)碱石灰洗气(32)乙烷(乙烯)-------溴水洗气(33)溴苯(溴)-------稀NaOH溶液分液(34)硝基苯(NO2)-------稀NaOH溶液分液(35)甲苯(苯酚)-------NaOH溶液分液(36)乙醛(乙酸)-------饱和Na2CO3溶液蒸馏(37)乙醇(水)-------新制生石灰蒸馏(38)苯酚(苯)-------NaOH溶液、CO2分液(39)乙酸乙酯(乙酸)-------饱和Na2CO3溶液分液(40)溴乙烷(乙醇)-------蒸馏水分液(41)肥皂(甘油)-------食盐过滤(42)葡萄糖(淀粉)-------(半透膜)渗析。


实验室制取溴苯实验目的:本实验旨在通过合成反应,制备出溴苯。
实验原理:溴苯是由苯与溴化亚铁(FeBr3)催化剂进行加成反应制备的。
催化剂会使芳香体系的电子云密度减小,从而提高其电子亲合性。
实验步骤:步骤一:准备实验装置和试剂1. 准备一个干净无水的圆底烧瓶,装入苯(C6H6)和溴化亚铁(FeBr3)催化剂。
2. 准备一只分液漏斗,并在漏斗颈处插入一根游离管。
3. 准备一只带有冷却器的接收瓶,用于收集溴苯产物。
步骤二:反应操作1. 将装有苯和溴化亚铁催化剂的圆底烧瓶连接至分液漏斗,游离管的另一端插入接收瓶。
2. 缓慢滴加溴素(Br2)至分液漏斗,注意滴加速度要适中,以保证反应进行顺利。
滴加速度过快可能导致副反应的发生。
3. 在反应过程中,观察溴素的颜色变化以及反应液的温度变化。
反应结束后,停止滴加。
步骤三:产物提取1. 分离接收瓶中的有机相和无机相。
有机相为溴苯产物,无机相中含有FeBr3催化剂和未反应的溴素。
2. 将有机相倒入干净的干燥漏斗中,用无水氯化钠(NaCl)干燥有机相。
干燥后的溴苯即可得到。
步骤四:纯化溴苯1. 将溴苯再次蒸馏,用以去除残余的杂质。
2. 将纯净的溴苯收集于干净无水的容器中,即可获得制取的溴苯。
实验注意事项:1. 实验操作时要佩戴化学防护手套、实验服、护目镜等安全设备,确保人身安全。
2. 实验条件下,溴素具有刺激性气味和腐蚀性,需要避免直接接触皮肤和呼吸。
实验室应保持通风良好。
3. 操作过程中,需要注意滴加速度,过快的滴加速度可能导致危险情况的发生。
4. 实验结束后,对产生的废液和残留物进行妥善处理,避免对环境造成污染。
实验结果与讨论:通过以上实验操作步骤,制备出了溴苯。
在实验过程中,反应液的颜色和温度发生了变化,说明了反应的进行。
通过溴苯的蒸馏纯化,可以得到纯净的溴苯产物。
总结:本实验通过合成反应,成功制备了溴苯。
溴苯是一种有机溴化合物,常用于有机合成的中间体和溶剂。
通过实验,进一步了解了有机合成实验的操作步骤和注意事项,培养了实验操作的技能和安全意识。
实验研究 15 溴苯的制取与提纯[ 教材实验原型 ]溴苯的制取:在 FeBr3催化作用下,苯环上的氢原子被溴原子所取代生成溴苯。
溴苯是密度比水大的无色液体。
[ 教材实验原理 ]1.制取溴苯需要注意的问题:(1)实验用的是液溴而不是溴水。
(2)为减少苯和液溴的挥发,常采纳长导管或冷凝管进行冷凝回流。
(3)铁粉和溴易发生反响生成 FeBr3,加入的铁粉其实不是催化剂,起催化作用的是FeBr3。
(4)HBr 极易溶于水,在汲取HBr 时要注意防备倒吸。
(5)查验 HBr 的生成常利用 AgNO3溶液,现象是产生不溶于 HNO3的淡黄色积淀。
2.提纯净化溴苯的实验步骤以下:[ 命题角度研究 ]1.苯与液溴混淆后,不加入铁粉或FeBr3,可否制得溴苯?提示:不加入催化剂时,苯与液溴反响很慢。
2.制取溴苯时,可否用溴水取代液溴?提示:不可以。
苯能萃取溴水中的Br 2,但不反响。
3.实验室制得的粗溴苯为何呈红棕色?如何除掉?提示:溴苯中溶有Br2而呈红棕色,用NaOH溶液清洗即可除掉Br 2。
4.如何汲取HBr 气体?提示:导管尾端接一个倒扣的漏斗置于水面上。
5.如何证明苯与液溴发生的是取代反响?提示:将产生的气体通入 AgNO3溶液中,产生浅黄色积淀,说明有 HBr 生成,则证明苯与液溴发生了取代反响。
[ 典题真题体验 ]( 高考经典题 ) 溴苯是一种化工原料,实验室合成溴苯的装置表示图及相关数据以下:苯溴溴苯密度 /g ·cm-3沸点 / ℃8059156水中溶解度微溶微溶微溶按以下合成步骤回答以下问题:(1)在 a 中加入 15 mL无水苯和少许铁屑。
在 b 中当心加入 4.0 mL液态溴。
向 a 中滴入几滴溴,有白色烟雾产生,是由于生成了________气体。
持续滴加至液溴滴完。
装置d的作用是________________________________________________________________________ 。