高中化学复习知识点:氨气的实验室制法
- 格式:docx
- 大小:413.17 KB
- 文档页数:15

考点氨气的工业制备及实验室制法1.(2019全国Ⅰ卷)利用生物燃料电池原理研究室温下氨的合成,电池工作时MV2+/MV+在电极与酶之间传递电子,示意图如下所示。
下列说法错误的是A. 相比现有工业合成氨,该方法条件温和,同时还可提供电能B. 阴极区,氢化酶作用下发生反应H2+2MV2+2H++2MV+C. 正极区,固氮酶催化剂,N2发生还原反应生成NH3D. 电池工作时质子通过交换膜由负极区向正极区移动【答案】B【解析】由生物燃料电池的示意图可知,左室电极为燃料电池的负极,MV+在负极失电子发生氧化反应生成MV2+,电极反应式为MV+—e—= MV2+,放电生成的MV2+在氢化酶的作用下与H2反应生成H+和MV+,反应的方程式为H2+2MV2+=2H++2MV+;右室电极为燃料电池的正极,MV2+在正极得电子发生还原反应生成MV+,电极反应式为MV2++e—= MV+,放电生成的MV+与N2在固氮酶的作用下反应生成NH3和MV2+,反应的方程式为N2+6H++6MV+=6MV2++NH3,电池工作时,氢离子通过交换膜由负极向正极移动。
A项、相比现有工业合成氨,该方法选用酶作催化剂,条件温和,同时利用MV+和MV2+的相互转化,化学能转化为电能,故可提供电能,A正确;B项、左室为负极区,MV+在负极失电子发生氧化反应生成MV2+,电极反应式为MV+—e—= MV2+,放电生成的MV2+在氢化酶的作用下与H2反应生成H+和MV+,反应的方程式为H2+2MV2+=2H++2MV+,B错误;C项、右室为正极区,MV2+在正极得电子发生还原反应生成MV+,电极反应式为MV2++e—= MV+,放电生成的MV+与N2在固氮酶的作用下反应生成NH3和MV2+,C正确;D项、电池工作时,氢离子(即质子)通过交换膜由负极向正极移动,D正确。
2.(2018江苏)下列有关物质性质的叙述一定不正确的是A.向FeCl2溶液中滴加NH4SCN溶液,溶液显红色B.KAl(SO4) 2·12H2O溶于水可形成Al(OH)3胶体C.NH4Cl与Ca(OH)2混合加热可生成NH3D.Cu与FeCl3溶液反应可生成CuCl2【答案】A【解析】A项,FeCl2溶液中含Fe2+,NH4SCN用于检验Fe3+,向FeCl2溶液中滴加NH4SCN溶液,溶液不会显红色,A项错误;B项,KAl(SO4)2·12H2O溶于水电离出的Al3+水解形成Al(OH)3胶体,离子方程式为Al3++3H 2O Al(OH)3(胶体)+3H+,B项正确;C项,实验室可用NH4Cl和Ca(OH)2混合共热制NH 3,反应的化学方程式为2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O,C项正确;D项,Cu与FeCl3溶液反应生成CuCl2和FeCl2,反应的化学方程式为Cu+2FeCl3=CuCl2+2FeCl2,D项正确。


中学实验室制18种气体的化学方程式和方法1.氢气(H2)化学方程式:2HCl+Zn→ZnCl2+H2制备方法:将锌粉加入稀盐酸中,产生氢气。
2.氧气(O2)化学方程式:2KClO3→2KCl+3O2制备方法:加热高锰酸钾(KMnO4)或高氯酸钾(KClO3),产生氧气。
3.氮气(N2)化学方程式:2NH4NO2→2N2+2H2O+O2制备方法:加热亚硝酸铵(NH4NO2),产生氮气。
4.氯气(Cl2)化学方程式:2NaCl+2MnO2+4HCl→2MnCl2+2H2O+Cl2制备方法:将氯化钠和高锰酸钾加入稀盐酸中,产生氯气。
5.氟气(F2)化学方程式:2HF+Ca(F2)→CaF2+H2↑制备方法:在氢氟酸中通入氟化钙,产生氟气。
6.氡气(Rn)化学方程式:N/A制备方法:由于氡的放射性,通常无法在实验室中制备。
7.氖气(Ne)化学方程式:N/A制备方法:氖是一种稀有气体,通常会从空气中分离提纯。
8.氦气(He)化学方程式:N/A制备方法:和氖一样,氦也是从空气中提炼得到的。
9.氦气(Ar)化学方程:N/A制备方法:氩也是通过分离空气中的气体得到的。
10.气体的方程式:不同的气体需要不同的制备方法和化学方程式,这是因为它们具有不同的化学性质和反应条件。
11.二氧化碳(CO2)化学方程式:CaCO3+2HCl→CaCl2+H2O+CO2↑制备方法:将碳酸钙与盐酸反应,产生二氧化碳。
12.二氧化硫(SO2)化学方程式:CuSO3+2HCl→CuCl2+SO2↑+H2O制备方法:将亚硫酸铜与盐酸反应,产生二氧化硫。
13.氮氧化物(NOx)化学方程式:N/A制备方法:氮氧化物是一类复杂的气体,通常是通过高温燃烧反应或者其他专门的制备方法得到的。
14.一氧化碳(CO)化学方程式:2C+O2→2CO制备方法:碳与氧气反应,产生一氧化碳。
15.氢氟化氢(HF)化学方程式:CaF2+H2SO4→2HF↑+CaSO4制备方法:氢氟化氢可以通过硫酸和氟化钙反应得到。

第二课时氨和铵盐[明确学习目标] 1.知道NH3的物理性质以及氨水显碱性的原因。
2.学会氨气的实验室制取、收集和检验方法。
3.学会铵盐的性质及NH+4的检验方法。
学生自主学习氨的性质及用途1.氨的性质(1)物理性质(2)氨气易溶于水——喷泉实验(3)化学性质2.氨水的性质3.氨的用途(1)氨是氮肥工业、有机合成工业及制造硝酸、铵盐和纯碱的原料。
(2)氨易液化,可作□10制冷剂。
铵盐的性质 1.物理性质绝大多数铵盐都是□01易溶于水的白色或无色晶体。
2.化学性质(写化学方程式) (1)不稳定性,受热易分解,如NH 4Cl :□02NH 4Cl=====△NH 3↑+HCl ↑; NH 4HCO 3:□03NH 4HCO 3=====△NH 3↑+H 2O +CO 2↑。
(2)与碱反应(如氢氧化钠与硝酸铵溶液反应) NH 4NO 3+NaOH=====△NaNO 3+NH 3↑+H 2O 。
氨的实验室制法1.实验原理□012NH4Cl+Ca(OH)2=====△CaCl2+2H2O+2NH3↑。
2.收集方法□02向下排空气法。
3.实验装置1.根据NH3与H2O的反应原理分析:氨水中存在哪些微粒?提示:氨水是氨气的水溶液,NH3溶于水发生了反应:NH3+H2O NH3·H2O,所以氨水的主要成分为NH3·H2O,由于NH3·H2O NH+4+OH-,所以氨水中存在的微粒有①分子:NH3·H2O、H2O、NH3;②阳离子:NH+4、H+;③阴离子:OH-。
2.实验室能否用加热氯化铵的方法制取氨气?提示:不能。
氯化铵受热分解生成的氨气和氯化氢遇冷会重新结合成氯化铵。
3.实验室制取氨气时常在收集氨气的试管口塞一团疏松的棉花团,这么做的目的是什么?提示:防止氨气与空气形成对流,以收集到较纯净的氨气。
课堂互动探究知识点一氨的性质1.喷泉形成的原理容器内外存在较大的压强差,在压强差的作用下,液体迅速流动,通过带有尖嘴的导管喷出来,即形成喷泉。

第3课时NH3及常见气体的制备方法[核心素养发展目标] 1.掌握实验室制取NH3的方法。
2.掌握实验室制取常见气体的原理、装置、收集、净化方法及制备方法的比较。
一、氨的实验室制法1.氨的实验室制法制备原理实验装置收集NH3极易溶于水,可以用________________________收集验满把湿润的红色石蕊试纸置于试管口,试纸变____________;或将蘸有浓盐酸的玻璃棒置于试管口,有______________产生思考(1)此装置存在的弊端是什么?如何进行改进?________________________________________________________________________ (2)收集NH3时,试管口处为什么加一团棉花?________________________________________________________________________ 2.氨的简易制法方法及装置原理及化学方程式氨水具有________和______,受热易分解。
化学方程式为____________________________NaOH固体具有吸水性,溶于水放出大量的热,促使氨水分解。
CaO与水反应,使溶剂(水)减少;反应放热,促使氨水分解。
化学方程式为____________________________________1.判断正误(1)实验室中可以利用加热NH4Cl分解的方法制取NH3()(2)由于氨极易溶于水,所以不能用排水法收集氨,只能用向下排空气法收集()(3)氨不能用浓硫酸进行干燥,但可以用无水CaCl2干燥()(4)为加快产生NH3的速率,实验室中可以用NaOH和NH4Cl反应制NH3()(5)由于氨极易溶于水,所以多余的氨可以用导管直接插入水中进行吸收() 2.(2023·江苏盐城高一联考)下列装置用于实验室中制取干燥氨气的实验,其中能达到实验目的的是()A.用装置甲制备氨气B.用装置乙除去氨气中的少量水C.用装置丙收集氨气D.用装置丁吸收多余的氨气(1)制氨气所用的铵盐不能用NH4NO3、NH4HCO3、(NH4)2CO3等代替,NH4NO3加热时爆炸,而NH4HCO3、(NH4)2CO3极易分解产生CO2气体使制得的NH3不纯。

氨和铵盐【学习目标】1、了解氨的物理性质,理解氨的化学性质。
2、掌握氨气的实验室制法,了解氨气的工业制法。
3、了解铵盐的性质,掌握氨气和铵离子的检验方法。
【要点梳理】要点一、氨气1、物理性质通常状况下,氨是一种无色、有刺激性气味的气体,密度比空气小,极易溶于水(常温常压下,体积比为1∶700),氨的水溶液称为氨水。
氨在加压下容易液化,液氨气化时吸收大量的热,使周围环境温度急剧降低,工业上可使用液氨作制冷剂。
2、化学性质(1)与水反应:NH3+H2O NH3·H2O NH4++OH-要点诠释:NH3·H2O是弱碱,氨水显弱碱性,具有碱的通性。
氨水可使紫色石蕊试液变蓝,故常用湿润的红色石蕊试纸检验NH3的存在。
氨水是混合物,溶液中存在的微粒有三种分子:NH3·H2O、NH3、H2O;三种离子:NH4+、OH-及少量的H+。
(2)与酸反应:氨气与酸反应生成铵盐NH3+HCl=NH4Cl(白烟)NH3+HNO3=NH4NO3(白烟)2NH3+H2SO4=(NH4)2SO4(3)与某些盐反应:一般生成难溶的碱,如氯化铁溶液与氨水反应:Fe3++3NH3·H2O==Fe(OH)3↓+3NH4+(4)还原性氨分子中的氮元素呈-3价,因此氨气在一定条件下具有还原性,在一定条件下可被某些强氧化剂氧化。
8NH3+3Cl2==N2+6NH4Cl【高清课堂:氨和铵盐ID:395522#氨气的实验室制法】3、氨气的实验室制法(1)原理:利用复分解反应强碱制弱碱2 NH4Cl +Ca(OH)2CaCl2+2NH3↑+2H2O要点诠释:药品的选择②碱:一般用熟石灰,不用NaOH或KOH,因为NaOH或KOH易吸水结块,而且对玻璃仪器腐蚀性较强。
(2)装置:固-固反应加热装置(同制O2)干燥:碱石灰(或固体NaOH、固体CaO)(不能用浓H2SO4、CaCl2干燥,CaCl2与NH3反应:CaCl2+8NH3= CaCl2·8 NH3)要点诠释:①发生装置的试管口略向下倾斜;②加热温度不宜过高,并用酒精灯外焰由前向后逐渐加热。
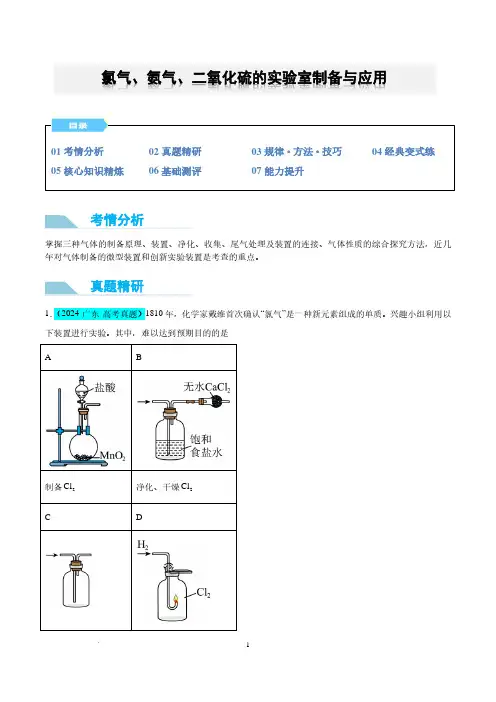
制备2Cl 净化、干燥2Cl氯气、氨气、二氧化硫的实验室制备与应用考情分析真题精研收集2Cl 验证2Cl 的氧化性 A .AB .BC .CD .D2.(2024·河北·高考真题)图示装置不能完成相应气体的发生和收集实验的是(加热、除杂和尾气处理装置A .AB .BC .CD .D规律·方法·技巧2.(2023·广东·高考真题)1827年,英国科学家法拉第进行了3NH 喷泉实验。
在此启发下,兴趣小组利用以下装置,进行如下实验。
其中,难以达到预期目的的是A .图1:喷泉实验B .图2:干燥3NHC .图3:收集3NHD .图4:制备3NH经典变式练核心知识精炼或其他强氧化剂,如KMnO4、K2Cr2O7、KClO3等)氧化浓盐酸。
MnCl+Cl↑+2H O实验室制取少量氨气的两种简易方法见图甲)△NH3↑+H2O。
)中滴加浓氨水法(见图乙)浓氨水中存在以下平衡:NH3+H2ONH+4+OH-,加入固态碱性物质NH3·H2O,消耗水且使c(OH-)增大,使平衡逆向移动,同时反应放热,促进NH3·H基础测评A.制氯气B.除氯气中HClC.干燥氯气D.尾气处理A.A B.B C.C D.DCl的制备与性质探究实验时,下列说法正确2.(23-24高三下·广东江门·阶段练习)利用如图所示装置进行2的是SO性质的微型实验,滤纸①~④分别浸泡了相关3.(24-25高三上·云南昆明·阶段练习)如图所示为探究2试剂,实验时向试管中滴入几滴浓硫酸。
下列说法正确的是A .滤纸①先变红后褪色B .滤纸②褪色证明2SO 具有漂白性C .滤纸③褪色取出放置一段时间后颜色可能恢复D .滤纸④上有褪色固体生成,证明2SO 具有还原性4.(23-24高三下·江苏盐城·阶段练习)实验室需要制备少量SO 2并验证其性质,下列实验装置不能..达到相应实验目的的是2 的漂白性2 SO 25.(2024·河北衡水·模拟预测)某小组同学用医用三通阀和针筒完成了二氧化硫的制备和性质检验的创新实验.将b 中浓硫酸推入a 中,将生成的2SO 收集在c 中,之后用c 中气体分别通入d 、e 、f 、g 、h 中检验2SO 的性质.以下说法错误的是注:通过调节阀可使所朝向部位连通.SO对应的性质:d、e褪色-漂白性;f、g褪色-还原性;h黄色浑浊-氧化性A.实验现象和2B.如果只想观察d中的实验现象,其他调节阀已调好,则d处的调节阀应调为SO的吸收C.实验结束后,将j中NaOH溶液推入到a、c中,可实现残留;2D.a、b的药品不能用铜和浓硫酸代替回答下列问题:(1)装置A中发生反应的化学方程式为。

第四节氨、硝酸和硫酸第一课时氨及氨的实验室制法【课时目标】1.了解氨的物理性质和氨的化学性质。
2.理解氨的实验室制法。
【基础知识导航】一、氨的固定将___的氨转变为___的方法叫做氨的固定,工业上固氮的方法为_________(用化学方程式表示)二、氨的性质1、氨的物理性质【实验探究】氨溶于水的喷泉实验现象结论2、氨的化学性质(1)NH3与水的反应NH3·H2O很不稳定,受热会分解【液氨与氨水的比较】(2)NH3与酸的反应氨与氯化氢的反应的化学方程式上述反应的现象是______________________,为什么?____________________【注意】上述反应可用于检验氯化氢气体或氨气的检验氨与硫酸的反应化学方程式【思考】氨与硫酸反应有没有类似氨与氯化氢反应的现象?为什么?_______________三、铵盐的性质1、铵盐受热易分解写出氯化铵受热分解的反应方程式______________________________________________ 写出碳酸氢铵受热分解的方程式【思考】氯化氨的分解与生成的反应是不是可逆反应?为什么?____________________2、铵盐与碱的反应写出硝酸铵与氢氧化钠溶液反应的方程式______________________________________ 写出上述反应的离子方程式________________________________________【思考】实验室如何检验铵盐?___________________________________四、氨的实验室制法1、反应原理2、装置:“+”加热装置;发生装置与制相似。
3、收集:法;收集的试管口塞上棉团,作用是。
4、干燥:5、检验:(1)(2)6、实验室能不能用氢氧化钠与氯化铵反应制备氨气?为什么?______________________7、实验室制备氨气的其它方法(1)直接加热浓氨水(2)浓氨水与固体烧碱或生石灰混合五、氨的用途【典例导析】例题1:氨下列关于氨和氨水的说法中正确的是()A、氨水和液氨的成分相同B、氨水可使酚酞指示剂变红C、氨水中共有5中粒子,其中物质的量浓度最大的粒子是OH-D、氨水随着质量分数的增大,溶液密度也随之增大【点拨】A中一个是混合物一个是纯净物,B氨水显碱性,C中氨水的电离程度很小,D中应为氨的密度小,规律也应该反的。

制氨气的几种方法氨气是一种非常重要的化学物质,它可以用来制作许多感兴趣的物品,例如农业用品,食品添加剂,高级材料和医疗材料。
它也是工业废气处理技术中的关键物质,也是医药用品工业的原料。
如今,它也被广泛应用于煤炭化工,清洁能源,冶金等生产领域。
在这里,我们将介绍制备氨气的几种方法:第一种是利用氮氧化物反应制备氨气。
这种反应利用空气中的氮气和氧气经过一系列化学反应后而产生氨气。
这种方法主要利用反应器和特殊的催化剂,可以在比较低的温度和压力下加以制备。
这种方法的反应效率是很高的,但它消耗的能量量也比较多。
第二种是利用氨氧化物反应制备氨气。
这种反应也是空气中的氮气和氧气的反应,但是使用的是氨氧化物,利用这种反应可以在更低的温度和压力下制备氨气。
但氨氧化物的成本比较高,此外,这种方法反应效率也比较低。
第三种方法是采用蒸汽煤气制备法制备氨气。
这种方法主要利用煤气中的氮气和氧气经过一系列复杂的化学反应而产生氨气。
因为煤气中的氮气和氧气含量较为丰富,所以这一制备方法比常规方法更具优势。
另外,煤气是从高温气化煤中排放得到的,所以在这里也可以利用温度的加热来更有效的制备氨气。
但是,这种方法也要求同时进行很多其它反应,以确保反应效率的最大化,而且经常会发生能量损失的情况。
此外,也有一些其他的制备氨气的方法,甲烷气化反应,甲烷氯化反应,三氯化硫气化反应,氟酸反应和湿法钨化反应等等。
这些反应具有不同的反应效率,生产成本也不同。
但是,这些方法大多是利用化学反应将氮气和氧气转化为氨气,也是目前制备氨气的主要方法。
通过以上的介绍,大家应该对制备氨气的几种方法有了一个初步的了解。
氨气在化工领域中的重要性是不言而喻的,相比于其他物质,它的应用要更加广泛。
所以,我们对它制备技术的研究也更加重要。
随着技术的发展,氨气制备技术也将有更多的进步空间,未来会更加发展壮大。

第二节 氨气的实验室制法以及硝酸与金属反应【课前预习】【学习目标】氮元素单质及其化合物知识与其他元素单质及其化合物知识的综合应用。
【学习重点】1.氨气的实验室制法2.金属与硝酸反应的有关计算一.氨气的实验室制法药品: 、 反应原理: (固体+固体――→△气体)反应方程式: 装置:圆底烧瓶和分液漏斗 收集:验满:用湿润的 或蘸有 的玻璃棒。
防止多余氨气污染空气的方法:收集NH 3后的导管口处塞一团湿棉花或用稀硫酸浸湿的棉花。
干燥:NH 3通过盛有 的干燥管。
实验室制取氨的其他方法:加热浓氨水、氧化钙与浓氨水反应等。
二、硝酸与金属的反应HNO 3几乎能与所有的金属(除金、铂、钛以外)发生氧化还原反应(如Cu)。
________________________________________________________________; _________________________________________________________________ 说明:a.硝酸与不活泼金属反应时,浓硝酸生成NO 2,稀硝酸生成NO 。
b.常温下浓硝酸使Fe 、Al________。
特别提示:氧化性酸和酸的氧化性概念辨析酸的氧化性:实质上指氢离子的氧化性,任何酸都有不同程度电离出H +的能力,H +在一定条件下获得电子生成H 2。
因此在某些反应中酸作氧化剂其实质上是H +作氧化剂,如:锌与盐酸或稀硫酸的反应,都可以用Zn +2H +===Zn 2++H 2↑离子方程式表示此类反应的实质。
氧化性酸:是酸根离子获得电子的能力,酸根离子获得电子后,化合价降低,形成相应的低价含氧化合物甚至是单质。
如浓硫酸与Cu反应:Cu+2H2SO4(浓)=====△CuSO4+SO2↑+2H2O,浓硫酸与木炭反应:C+2H2SO4(浓)=====△CO2↑+2SO2↑+2H2O,硝酸与锌反应:4Zn+10HNO3(稀)===4Zn(NO3)2+N2O↑+5H2O,5Zn+12HNO3(很稀)===5Zn(NO3)2+N2↑+6H2O,浓硝酸与木炭、单质硫、磷的反应等等。

氨气的转化知识点总结1. 氨气的制备氨气的制备方法主要有合成氨法和氨盐分解法两种。
合成氨法是指通过氮气和氢气的催化反应制备氨气。
这一反应是工业上最主要的生产方式,通常采用费-麦勒反应,利用高温高压条件下,以铁、铑或钼等金属为催化剂,将氮气和氢气在催化剂表面逐步转化为氨气。
而氨盐分解法则是利用氯化铵和氢氧化钠或氢氧化钾制备氨气。
氯化铵在加热时分解产生氨气和氯化氢气体,而氢氧化钠或氢氧化钾则可以吸收氯化氢气体,得到氨气。
2. 氨气的性质氨气具有特殊的性质,了解这些性质对于氨气的转化以及在实际应用中至关重要。
首先,氨气是碱性气体,能够和酸发生中和反应,生成相应的盐。
其次,氨气是一种有毒气体,对皮肤和呼吸道有刺激作用,长时间暴露于高浓度氨气环境可能对人体造成伤害。
另外,氨气易溶于水,在水中形成氨水,同时也可与许多物质发生反应。
此外,氨气还具有挥发性强、吸湿性强的特点。
3. 氨气的转化反应氨气在化学反应中可以发生多种转化,主要包括以下几种反应:(1) 氨气的氧化反应氨气与氧气在气相或液相条件下可以发生氧化反应,生成氮氧化物和水。
氨气的氧化反应通常需要在高温下进行,可采取催化氧化的方式进行反应。
例如,氨气与过氧化氢在催化剂的存在下会发生氧化反应,生成氮氧化物和水。
(2) 氨气的水合反应氨气在水中可以发生水合反应,生成氢氧化铵。
这一反应是氨气在水溶液中的主要转化方式之一,也是氨气在实际应用中的常见反应过程。
(3) 氨气的氯化反应氨气和氯气在适当条件下可以发生氯化反应,生成氮氯化物。
这一反应通常需要在充分通风的条件下进行,因为氨气和氯气都具有毒性,反应后的产物也具有一定的危险性。
(4) 氨气的硝化反应氨气可以和硝酸盐在适当条件下发生硝化反应,生成硝酸铵。
硝化反应在农业肥料生产中有着重要的应用,而硝酸铵也是一种常见的氮肥。
(5) 氨气的脱氢反应氨气在高温下可以发生脱氢反应,生成氢气和氮气。
脱氢反应通常需要在高温高压条件下进行,是实现氢气生产的重要途径之一。