2.3氧化还原反应
- 格式:ppt
- 大小:1.05 MB
- 文档页数:51




高中化学必修1 §2.3《氧化还原反应》一、说教材1、地位与作用《氧化还原反应》安排在高中化学必修1第二章《化学物质及其变化》中的第三节,有其重要的意义。
因为在中学阶段的基本概念、基础理论知识中,《氧化还原反应》占有极其重要的地位,贯穿于中学化学教材的始终,是中学化学教学的重点和难点之一。
在中学化学中要学习很多重要元素及其化合物的知识,凡涉及元素价态变化的反应都是氧还原反应。
只有让学生掌握氧化还原反应的基本概念,才能使他们理解这些反应的实质,学生对本节教材掌握的好坏直接影响着其以后对化学的学习。
本节教材安排在这里是承前启后,它既复习了初中的基本反应类型及氧化反应、还原反应的重要知识,并以此为铺垫展开对氧化还原反应的较深层次的学习,还将是今后联系元素化合物知识的重要纽带。
氧化和还原是一对典型矛盾,它们既是相反的,又是相依存的,通过认真引导使学生逐步理解对系统规律在自然现象中的体现,又会协助学生用准确的观点和方法学习化学知识。
2、教学目标2.1、知识与技能:①能从化合价的变化,理解并建立氧化还原反应的概念;②通过对典型化学反应的分析,理解氧化还原反应的本质是电子转移。
2.2过程与方法:①学会怎样从特殊到一般规律,再从一般规律到特殊的理解问题的科学方法;②通过“思考与交流”、“问题探究”等活动,增强学生分析、联想、类比、迁移以及概括的水平。
2.3、情感态度价值观:通过氧化还原反应概念的演变,培养学生用发展的眼光、科学的态度、勇于探索的品质学习化学;通过氧化还原反应相关概念的学习,初步形成对立统一的辨证唯物主义的观点。
3、重难点重点:用化合价升降和电子转移的观点来理解氧化还原反应。
难点:用电子转移的观点分析氧化还原反应。
二、说学情学生在初中化学学习中已经接触了很多反应,已经掌握把化学反应分为四种基本反应,并能从具体的反应理解氧化反应和还原反应,但并没理解到氧化还原反应的本质特征;学习了化合价,理解了化合价的变化,但并没有了解化合价变化的实质以及化合价的变化与得失电子之间的关系。


《氧化还原反应》氧化还原知识点总结及训练氧化还原反应方程式的配平氧化还原反应:化合价升高→失电子→还原剂→氧化反应→氧化产物化合价降低→得电子→氧化剂→还原反应→还原产物本质:电子发生了转移;表现:化合价变化。
结论:电子转移总数相等,化合价升降总数也必然相等,据此我们可以用化合价升降法来配平氧化还原反应的化学方程式.一、氧化还原反应方程式的配平方法(一).化合价升降法(得失电子守恒法)1.配平的原则 :(1).反应中还原剂化合价升高的总数和氧化剂化合价降低的总数相等(电子守恒).(2).反应前后各种原子的种类和个数相等(质量守恒).2.配平的步骤:(1).首先写出反应物、产物的化学式;(2).标出反应前后变化的元素化合价;(3).使化合价升降总数相等;(4).用质量守恒定律,观察法进行配平.例1:Fe2O3+CO→ Fe+CO2+30Fe→Fe降 3 价× 2=6+2+4C→C降2价×3=6例2:C +HNO3(浓→ H 2O + NO2 + CO 2练习: 1、 NH3+O2( 纯) → N2+H2O2、 Cu + HNO3→ Cu(NO3) 2 + NO 2 + H 2O例3:价态归中的反应: H 2S+SO2→ S+H2O练习: Fe+FeCl3→ FeCl 2KMnO + HCl → KCl + MnCl2+ Cl2↑ +H O42 +7+2Mn →Mn升 5 价× 2=10-102Cl→Cl2降2价× 5=10 (不能生成半个分子)例 4:岐化反应: Cl 2+ NaOH (浓)→ NaCl+ NaClO3+H2O 练习:S+ KOH(浓)→K2S+K2SO3 + H2OP4+ NaOH + H O → NaH PO +PH3224例5:多元素多价态反应: FeS 2 + O 2→ Fe 2O3 + SO 2练习: Cu S + HNO→Cu ( NO)2+NO↑+ H SO+H2O23324课后练习:MnO 2 +HCl(浓)―—MnCl2+Cl2↑+H2OAs2O3+ HNO3+H2O→H3AsO4+NOP +HNO3(浓)→H3PO4 +NO2↑+H2OKMnO +KNO+H SO→ MnSO +K SO+ KNO3+H O42244242KMnO 4 +HCl→KCl +MnCl2+Cl2↑+H 2ONH4NO ―—N2+HNO3+ H O 32MnO4- + H 2O2+H +― Mn 2++O 2↑+(二)、待定系数法(适合陌生的化学方程式)例题 1:配平 aFeS +b O —Fe O + SO22223步骤: 1、设化合价改变的反应物的系数为a, b2、把假设的系数当作已知数,把其它物质的系数配好。



2.3 氧化还原反应教学设计(第一课时)一、教学目标1.了解从三种不同角度去理解氧化还原反应,了解四大基本反应与氧化还原反应的关系。
2.初步掌握根据化合价的变化的观点分析氧化还原反应的方法。
3.学会用化合价的变化判断氧化还原反应。
4.算握用电子转移的观点分析氧化还原反应。
二、重点难点重点:用化合价升降和电子转移的观点理解氧化还原反应。
难点:氧化还原反应的本质。
三、教学过程【问题一】请同学们根据初中所学基本反应类型,对下列化学反应进行分类,并写出它们的反应通式。
【学生活动】(3min)根据PPT展示完成表格,并让一位学生上黑板写。
【问题二】Fe2O3+3CO=2Fe+3CO2不属于四种基本反应类型中的任何一种,所以,四种基本反应类型的分类并不能包括所有的化学反应,今天我们就来学习一种新的化学反应——氧化还原反应。
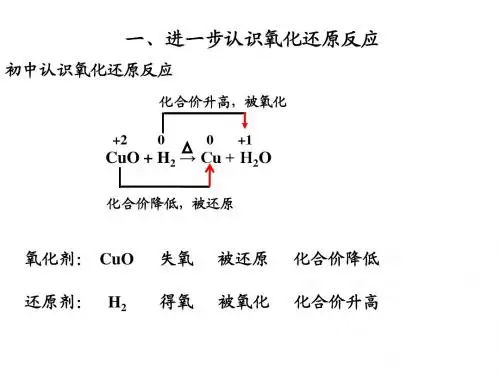
【问题三】初中将反应分为氧化反应和还原反应的标准是什么?(学生能够回忆出初中学过的氧化反应、还原反应)那以Fe2O3+3CO=2Fe+3CO2的反应为例,从得失氧角度分析该反应,从而得出氧化还原反应定义。
【回题四】为什么氧化反应和还原反应是同时发生的?学生通过讨论很容易发现还原反应与氧化反应是并存的,有得氧必有失氧,另从质量守恒定律解释同时发生的原因,并从得氧失氧角度归納出氧化还原反应的概念。
【问题五】请标出反应Fe2O3+3C0=2Fe+3CO2的各元素的化合价,观察化合价有无变化,变化有无规律?讨论氧化还原反应与元素化合价的升高、降低有什么关系?学生通过练习、观察不难发现物质所含元素化合价升高的反应是氧化反应,化合价降低的反应是还原反应。
那么我们可以把凡有元素化合价升降的化学反应定义为氧化还原反应。
紧接着让学生分析:CaCl2+Na2CO3=CaCO3+2NaCl,得出非氧化还原反应,并总结出氧化还原反应的基本特征和判断依据。
【问题六】氧化还原反应与四种基本反应类型有什么关系?通过练习不仅巩固了新学的氧化还原反应,而且还可总结出氧化还原反应与四种基本反应类型的关系,即:化合反应和分解分应有些是氧化还原反应,有些是非氧化还原反应,所有的置换反应都是氧化还原反应,所有的复分解反应都是非氧化还原反应。
氧化还原反应一、 氧化还原反应 氧化反应:化合价升高还原反应:化合价降低1、标志:化合价的变化2、本质:电子的转移3、 氧化剂(氧化性)——被还原——发生还原反应——化合价降低——得e ———得还原产物 还原剂(还原性)——被氧化——发生氧化反应——化合价升高——失e ———得氧化产物4、氧化剂、还原剂的判断(1)根据化合价判断最高价 —— 氧化性 中间价态 — 氧化性 + 还原性 最低价 —— 还原性(2)氧化剂: 活泼非金属(O 2、Cl 2等)、较高价态的化合物还原剂:活泼金属、H 2、C 、较低价态的化合物二、Fe 及化合物的性质1、Fe 3+的检验(1)颜色:浅黄色(2)+KSCN 溶液 —— 红色(3)+ NaOH 溶液 —— 红褐色沉淀 Fe 3+ + 3OH — = Fe(OH)3↓2、Fe 2+的检验(1)颜色:浅绿色(2) + NaOH 溶液 ——白色沉淀——灰绿色沉淀—— 红褐色沉淀Fe 2+ + 2OH — = Fe(OH)2↓ 4Fe(OH)2 + O 2 + 2H 2O = 4Fe(OH)3↓(3)+KSCN 溶液 —— 无现象——+ 氯水 ——红色3、Fe 的还原性(1)Fe → Fe 2+ 置换反应 方案: 将Fe 粉加入到稀H 2SO 4、CuSO 4溶液等Fe + H 2SO 4 = FeSO 4 +H 2↑ Fe + 2H + = Fe 2++H 2↑ Fe + CuSO 4 = FeSO 4 +Cu Fe + Cu 2+ = Fe 2+ + Cu (2)Fe → Fe 3+ 化合反应 ① 与O 2反应 4Fe + 3O 2 = 2Fe 2O 3② 与Cl 2反应 2Fe + 3Cl 2 = 2FeCl 30 +2 点燃 点燃 FeFe 2+ Fe 3+ 失e-,化合价升高,被氧化,发生氧化反应 -4、Fe 3+的氧化性(1)2 FeCl 3+Fe==3FeCl 2(溶液由黄色变为浅绿色)2 Fe 3+ + Fe==3Fe 2+ FeSO 4溶液中放Fe 钉子防止变质(2)使用FeCl 3溶液腐蚀铜箔刻蚀印刷线路板2Fe 3+ + Cu = 2Fe 2+ + Cu 2+5、 Fe 2+的氧化性和还原性(1)氧化性: Fe 2+ → Fe 如:FeCl 2溶液中加入锌粉,Mg 等Zn+ FeCl 2==ZnCl 2+Fe (有铁析出来) Zn + Fe 2+ = Fe + Zn 2+(2)还原性:Fe 2+ → Fe 3+ 如:往FeCl 2溶液中先加氯水再滴加硫氰酸钾溶液(KSCN )2FeCl 2+ Cl 2== 2FeCl 3 溶液由浅绿色变为黄色,溶液又变红色2Fe 2+ + Cl 2== 2Fe 3+ + 2Cl —- 失e- ,化合价升高, 发生氧化反应 +2 氧化剂2FeCl 3 + Cu ===== 2FeCl 2 + CuCl 2。