金属与酸反应图像题
- 格式:docx
- 大小:238.82 KB
- 文档页数:8


一、中考初中化学金属与酸反应的图像 1.如图表所示4个图象中,能正确反映变化关系的是A .足量镁和铝分别放入等质量、等浓度的稀盐酸中B .镁在空气中加热C .加热一定质量的高锰酸钾固体D .向一定质量的二氧化锰中加入过氧化氢溶液【答案】B【解析】【分析】【详解】A 、根据反应的化学方程式及其质量关系:22Mg+2HCl=24MgCl +3H 72↑,325421961872Al +6HCl =2AlCl +3H 32↑可知 ,足量的镁和铝分别放入等质量、等浓度的稀盐酸中,酸能完全反应,因此反应生成的氢气质量相同,产生相同质量的氢气,消耗镁的质量大于 铝的质量,图像不能正确反映变化关系,不符合题意;B 、镁与空气中的氧气反应生成氧化镁,根据质量守恒定律,反应物质量应该等于生成物质量,因此固体的质量不断增加,图像能正确反映变化关系,符合题意;C、高锰酸钾受热分解生成了锰酸钾、二氧化锰和氧气,固体的质量减小,锰元素的质量不变,因此固体中锰元素的质量分数应当增加,图像不能正确反映变化关系,不符合题意;D、向一定质量的二氧化锰中加入过氧化氢溶液,二氧化锰是该反应的催化剂,质量不变,图像不能正确反映变化关系,不符合题意。
故选B。
2.下列所示的四个图像,能正确反映对应变化关系的是A.向一定量的硝酸铜和硝酸镁的混合溶液中加入铁粉B.等质量的镁和铁分别与等质量、等浓度足量的稀硫酸反应C.向一定量的氢氧化钠溶液中滴加pH=3的稀盐酸D.向一定量的含有盐酸的氯化铜溶液中滴加氢氧化钠溶液【答案】B【解析】【分析】【详解】A、铁的金属活动性比铜强,比镁弱,向一定量的硝酸铜和硝酸镁的混合溶液中加入铁粉,铁不能与硝酸镁溶液反应,铁能与硝酸铜溶液反应生成硝酸亚铁溶液和铜,参加反应的铁的质量小于生成铜的质量,则溶液的质量应减少,故错误;B、等质量的镁和铁分别与等质量、等浓度足量的稀硫酸反应,横坐标是硫酸的量,故等量的硫酸产生氢气的质量相等,当金属全部参加反应,生成氢气的质量与金属的相对原子质量成反比(+2价的金属),则镁产生的氢气的质量大于铁,故正确;C、向一定量氢氧化钠溶液中滴加pH=3的稀盐酸,稀盐酸和氢氧化钠反应生成氯化钠和水,随着反应进行,溶液碱性减弱,pH减小,恰好完全反应时pH=7,继续加入稀盐酸时,溶液pH小于7,但是不能减小到3,更不能小于3,故错误;D、向含有盐酸的氯化铜溶液中滴加烧碱溶液时,氢氧化钠先和稀盐酸反应,后和氯化铜反应,因此开始不能产生沉淀,故错误。

金属与酸反响生成氢气图像问题的剖析方法:( 1)等质氢图:两种金属反响产生的氢气质量同样,此图反应两种状况:①酸不足,金属过虽,产生的氢气质量由酸的质量决定。
②酸足量,投放的两种金属与酸反响产生氢气的质量恰巧同样,如 6.5g 锌和5.6g 铁分别投入足量的盐酸中反响产生的氢气质量同样。
(2)等质等价金属图:如等质量的镁、铁、锌与足量的酸反响生成的金属离子都是 +2 价,产生氢气的速率和质量不一样。
此图反应出:①金属越开朗,图示反响物的线越陡,如 Mg线比 Zn 线陡 ,Zn 线比 Fe 线陡,说明开朗性 Mg>Zn>Fe②金属的相对原子质量越小。
等质量时,与酸反响产生的氢气越多,曲线的拐点越高,所以,相对原子质量 Zn >Fe>Mg。
可简单归纳为 : 越陡越活,越高越小。
(3)等质不等价金属图:铝、镁、锌与酸反响生成金属离子的化合价分别为 +3、+2、 +2,此图反应出等质不等价金属与酸反响不单速率不一样并且生成的氢气的质量与金属化合价有关。
可用下边式子计算氢气质量:利用化学方程式的简单计算:1.理论依照:所有化学反响均按照质量守恒定律,依据化学方程式计算的理论依照是质量守恒定律。
2.基本依照依据化学方程式计算的基本依照是化学方程式中各反响物、生成物之间的质量比为定值。
而在化学方程式中各物质的质量比在数值上等于各物质的相对分子质量与其化学计量数的乘积之比。
比如: 镁焚烧的化学方程式为2Mg+O2MgO,此中各物质的质量之比为,m(Mg):m(O2):n(MgO)=48:32:80=3:2:5。
有关化学方程式的计算:1.含杂质的计算,在实质生产和实验中绝对纯净的物质是不存在的,所以解题时把不纯的反响物换算成纯净物后才能进行化学方程式的计算,而计算出的纯净物也要换算成实质生产和实验中的不纯物。
这些协助性计算可依占有关公式进行即可。
2.代入化学方程式中进行计算的有关量 ( 往常指质量;一定需纯净的 ( 不包含未参加反响的质量 ) 。


一、中考初中化学金属与酸反应的图像 1.如图所示四个图像,分别对应四个过程,其中不正确的是A .向一定量的锌中加入足量的稀盐酸B .向一定量硫酸铜溶液中加入足量的铁C .足量锌、铁中分别加入等质量、等质量分数的稀硫酸D .等质量的锌和铁中分别加入足量等质量分数的稀硫酸【答案】B【解析】【分析】【详解】A 、向一定量的锌中加入足量的稀盐酸,锌完全反应后质量为0,不符合题意;B 、向一定量硫酸铜溶液中加入足量的铁,铁和硫酸铜反应生成硫酸亚铁和铜,44=Fe+CuSO FeSO +Cu ,每56g 固体铁加入置换出64g 铜单质,反应后固体质量增加,溶液的质量减小,反应完后不再减小,符合题意;C 、足量锌、铁中分别加入等质量、等质量分数的稀硫酸,锌的活动性强,在相同的时间内生成的氢气多,稀硫酸的质量相同,完全反应后生成的氢气相同,不符合题意;D 、等质量的锌和铁中分别加入足量等质量分数的稀硫酸,相同的酸反应,生成的氢气质量相同,根据反应方程式:22Zn+2HCl=ZnCl +H ↑22Fe+2HCl=FeCl +H ↑每生成2g 氢气需要锌的质量为65g ,需要铁的质量为56g ,等质量的锌和铁中分别加入足量等质量分数的稀硫酸,完全反应后,铁生成的氢气多,不符合题意。
故选B。
2.有质量相等的两种金属单质分别和质量相等、溶质质量分数也相等的稀盐酸反应,反应情况如图所示。
则下列情况中不可能存在的是A.盐酸均反应完,金属均有剩余B.有一种金属反应完,与此金属反应的盐酸有剩余C.曲线 a、b 分别表示锌、铁的反应情况或镁、铝的反应情况D.若两种金属是铁和铝,盐酸均反应完,铁也恰好完全反应,铝有剩余【答案】B【解析】【分析】【详解】A、根据图象可知,生成的氢气质量相等,所以参加反应的酸的质量相等,金属均可能有剩余,故正确;B、如果有一种金属反应完,与此金属反应的盐酸有剩余,等质量的两种与质量相等,溶质的质量分数也相等的稀盐酸反应生成的氢气质量不相等,故错误;C、根据反应情况曲线图,a曲线为活动性较大的金属,应表示金属锌与酸反应,b曲线则表示铁与酸的反应;镁在铝前,即镁的金属活动性比铝强,所以图线a、b分别表示镁、铝的反应情况,故正确;D、盐酸均反应完,因为稀盐酸相等,铁恰好完全反应,铝有剩余,所以生成的氢气相等,故正确。
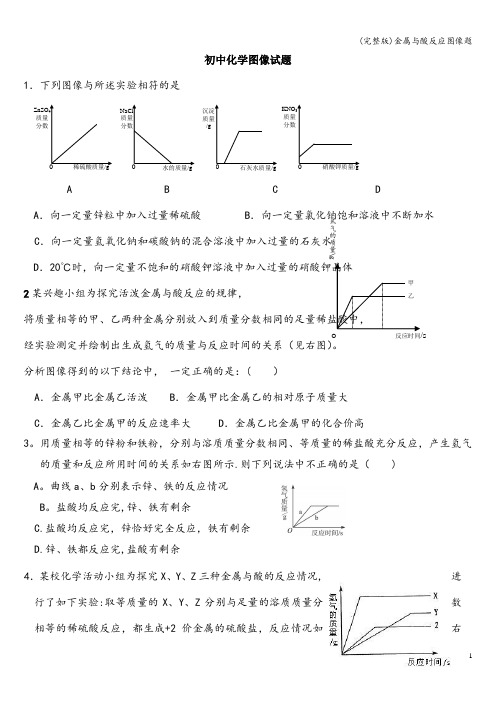
初中化学图像试题1.下列图像与所述实验相符的是A B C DA .向一定量锌粒中加入过量稀硫酸B .向一定量氯化钠饱和溶液中不断加水C .向一定量氢氧化钠和碳酸钠的混合溶液中加入过量的石灰水D .20℃时,向一定量不饱和的硝酸钾溶液中加入过量的硝酸钾晶体2某兴趣小组为探究活泼金属与酸反应的规律,将质量相等的甲、乙两种金属分别放入到质量分数相同的足量稀盐酸中,经实验测定并绘制出生成氢气的质量与反应时间的关系(见右图)。
分析图像得到的以下结论中, 一定正确的是:( )A .金属甲比金属乙活泼B .金属甲比金属乙的相对原子质量大C .金属乙比金属甲的反应速率大D .金属乙比金属甲的化合价高3。
用质量相等的锌粉和铁粉,分别与溶质质量分数相同、等质量的稀盐酸充分反应,产生氢气的质量和反应所用时间的关系如右图所示.则下列说法中不正确的是( ) A 。
曲线a 、b 分别表示锌、铁的反应情况 B 。
盐酸均反应完,锌、铁有剩余C.盐酸均反应完,锌恰好完全反应,铁有剩余D.锌、铁都反应完,盐酸有剩余4.某校化学活动小组为探究X 、Y 、Z 三种金属与酸的反应情况,进行了如下实验:取等质量的X 、Y 、Z 分别与足量的溶质质量分数相等的稀硫酸反应,都生成+2价金属的硫酸盐,反应情况如右稀硫酸质量/g0 ZnSO4质量 分数0 水的质量/g石灰水质量/g硝酸钾质量/gNaCl 质量 分数 沉淀 质量 /gKNO 3质量 分数氢气的质量\gO 反应时间/s甲乙tMgmAlmMg tAlAl mtMgtMg mAl图所示。
下列对该图象理解的叙述中,正确的是[相对原子质量Mg —24 Zn-65 Fe-56 Al-27 Na —23]A .金属活动性由强到弱:X 、Z 、YB .金属活动性由强到弱:X 、 Y 、ZC .X 、Y 、Z 依次可能是Mg 、Zn 、FeD .相对原子质量的大小:Z>Y 〉X 5.等质量的A 、B 两种金属,分别与质量分数相同的足量稀盐酸反应(已知,A 、B 在生成物中均为+2价),生成氢气的质量和反应时间的关系如图所示,则下列判断正确的是( )A .金属A 比金属B 活泼 B .相对原子质量:A 〉BC .A 、B 均消耗完时,所得溶液的质量均比反应前各自酸溶液的质量大D .A 、B 均消耗完时,产生氢气的质量:A 〈B6。
一、中考初中化学金属与酸反应的图像1.下列图像能正确反映其对应变化关系的是A .常温下,相同质量的锌和铁分别与足量的溶质质量分数相同的稀硫酸反应B .镁条在氧气中燃烧C .加热氯酸钾和二氧化锰的混合物D .用一氧化碳气体还原一定质量的氧化铁【答案】C【解析】【分析】【详解】A 、在金属活动性顺序中,锌的活动性强于铁,故锌的反应速率大于铁,根据化学反应方程式2442=F Fe+H SO SO +H e ↑2442=Z Zn+H SO SO +H n ↑,每生成2g 氢气,需要消耗的锌、铁的质量分布为65g 、56g ,所以相同质量的锌和铁分别与足量的溶质质量分数相同的稀硫酸,最终是铁产生的氢气的质量大于锌产生的氢气的质量,故选项错误;B 、镁燃烧生成氧化镁,随着反应的进行,固体质量不断增大,但是开始时固体质量不是0,故选项错误;C 、加热氯酸钾和二氧化锰的混合物制取氧气,反应中二氧化锰作催化剂,反应前后质量不变,故选项正确;D、一氧化碳气体还原一定质量的氧化铁粉末除了生成二氧化碳外还会生成一定质量的铁,最终固体的质量不会为0,故选项错误。
故选C。
2.如图所示曲线正确的是A.加热一定质量的高锰酸钾B.一定量的Fe加到AgNO3溶液中C.等质量的Mg和Zn分别加足量盐酸D.氢氧化钠溶液加水稀释【答案】C【解析】【分析】A 、加热一定质量的高锰酸钾,当加热一段时间,达到一定温度后,高锰酸钾才开始分解生成氧气,随着反应的进行,氧气质量逐渐增加,待高锰酸钾完全反应后,不再变化,故不是一开始就产生氧气,不符合题意;B 、一定量的Fe 加到AgNO 3溶液中,332=Fe Fe+2AgNO NO ()+2Ag ,56份的铁置换出216份的银,固体质量不断增加,待完全反应后,不再变化,不符合题意;C 、等质量的Mg 和Zn 分别加足量盐酸,镁与盐酸反应:22Mg+2HCl=MgCl +H ↑,锌与稀盐酸反应:22Zn+2HCl=ZnCl +H ↑,锌的相对原子质量大于镁,故最后,镁生成氢气的质量大,符合题意;D 、氢氧化钠溶液加水稀释,氢氧化钠浓度变小,pH 值逐渐减小至无限接近于7 ,但是不会小于7,不符合题意。
一、中考初中化学金属与酸反应的图像1.在两只烧杯中分别放入相同质量的镁、锌两种金属,然后向两只烧杯中分别倒入相同质量、相同质量分数的稀硫酸,反应产生氢气的质量与消耗硫酸的质量关系如图。
综合以上信息得到以下结论,合理的是A .从图象可以看出,金属镁比金属锌的活动性强B .若两种金属都有剩余,二者得到的氢气质量相同C .若硫酸有剩余,二者得到氢气的质量相同D .若两种金属完全溶解,二者消耗硫酸的质量相同【答案】B【解析】【分析】【详解】A 、图像体现的是产生氢气质量与消耗硫酸质量之间的关系,没有体现时间关系,无法比较镁、锌反应的速率,无法得出镁和锌的活动性强弱,说法错误;B 、若两种金属都有剩余,则消耗的硫酸质量相等,根据氢元素质量守恒,产生的氢气均来自硫酸中的氢元素,故二者得到的氢气质量相同,说法正确;C 、若硫酸有剩余,根据2442Mg H SO MgSO H 242+=+↑,2442Zn H SO ZnSO H 652+=+↑可知,相同质量的镁、锌产生氢气的质量为:镁>锌,说法错误;D 、若两种金属完全溶解,根据2442Mg H SO MgSO H 2498+=+↑,2442Zn H SO ZnSO H 6598+=+↑可知,相同质量的镁、锌与硫酸反应,消耗硫酸的质量为:镁>锌,说法错误。
故选:B 。
2.下列图像能正确反应其对应关系的是()A.向一定体积的稀硫酸中逐滴加入足量的氢氧化钠溶液B.向足量的镁和铁中加入等质量、等质量分数的稀硫酸C.向硫酸镁和硫酸的混合溶液中逐渐加入氢氧化钠溶液D.某温度下,向一定量饱和硝酸钾溶液中加入硝酸钾晶体【答案】B【解析】【详解】A、向一定体积的稀硫酸中逐滴加入足量的氢氧化钠溶液,pH应该是由小于7逐渐升高,直至等于或大于7,该选项对应关系不正确;B、向足量的镁和铁中加入等质量、等质量分数的稀硫酸,最终生成氢气质量相等,由于镁比铁活泼,反应需要时间短,该选项对应关系正确;C、向硫酸镁和硫酸的混合溶液中逐渐加入氢氧化钠溶液,氢氧化钠先和硫酸反应生成硫酸钠和水,后和硫酸镁反应生成氢氧化镁沉淀和硫酸钠,该选项对应关系不正确;D、某温度下,向一定量饱和硝酸钾溶液中加入硝酸钾晶体,硝酸钾不能溶解,溶质质量分数不变,该选项对应关系不正确。
金属与酸图像问题1.(1)向等质量的 Mg Al 、Zn 、Fe (金属表面氧化物均已除)的金属粉末中加入等质量等浓度且过量的稀 硫酸,产生氢气的质量随时间变化的曲线是()(2)等质量且过量的 Mg Al 、Zn 、Fe 四种金属粉末(金属表面氧化物已除)和等质量等浓度的稀硫酸反应, 将产生的氢气质量随时间的变化曲线是()3.. 在天平两盘上的烧杯中,各放入等质量等浓度且过量的稀硫酸, 调节天平至平衡。
分别向左右两边烧杯各加入等质量锌粉和铁粉 (表面氧化物均已除),完全反应后,天平的指针()A. 偏向加锌粉的一边B. 偏向加铁粉的一边C.仍停留在原来的位置D.无法确定4.. 在天平两盘上的烧杯中,各放入等质量等浓度的稀硫酸, 调节天平至平衡。
分别向左右两边烧杯各加入等质量且 过量的锌粉和铁粉(表面氧化物均已除),完全反应后,天平 的指针 () A. 偏向加锌粉的一边 B. 偏向加铁粉的一边C.仍停留在原来的位置D.无法确定5在已经调平的托盘天平两边各放一只等质量的烧杯,向烧杯中各加 入质量相等、质量分数相等的稀硫酸,然后在左右两盘的烧杯中分 别放入等质量的锌粉和铁粉(表面氧化物均已除)。
下列实验现象 可能观察到的是()A. 天平指针开始偏向放铁粉的烧杯一边 1--------- 去 -------- 1B. 只有铁粉有剩余C. 天平指针最终偏向放锌粉的烧杯一边D. 只有锌粉有剩余6 .在已调平的托盘天平两边各放一个等质量的烧杯,向烧杯中各注入质量相等、质量分数也相等的稀硫 酸。
然后在左盘的烧杯中投入一定质量的金属 X 粉末,同时在右盘的烧杯中放入与 X 等质量的金属 Y粉末。
观察到天平的指针先偏向右边,当两种金属全溶解后,天平的指针偏向左边。
则X 、Y 是下表组合中的()AB C D XFe Zn Zn Mg YMgMgFeZnIs爼%的城屋曲缸吒的Jfc锻宿/5问时P戟%的Jfis盘氢气的质吊孟氢气的M iM益氢气的质帖语7.某合金6g 与足量的稀硫酸充分反应后,如果生成0.2g 氢气,该合金中的元素可能是 ()A. Zn 和 FeB. Cu 和 AuC. Zn 和 CuD. Mg 和 Al9小宇同学在托盘天平两端的烧杯内,分别加入等质量、等质量分数的足量稀硫酸,调节天平至平衡。
然 后向两端烧杯内分别加入等质量的铁、铝铜合金,反应完毕后,天平仍保持平衡,则该合金中铝和铜 的质量比为() A . 9: 19 B . 19: 9C. 13: 1 D. 1: 1310.在天平的两个托盘里分别加入等质量的两只烧杯, 烧杯中各盛有100g9.8%的硫酸溶液,向两个烧杯中同时放入下列哪种物质,反应终止时,天平仍然保持平衡 A.锌、铁各7g B.锌、铁各5g C.锌、铁各4g D. 锌、铁各3g11. 在托盘天平两边各放一只等质量的烧杯,向两只烧杯中分别注入等质量、等质量分数的稀盐酸和稀硫酸,天平平衡,然后向左、右两烧杯中 分别投入等质量的锌和铁(如图).等充分反应后,发现两烧杯中金属均 有剩 余。
则 天 平 指针一定指 向 稀硫酸反应,下列叙述正确的是 ()A. x 表示反应所用时间,y 表示生成氢气的质量B. x 表示生成氢气的质量,y 表示反应所用时间C. x 表示滴加稀硫酸的质量, y 表示生成氢气的质量D. x 表示参加反应的金属的质量, y 表示生成氢气的质量2某兴趣小组为探究活泼金属与酸反应的规律,将质量相等的甲、乙 两种金属分别放入到质量分数相同的足量稀盐酸中,经实验测定并绘制出生成氢气的质量与反应时间的关系(见右图) 分析图像得到的以下结论中, 一定正确的是:()A. 金属甲比金属乙活泼B. 金属甲比金属乙的相对原子质量大C. 金属乙比金属甲的反应速率大D. 金属乙比金属甲的化合价高3.用质量相等的锌粉和铁粉,分别与溶质质量分数相同、等质量的稀盐酸充分反应, 产生氢气的质量和反应所用时间的关系如右图所示。
则下列说法中不正确的是 (A. 曲线a 、b 分别表示锌、铁的反应情况B. 盐酸均反应完,锌、铁有剩余C. 盐酸均反应完,锌恰好完全反应,铁有剩余D. 锌、铁都反应完,盐酸有剩余 4•某校化学活动小组为探究 X 、Y 、Z 三种金属与酸的反应情况,进行了如下实验:分别与足量的溶质质量分数相等的稀硫酸反应,都生成 +2价金属的硫酸盐,反 应情况如右图所示。
下列对该图象理解的叙述中,正确的是[相对原子质量 Mg-24Zn-65 Fe-56 AI-27 Na-23] A.金属活动性由强到弱: X 、Z 、YB. 金属活动性由强到弱:X 、Y 、ZC. X 、Y 、Z 依次可能是 Mg Zn 、Fe()A .分度盘的中央B .右C.左 D 12.如图表示等质量的金属.无法确定Mg 和Al 分别与足量且质量分数相等的—甲D. 相对原子质量的大小:Z>Y>XX 、Y 、Z反应时间人反应时间/S反应时測/S5.等质量的A、B两种金属,分别与质量分数相同的足量稀盐酸反应生成氢气的质量和反应时间的关系如图所示,则下列判断正确的是(A. 金属A比金属B活泼B. 相对原子质量:A>BC. A、B均消耗完时,所得溶液的质量均比反应前各自酸溶液的质量大D. A、B均消耗完时,产生氢气的质量:A<B(已知,A B在生成物中均为+2价),)6.用相同质量的锌和铁分别跟足量稀盐酸反应,成氢气的质量),其中符合实际的是反应情况见图(横坐标t表示反应时间,纵坐标m表示生7、室温下,的是(等质量的镁片和铝片分别与足量的稀硫酸反应,产生氢气的质量)D(m)与时间⑴的关系图正确C8.某研究性学习小组的同学为探究实验室制取氢气的方案,分别用等质量的金属质量分数相同的稀硫酸反应,不合理的是(已知原子质量不等)(反应速率A> B 生成氢气的质量反应生成氢气的质量与时间的关系如下图所示。
A B在生成物中均显+2价,A、B的相对)A、B跟质量相同、溶质分析图象得到的下列结论中,A.B.C.D.A=B金属的活动性A< BA、B均反应完,硫酸有剩余9、等质量的M N两种金属,分别与相同质量分数的足量稀盐酸反应(已知生成氢气质量和反应时间的关系如右图所示,下列叙述正确的是(A. M N两种金属中较活泼的是N B .生成C.相对原子质量较大的是N D •产生10. 下列图象正确反映对应的变化关系的是(A.B.C.D.一定量的稀硫酸与锌粒反应t C时,向饱和硝酸钾溶液中加入硝酸钾晶体向一定量的过氧化氢溶液中加入少量二氧化锰将足量碳酸镁和氧化镁固体分别加入相同质量、AH的质量M< NH的速率N> M)相同质量分数的稀盐酸中M11 •将相同体积、相同溶质质量分数的稀盐酸,分别滴到等质量、颗粒大小相同的属中,生成H2的质量与反应时间的关系如右图所示。
下列说法中正确的是(A. 三种金属的活动性顺序为Y>X>ZB. 产生氢气的速率顺序为X > Y> ZC. 消耗稀盐酸的质量顺序为Z> Y> XD. 相对原子质量由大到小的顺序为X > Y> ZX、Y、Z三种较活泼金12.等质量的三种金属A、B C和相同溶质质量分数的足量的稀硫酸反应,都生成了+2价的金属硫酸盐,其反应情况如图所示。
依图可知三种金属的活动性顺序是________ ,它们相对原子质量大小的顺序是 ______________13用相同质量的铁和锌跟一定量的稀硫酸反应,其反应过程如右图所示。
试回答:①曲线A表示的是_________ (填“铁”或“锌”)跟稀硫酸反应的情况。
②上述曲线图除能说明①的结论外,还可得出的结论是(答一条)______ _______________ _______________ 。
14.现有等质量甲、乙、丙三种金属,同时放入三份溶质质量分数相同、体积相同的稀硫酸中,甲、乙、丙产生氢气的质量如右图所示(已知甲、乙、丙在生成物中均为+2价)。
写出下列结论中,甲、乙、丙的正确顺序。
①金属活动性顺序___________________________________ ;②相对原子质量___________________________________ 。
珂的质量A反应时间/;甲乙丙15.把相同体积、相同质量分数的稀盐酸,分别滴到等质量、颗粒大小相同的X、Y、Z三种较活泼金属中,生成H2的质量与反应时间的关系如右图所示。
这三种金属的活动性顺序为_____________________________ ;假如X、Y、Z都是+2价金属,则相对原子质量由大到小的顺序为________________ 。
Hal16.等质量的三种不同金属a、b、c分别和足量的溶质质量分数相同的稀硫酸反应,都生成相同价态硫酸盐,其反应情况如图所示。
回答:(1)三种金属的活动顺序由强到弱的是_________________________(2) 三种金属的相对原子质量由大到小的顺序是(3)若b代表铁,写出它跟稀硫酸反应的化学方程式22. 现有铜与金属镁、铁、锌中的一种组成的混合物,现欲测定其组成。
【查阅资料】镁、铁、锌皆能与稀硫酸发生置换反应,且生成+2价的可溶性金属化合物和氢气。
【实验步骤及数据】取该混合物粉末8.0 g放入烧杯中,将140.0 g 绒织的质量分数为14.0 %的稀硫酸平均分四次加入该烧杯中,充分反应后,测得剩余固体质量数据记录如图:通过计算(写出计算过程),求:(1) 该混合物粉末中铜的质量分数?(2) 第三次加入硫酸充分反应后,所得溶液中溶质的质量分数是多少23. 为探究一种混合物是由铜粉与镁粉、铁粉、锌粉中的哪一种金属组成。
某同学进行了如下实验:称量8.0 g该混合物粉末放入烧杯中T将140 g 14 %的稀硫酸平均分成四份依次加入该烧杯中T充分反应后测定剩余固体质量—数据处理:将测得剩余固体质量与加入稀硫酸的质量关系绘制成右图。
试计算:⑴该混合物是由铜粉和—__ 组成的。
⑵加入105 g稀硫酸充分反应后,所得溶液的25.现有铜与另一种金属的混合物粉末,另一种金属可能是镁、铁、锌中的一种,现欲测定其组成。
【实验步骤及数据】取该混合物粉末8.0g放入烧杯中,将140.0g 14.0 %的稀硫酸分四次加入到该烧杯中, 充分反应后,测得剩余固体质量的数据记录如下:次数1234加入稀硫酸的质量/ g35.035.035.035.0剩余固体的质量/ g 6.8 5.6 4.4 4.2通过计算(写出计算过程,结果精确到0.1%),求:(1)该混合物粉末中铜的质量分数?(2)该混合物粉末中另一金属为何种金属?(3)第三次加入硫酸充分反应后,所得溶液中溶质的质量分数是多少Welcome !!! 欢迎您的下载, 资料仅供参考!。