金属与酸反应图像题分析
- 格式:doc
- 大小:476.00 KB
- 文档页数:3



微专题11金属与酸、盐溶液反应的图像分析1.(2022·山东济宁·中考真题)相同质量的镁、铁、锌三种金属,分别与足量的、相同质量分数的稀硫酸充分反应,生成氢气质量与反应时间关系见如图,分析图像判断,下面说法正确的是A.金属锌反应速率最大B.金属锌的活动性最强C.金属镁生成氢气质量最多D.金属铁消耗稀硫酸质量最多【答案】C【解析】三种金属的活动性由强到弱是镁>锌>铁,质量相同的三种金属与足量酸反应理论上产生氢气由多到少是镁>铁>锌。
A、图中可以看到,金属镁与酸反应产生氢气的质量上升是最快的,所以金属镁反应速率最大,A 错误,不符合题意;B、镁反应速率最大,金属活动性最强,B 错误,不符合题意;C、图中可知,金属镁产生氢气的质量最高,生成的氢气质量最多,C 正确,符合题意;D、产生的氢气中氢元素全部来自于稀硫酸,产生的氢气越多,消耗的稀硫酸质量越多,镁应该是消耗稀硫酸质量最多的金属,D 错误,不符合题意。
故选:C。
2.(2022·湖南怀化·统考中考真题)现有质量相等的X、Y、Z 三种金属,分别放入三份溶质质量分数相等的足量稀硫酸中,X 不发生反应,Y、Z 在生成物中均显+2价,Y、Z 反应生成氢气的质量与反应时间的关系如图所示,则下列说法正确的是突破一、金属与酸反应A.X、Y、Z 的金属活动性顺序为:Y>Z>XB.相对原子质量:Y>ZC.完全反应生成氢气的质量:Y<ZD.Y 与H 2SO 4反应的化学方程式为:2442Y+H SO YSO +H ↑=【答案】D【解析】A.排在氢前面的金属可以和酸反应生成氢气;活动性越强的金属与酸反应越剧烈,即反应放出氢气的速度越快;X 不发生反应,则X 活动性最弱;由图可知,Z 反应速率最快,则Z 最活泼,X、Y、Z 的金属活动性顺序为:Z>Y >X,错误;B.一定量金属与足量酸完全反应时,产生氢气质量=⨯金属质量金属的相对金原子质量属化合价;Y、Z 在生成物中均显+2价,且Y 生成氢气质量大,则相对原子质量:Y<Z,错误;C.由图可知,完全反应生成氢气的质量:Y>Z,错误;D.Y、Z 在生成物中均显+2价,则Y 与H 2SO 4反应的化学方程式为:2442Y+H SO YSO +H ↑=,正确;故选D。



一、中考初中化学金属与酸反应的图像1.向一定量的稀盐酸中,分别加入足量的水、金属铁、氢氧化钙溶液、硝酸银溶液,下列图示正确的是A.B.C.D.【答案】D【解析】【分析】铁和稀盐酸反应生成氯化亚铁和氢气,稀盐酸和氢氧化钙反应生成氯化钙和水,稀盐酸和硝酸银反应生成氯化银和硝酸。
【详解】A、向一定量的稀盐酸中加入足量的水时,酸性减弱,pH升高,但不会变成中性或碱性,pH只会接近7,故A不正确;B、活泼金属和酸接触就会放出氢气,铁和稀盐酸反应生成氯化亚铁和氢气,起点应该从零开始,故B不正确;C、一定量的稀盐酸和氢氧化钙反应生成氯化钙和水,随着反应的进行,溶液的质量增加,反应完全后溶液质量不变,故C不正确;D、稀盐酸和硝酸银反应生成氯化银和硝酸,随着反应的进行,沉淀的质量增加,反应完全,质量不变,故D正确。
故选D。
2.如图表所示4个图象中,能正确反映变化关系的是A.足量镁和铝分别放入等质量、等浓度的稀盐酸中B.镁在空气中加热C .加热一定质量的高锰酸钾固体D .向一定质量的二氧化锰中加入过氧化氢溶液【答案】B【解析】【分析】【详解】A 、根据反应的化学方程式及其质量关系:22Mg+2HCl=24MgCl +3H 72↑,325421961872Al +6HCl =2AlCl +3H 32↑可知 ,足量的镁和铝分别放入等质量、等浓度的稀盐酸中,酸能完全反应,因此反应生成的氢气质量相同,产生相同质量的氢气,消耗镁的质量大于 铝的质量,图像不能正确反映变化关系,不符合题意;B 、镁与空气中的氧气反应生成氧化镁,根据质量守恒定律,反应物质量应该等于生成物质量,因此固体的质量不断增加,图像能正确反映变化关系,符合题意;C 、高锰酸钾受热分解生成了锰酸钾、二氧化锰和氧气,固体的质量减小,锰元素的质量不变,因此固体中锰元素的质量分数应当增加,图像不能正确反映变化关系,不符合题意;D 、向一定质量的二氧化锰中加入过氧化氢溶液,二氧化锰是该反应的催化剂,质量不变,图像不能正确反映变化关系,不符合题意。
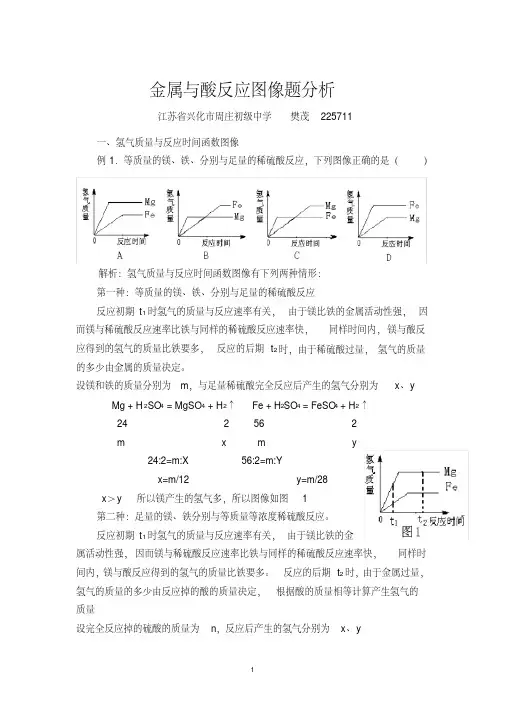
金属与酸反应图像题分析江苏省兴化市周庄初级中学樊茂225711一、氢气质量与反应时间函数图像例1.等质量的镁、铁、分别与足量的稀硫酸反应,下列图像正确的是()解析:氢气质量与反应时间函数图像有下列两种情形:第一种:等质量的镁、铁、分别与足量的稀硫酸反应反应初期t1时氢气的质量与反应速率有关,由于镁比铁的金属活动性强,因而镁与稀硫酸反应速率比铁与同样的稀硫酸反应速率快,同样时间内,镁与酸反应得到的氢气的质量比铁要多,反应的后期t2时,由于稀硫酸过量,氢气的质量的多少由金属的质量决定。
设镁和铁的质量分别为m,与足量稀硫酸完全反应后产生的氢气分别为x、y Mg + H2SO4 = MgSO4 + H2↑Fe + H2SO4 = FeSO4 + H2↑24 2 56 2m x m y24:2=m:X 56:2=m:Yx=m/12 y=m/28x>y 所以镁产生的氢气多,所以图像如图 1第二种:足量的镁、铁分别与等质量等浓度稀硫酸反应。
反应初期t1时氢气的质量与反应速率有关,由于镁比铁的金属活动性强,因而镁与稀硫酸反应速率比铁与同样的稀硫酸反应速率快,同样时间内,镁与酸反应得到的氢气的质量比铁要多。
反应的后期t2时,由于金属过量,氢气的质量的多少由反应掉的酸的质量决定,根据酸的质量相等计算产生氢气的质量设完全反应掉的硫酸的质量为n,反应后产生的氢气分别为x、yMg + H2SO4 = MgSO4 + H2↑Fe + H2SO4 = FeSO4 + H2↑98 2 98 2n x n y98:2=n:X 98:2=n:Yx=m/49 y=m/49x=y,反应后生成的氢气质量相等。
此时的图像为图 2就本题,根据题意,显然是第一种情形,因而答案选 A二、氢气质量与加入酸质量之间的函数图像例2.下列实验过程与图象描述相符合的一组是()解析:对于答案B,该图像是反映加入稀硫酸质量与氢气质量之间的函数关系,在初始阶段m1时,代表向金属里加入少量的稀硫酸,因而此时,金属过量,加入的酸全部反应,用酸的质量去计算氢气质量,酸相等,所以产生的氢气也相等。


一、中考初中化学金属与酸反应的图像 1.如图表所示4个图象中,能正确反映变化关系的是A .足量镁和铝分别放入等质量、等浓度的稀盐酸中B .镁在空气中加热C .加热一定质量的高锰酸钾固体D .向一定质量的二氧化锰中加入过氧化氢溶液【答案】B【解析】【分析】【详解】A 、根据反应的化学方程式及其质量关系:22Mg+2HCl=24MgCl +3H 72↑,325421961872Al +6HCl =2AlCl +3H 32↑可知 ,足量的镁和铝分别放入等质量、等浓度的稀盐酸中,酸能完全反应,因此反应生成的氢气质量相同,产生相同质量的氢气,消耗镁的质量大于 铝的质量,图像不能正确反映变化关系,不符合题意;B 、镁与空气中的氧气反应生成氧化镁,根据质量守恒定律,反应物质量应该等于生成物质量,因此固体的质量不断增加,图像能正确反映变化关系,符合题意;C、高锰酸钾受热分解生成了锰酸钾、二氧化锰和氧气,固体的质量减小,锰元素的质量不变,因此固体中锰元素的质量分数应当增加,图像不能正确反映变化关系,不符合题意;D、向一定质量的二氧化锰中加入过氧化氢溶液,二氧化锰是该反应的催化剂,质量不变,图像不能正确反映变化关系,不符合题意。
故选B。
2.下列所示的四个图像,能正确反映对应变化关系的是A.向一定量的硝酸铜和硝酸镁的混合溶液中加入铁粉B.等质量的镁和铁分别与等质量、等浓度足量的稀硫酸反应C.向一定量的氢氧化钠溶液中滴加pH=3的稀盐酸D.向一定量的含有盐酸的氯化铜溶液中滴加氢氧化钠溶液【答案】B【解析】【分析】【详解】A、铁的金属活动性比铜强,比镁弱,向一定量的硝酸铜和硝酸镁的混合溶液中加入铁粉,铁不能与硝酸镁溶液反应,铁能与硝酸铜溶液反应生成硝酸亚铁溶液和铜,参加反应的铁的质量小于生成铜的质量,则溶液的质量应减少,故错误;B、等质量的镁和铁分别与等质量、等浓度足量的稀硫酸反应,横坐标是硫酸的量,故等量的硫酸产生氢气的质量相等,当金属全部参加反应,生成氢气的质量与金属的相对原子质量成反比(+2价的金属),则镁产生的氢气的质量大于铁,故正确;C、向一定量氢氧化钠溶液中滴加pH=3的稀盐酸,稀盐酸和氢氧化钠反应生成氯化钠和水,随着反应进行,溶液碱性减弱,pH减小,恰好完全反应时pH=7,继续加入稀盐酸时,溶液pH小于7,但是不能减小到3,更不能小于3,故错误;D、向含有盐酸的氯化铜溶液中滴加烧碱溶液时,氢氧化钠先和稀盐酸反应,后和氯化铜反应,因此开始不能产生沉淀,故错误。

中考化学一轮复习专题:金属与酸反应的图像问题金属与酸反应的图像问题是近年来各省市中考试卷中高频率出现,这类试题综合性较强,对学生的思维能力要求较高,涉及到金属的化学活动性、金属的相对原子质量、氢气的质量、溶液的质量、溶质质量分数等知识点。
中考中常考的金属与酸反应的图像问题可以分为两类 :①等量的金属分别和足量的酸反应:即酸过量(足量)②等量的酸分别和足量的金属反应:酸不足(金属过量)在初中化学中常考察的金属只有四个:镁(Mg)、铁(Fe)、锌(Zn)、铝(Al)解题技巧:①首先要判断金属和酸的过量少量情况,一般通过题干中“少量”,“足量”,“过量”等字眼。
而反应中最终产生氢气的多少是由反应物中少量的那个量决定的。
②在讨论金属与酸反应的图像问题时,一定要分清图像中横坐标和纵坐标所表示的具体含义,一般纵坐标是产生氢气的量;而横坐标通常会出现两种情况:(1)时间/s;(2)消耗酸的质量/g 或消耗金属的质量/g.③两种或多种金属与稀酸反应时,反应的快慢(即相同时间内产生氢气的多少)由金属的活动性决定,在温度、金属颗粒大小和稀酸溶液溶质质量分数一定的条件下,金属的活动性越强,生成氢气就越快;生成氢气越快,说明金属的活动性就越强。
④等质量的金属与足量的稀酸反应时,产生氢气的最大量由金属决定,通过化学方程式可以得出:当金属的化合价相同时,对于相同质量的金属,金属的相对原子质量越大,生成的氢气越少;生成的氢气越多,金属的相对原子质量越小。
⑤两种或多种等质量的金属与足量的稀酸反应时,当有部分金属过量时,一定是相对原子质量小的(化合价相等时,这里Al 可以等效成18)金属过量,而相对原子质量大的金属先反应完。
(1)横坐标为反应时间相同质量的Mg,Al,Zn,Fe分别跟足量的等质量等浓度的同种酸反应:①反应速率关系是:Mg>Al>Zn>Fe②最终产生氢气的质量关系是:Al>Mg>Fe>Zn(2)横坐标为酸的质量相同质量的Mg,Al,Zn,Fe分别跟足量的等质量等浓度盐酸反应:金属均完全反应后,最终产生氢气的质量关系是:Al>Mg>Fe>Zn(1)横坐标为反应时间等质量等浓度的同种酸和足量的Mg,Al,Zn,Fe分别充分反应:①产生氢气的反应速率关系:Mg>Al>Zn>Fe②最终产生氢气的质量关系是:Mg=Al=Zn=Fe(2)横坐标为金属的质量等质量等浓度的同种酸和足量的Mg,Al,Zn,Fe分别充分反应:最终产生氢气的质量关系是:Mg=Al=Zn=Fe中考化学一轮复习专题:金属与酸反应的图像问题1.(2020.济宁)在两只烧杯中分别放入相同质量的镁、锌两种金属,然后向两只烧杯中分别倒入相同质量、相同质量分数的稀硫酸,反应产生氢气的质量与消耗硫酸的质量关系如图。

一、中考初中化学金属与酸反应的图像 1.如图所示四个图像,分别对应四个过程,其中不正确的是A .向一定量的锌中加入足量的稀盐酸B .向一定量硫酸铜溶液中加入足量的铁C .足量锌、铁中分别加入等质量、等质量分数的稀硫酸D .等质量的锌和铁中分别加入足量等质量分数的稀硫酸【答案】B【解析】【分析】【详解】A 、向一定量的锌中加入足量的稀盐酸,锌完全反应后质量为0,不符合题意;B 、向一定量硫酸铜溶液中加入足量的铁,铁和硫酸铜反应生成硫酸亚铁和铜,44=Fe+CuSO FeSO +Cu ,每56g 固体铁加入置换出64g 铜单质,反应后固体质量增加,溶液的质量减小,反应完后不再减小,符合题意;C 、足量锌、铁中分别加入等质量、等质量分数的稀硫酸,锌的活动性强,在相同的时间内生成的氢气多,稀硫酸的质量相同,完全反应后生成的氢气相同,不符合题意;D 、等质量的锌和铁中分别加入足量等质量分数的稀硫酸,相同的酸反应,生成的氢气质量相同,根据反应方程式:22Zn+2HCl=ZnCl +H ↑22Fe+2HCl=FeCl +H ↑每生成2g 氢气需要锌的质量为65g ,需要铁的质量为56g ,等质量的锌和铁中分别加入足量等质量分数的稀硫酸,完全反应后,铁生成的氢气多,不符合题意。
故选B。
2.下列图像与对应的说法正确的是A.向NaOH溶液中加水稀释B.等质量的Al、Zn与足量的稀硫酸反应C.向稀硫酸中加入Ba(OH)2溶液D.在恒温的条件下,适量蒸发饱和NaCl溶液的水分【答案】C【解析】【分析】【详解】A.向氢氧化钠溶液加水稀释,溶液一开始呈碱性,pH>7,加水稀释后,碱性减弱,pH逐渐减小,但也不会呈酸性,故A错误;B.金属活动顺序中,Al比Zn活泼,与酸反应速率Al比Zn快,在图像中表现应为Al的斜线倾斜率大于Zn的斜线倾斜率,故B错误;C. H2SO4+Ba(NO3)2=2HNO3+BaSO4↓,二者完全反应后,Ba(NO3)2溶液过量后,就不会产生BaSO4沉淀,故C正确;D.在恒温下,饱和溶液溶质质量分数不变,故D错误。
化学⼲货⾦属与酸反应的图象问题⾦属与酸溶液反应这⼀知识点的出现,通常是考查同学们对⽣成氢⽓的快慢和多少的掌握情况,往往还会与图象联系在⼀起,因此,图象题的学习是第⼋章的重点。
我们来分析⼀下Mg、Al、Zn、Fe四种⾦属与酸反应的图象问题。
//⾸先,复习⼀下常见⾦属在溶液中的活动性顺序在⾦属活动性顺序⾥,⾦属的位置越靠前,它的活动性就越强。
在⾦属活动性顺序⾥,位于氢前⾯的⾦属能置换出盐酸、稀硫酸中的氢。
在⾦属活动性顺序⾥,位于前⾯的⾦属能把位于后⾯的⾦属从它们化合物的溶液⾥置换出来。
//我们在做图象题时要注意的⼏点内容:⾸先要注意横坐标和纵坐标的物理意义。
其次要注意特殊点的含义,例如起始点、转折点。
最后要注意曲线的趋势的含义。
1等量⾦属和⾜量酸的反应(1)横坐标表⽰时间,纵坐标表⽰⽣成氢⽓的质量图1如图1所⽰,当⾦属与稀盐酸溶液反应时,随着反应的进⾏,⽣成氢⽓的质量越来越多,此时在图象上表现为从O发出的⼀条上升的直线,且⽣成氢⽓越快,这条直线的倾斜程度越⼤。
横坐标表⽰时间,直线的倾斜程度只需看⾦属活动性,倾斜程度即坡陡坡缓,“坡越陡”表⽰⽣成氢⽓越快,“坡越缓”表⽰⽣成氢⽓越慢。
当⾦属与稀酸溶液充分反应后,⽣成氢⽓的质量将不再发⽣变化,此后在图象上表现为⼀条⽔平直线。
⽣成氢⽓越多,⽔平直线在图像上就越⾼。
因此,从图象上看⽣成氢⽓的多少,只需看直线的⾼度,即线⾼线低,“线越⾼”表⽰⽣成的氢⽓越多,“线越低”表⽰⽣成的氢⽓越少。
通过上图,我们可以得出的结论是:产⽣H₂由快到慢的顺序为:Mg>Al>Zn>Fe产⽣H₂由多到少的顺序为:Al>Mg>Fe>Zn//(2)横坐标表⽰⾦属的质量,纵坐标表⽰⽣成氢⽓的质量向⾜量的酸中逐渐加⼊⾦属,所加的⾦属能够完全反应,所以得到的图象为从O发出的射线。
由以上分析可知,等质量的⾦属产⽣的氢⽓由多到少的顺序为Al、Mg、Fe、Zn,因此⽣成氢⽓质量随加⼊⾦属质量的变化图象如图2所⽰。
金属与酸反应图像分析1、二标三点认清横、纵座标,仔细判断起点、拐点、终点!2、四口诀:①越活越陡;②等酸等氢;③越小越多;④上多下少。
(不懂或忘记的,请咨询老师并做好笔记!)例1.锌和稀硫酸反应生成氢气,几次实验的锌的用量不等,但稀硫酸的用量相同。
锌的用量(X轴),生在氢气的体积(Y轴)(在同温同压下测定)关系如图2,下列关于实验结果描述错误的是(??? )?A.线段AB(包括A点)表示锌过量、硫酸已耗尽?B.线段AB(不包括A点)表示锌过量、硫酸已耗尽?C.线段OA(包括A点)表示锌和过量的硫酸反应?D.线段OA(不包括A点)表示锌和过量的硫酸反应解析:一定质量的锌与足量的稀硫酸充分反应,图2中A点表示某一时刻,反应刚好停止。
线段OA (包括点A)表示金属和过量的稀硫酸反应。
线段AB(不包括点A)表示金属已经反应完,而稀硫酸过量。
不过,值得我们注意的是,如果是足量的锌与一定量的稀硫酸充分反应时,那么线段OA (包括点A)则表示过量的金属和稀硫酸反应。
线段AB(不包括点A)表示稀硫酸已经消耗完,而锌过量。
解答:B 、D【练】将物质的量相等的铝粉和铁粉分别与同体积、同浓度的稀硫酸反应。
反应情况如图5所示。
有关叙述中正确的是( ????)A .铝粉、铁粉和硫酸均有剩余B .铝粉、铁粉均反应完,硫酸有剩余C .硫酸、铝粉均反应完,铁粉有剩余D .硫酸、铁粉均反应完,铝粉有剩余分析:Na Mg Al Fe Zn Cu 等金属平均每产生1g 氢气时消耗的质量为:23231=、24122=、2793=、56282=、6532.52=、∞(无穷)。
消耗等量酸,产生等量氢气时,消耗的金属质量大小依次:Zn>Fe>Na>Mg>Al 。
故本题投入等质量铁、铝后,可能剩余的是铝。
【练】?1、 将等质量的镁、铁、锌,分别放入三份溶质质量分数相同的稀盐酸中,反应生成的H 2质量与反应时间的关系如图所示。
金属及酸反应生成氢气图像问题的分析方法一、引言金属与酸反应生成氢气是化学实验中常见的现象,也是相关研究中的重要问题。
本文旨在探讨金属与酸反应生成氢气的图像问题,并提出相应的分析方法。
二、背景金属与酸反应生成氢气的过程可以用以下方程式表示:金属 + 酸→ 相应金属盐 + 氢气↑三、图像问题的分析方法1. 实验条件的确定在进行金属与酸反应生成氢气的实验时,需要确定实验条件,包括所使用的金属、酸的浓度和温度等。
这些条件会直接影响氢气的生成速率和产量。
可以通过调整实验条件,观察氢气生成的图像变化,进而分析图像问题。
2. 观察氢气生成的时间变化在实验过程中,可以记录金属与酸反应生成氢气的时间变化。
通过观察氢气生成的速率和产量随时间的变化,可以分析金属与酸反应生成氢气的图像问题。
例如,可以记录氢气开始生成的时间点、氢气生成的速率是否逐渐增加或减少等。
3. 分析氢气生成的量变化可以通过实验测定氢气的产量,进一步分析金属与酸反应生成氢气的图像问题。
例如,可以通过收集氢气并测量其体积或质量的变化,得出氢气生成的量变化曲线。
通过分析曲线的形状和趋势,可以得到关于金属与酸反应生成氢气的图像信息。
4. 对比不同金属和酸的反应可以选择不同的金属和酸进行实验,对比它们生成氢气的图像差异。
通过对比分析,可以发现不同金属和酸的反应特点,进一步揭示金属与酸反应生成氢气的图像问题。
5. 使用实验装置记录氢气生成过程可以设计实验装置,使用实时记录设备记录金属与酸反应生成氢气的过程。
通过观察实时记录的图像,可以更直观地分析金属与酸反应生成氢气的图像问题。
例如,可以使用摄像机记录实验过程,然后通过回放视频进行分析。
四、实验结果与讨论根据以上分析方法,我们可以得到金属与酸反应生成氢气的图像问题的详细数据和分析结果。
通过实验结果和讨论,可以得出结论,进一步探讨金属与酸反应生成氢气的机理和规律。
五、结论金属与酸反应生成氢气的图像问题是一个重要的研究课题。
金属与酸、盐溶液反应坐标图像一、金属与酸反应金属与酸反应,生成的氢气的质量=参与反应的金属的质量×化合价/相对原子质量1. 横坐标表示反应时间(1)等质量的不同金属分别和足量的等体积、等浓度的酸反应(图1)(图1)分析:①酸足量,金属被消耗完,最终生成氢气的质量要依据______的质量来计算。
②金属的相对原子质量越小(金属铝等效成+2价,相对原子质量等效成18),最终生成的氢气的质量越________(选填“多”或“少”)。
(2)足量的不同金属分别与等体积、等浓度的酸反应(图2)(图2)分析:①金属足量,酸被消耗完,最终生成氢气的质量要依据____的质量来计算。
②金属的相对原子质量越小,最终消耗的金属质量越_____(选填“多”或“少”)。
(3)同种金属与等质量、不同浓度的酸反应(图3、4)(图3)(图4)分析:①酸的浓度越大,反应速率越________(选填“快”或“慢”)。
②当金属量不足时,最终生成的氢气的质量:浓度大的酸______ _(选填“>”“<”或“=”,下同)浓度小的酸;当金属足量时,最终生成的氢气的质量:浓度大的酸________浓度小的酸。
2. 横坐标表示酸的质量以向等质量的铝、镁、铁中分别加入等浓度的稀盐酸为例(图5)(图5)分析:①当酸的质量≤m时,产生氢气的质量________(选填“相等”或“不相等”)。
②随着稀盐酸的不断滴加,稀盐酸过量,金属的量不足,产生氢气的质量由金属的质量决定,图5中表示镁与稀盐酸反应的曲线是________(填序号)。
3. 横坐标表示金属的质量等质量的不同金属分别与等体积、等质量分数的酸反应(图6)(图6)分析:①金属足量,酸被消耗完,最终生成氢气的质量要依据____的质量来计算。
②当金属质量≤m时,生成氢气的质量要依据________的质量来计算,相对原子质量越小,生成氢气的质量越________(填“多”或“少”)。
产生相同质量的氢气时,消耗金属的质量关系为____________。
金属与酸反应图像题分析
江苏省兴化市周庄初级中学樊茂225711
一、氢气质量与反应时间函数图像
例1.等质量的镁、铁、分别与足量的稀硫酸反应,下列图像正确的是()
解析:氢气质量与反应时间函数图像有下列两种情形:
第一种:等质量的镁、铁、分别与足量的稀硫酸反应
反应初期t1时氢气的质量与反应速率有关,由于镁比铁的金属活动性强,因而镁与稀硫酸反应速率比铁与同样的稀硫酸反应速率快,同样时间内,镁与酸反应得到的氢气的质量比铁要多,反应的后期t2时,由于稀硫酸过量,氢气的质量的多少由金属的质量决定。
设镁和铁的质量分别为m,与足量稀硫酸完全反应后产生的氢气分别为x、y Mg + H2SO4 = MgSO4 + H2↑Fe + H2SO4 = FeSO4 + H2↑
24 2 56 2
m x m y
24:2=m:X 56:2=m:Y
x=m/12 y=m/28
x>y 所以镁产生的氢气多,所以图像如图1
第二种:足量的镁、铁分别与等质量等浓度稀硫酸反应。
反应初期t1时氢气的质量与反应速率有关,由于镁比铁的金
属活动性强,因而镁与稀硫酸反应速率比铁与同样的稀硫酸反应速率快,同样时间内,镁与酸反应得到的氢气的质量比铁要多。
反应的后期t2时,由于金属过量,氢气的质量的多少由反应掉的酸的质量决定,根据酸的质量相等计算产生氢气的质量
设完全反应掉的硫酸的质量为n,反应后产生的氢气分别为x、y
Mg + H2SO4 = MgSO4 + H2↑Fe + H2SO4 = FeSO4 + H2↑
98 2 98 2
n x n y
98:2=n:X 98:2=n:Y
x=m/49 y=m/49
x=y,反应后生成的氢气质量相等。
此时的图像为图2
就本题,根据题意,显然是第一种情形,因而答案选A
二、氢气质量与加入酸质量之间的函数图像
例2.下列实验过程与图象描述相符合的一组是()
解析:对于答案B,该图像是反映加入稀硫酸质量与氢气质量之间的函数关系,在初始阶段m1时,代表向金属里加入少量的稀硫酸,因而此时,金属过量,加入的酸全部反应,用酸的质量去计算氢气质量,酸相等,所以产生的氢气也相等。
在后期m2由于不断加酸,到金属完全反应,直至酸过量,此时用反应掉的金属的质量去计算氢气的质量,而等质量的镁、锌分别与
足量的稀硫酸完全反应,镁产生的氢气多,锌产生的氢气少,
综合两点图像如图3,因而B正确。
对于A由于氧化钙与饱
和溶液中水反应,导致饱和溶液中水减少,使溶质氢氧化钙
的质量减少所以错误。
对于C氢氧化钠过量时,溶液的PH
值应大于7,所以C错误,对于D氢氧化钠先与盐酸反应,
在开始时,没有沉淀,只有当氢氧化钠加到一定程度才有沉淀,所以D错误。
三、氢气质量与加入金属质量之间的函数图像
例3.下列曲线正确的是()
解析:对于答案A、C向等体积、等浓度的稀盐酸中加入金属,在初始阶段m1时,加入的金属量很少,应完全反应,盐酸过量,此时
用金属质量计算氢气的质量,同等质量m1的铝、铁两金属
分别与足量的盐酸完全反应后,铝比铁产生的氢气多。
在后
期阶段m2时,当金属加到一定程度后金属会过量,盐酸完
全反应,此时产生氢气的质量用完全反应的盐酸的质量来计
算,由于盐酸的质量、浓度相同,因而生成的氢气的质量会
相等。
如图4。
因而A错误,D正确,对于B ,稀硝酸中
加水溶液的PH值不可能等于7,更不可能大于7,所以B错误。
对于C双氧水加入二氧化锰反应速度快,在同样时间内比不加二氧化锰产生的氧气要多,因而C错误。
练一练:1.用质量相等的锌粉和铁粉,分别与溶质质量分数相同、等质量的稀盐酸充分反应,产生氢气的质量和反应所用时间的关系如上图所示。
则下列说法不正确的是()
A.曲线a、b分别表示锌、铁的反应情况
B.盐酸均反应完,锌、铁有剩余
C.盐酸均反应完,锌恰好完全反应,铁有剩余
D.锌铁都反应完,盐酸有剩
2.用质量相等的锌粉和铁粉,分别与溶质质量分数相同且
等质量的稀盐酸充分发生反应,产生氢气的质量与时间的关系
如右图所示。
请回答下列问题:
①表示锌粉与稀盐酸反应的曲线为(填a或b)
②对于a曲线表示的反应,物质(填名称)有剩余。