谷胱甘肽过氧化物酶(glutathione peroxidase, GSH-Px)试剂盒使用说明
- 格式:pdf
- 大小:87.15 KB
- 文档页数:5

禾本科植物谷胱甘肽氧化物酶的活性测定摘要:本文以羊草的叶片和根为材料, 用0. 2 mo l /L pH 6. 2的磷酸缓冲液( 含1 mmo l/L EDTA-2Na,5%的水溶性PVP)作为谷胱甘肽过氧化物酶(GSH一PX)的提取介质,偏磷酸为酶促反应的蛋白质沉淀剂, 二硫代对二硝基苯甲酸(DTNB ) 与GSH显色反应3min, 在412 nm测定酶管和非酶管的OD值, 以测定谷胱甘肽过氧化物酶的活性关键词:盐碱胁迫;羊草;GSH-PX;酶活性Analyzing Soluble Sugar Content and Biomass of Sweet Sorghumunder Saline-alkali StressAbstract:Soil salinization is a global issue. Experiments prove that growing state of sweet sorghum shows growth inhibition,lower production and physiological disorders under soil salinity In this study,sweet sorghum as our material,was sowed in neutral soil and saline soil, respectively,exploring characteristics of salinity stress for the sweet sorghum and the change of soluble sugar and biomass. According to the particularity of different soils,we observed the relationship between different varieties and salt-alkali stress at different growth stages.Profound understanding of physiological mechanism of sweet sorghum response to salt-alkali stress for screening sweet sorghum germplasm,identifying salinity tolerance and cultivating the new sweet sorghum species is significance.Keywords: Salt stress; sweet sorghum; Glutathione peroxidase; enzyme actirityⅠ1前言植物是一个需氧代谢的有机体。

抗氧化酶的作用简介抗氧化酶是一类在生物体内起到抗氧化作用的酶。
它们能够通过将氧自由基转化为无害物质,从而保护细胞免受氧化损伤。
氧自由基是一种高度反活性的分子,通过与细胞中的脂质、蛋白质和核酸发生反应,会导致细胞损伤甚至死亡。
而抗氧化酶正是在这一过程中发挥重要作用。
抗氧化酶的分类超氧化物歧化酶(superoxide dismutase, SOD)超氧化物歧化酶是最早被发现的抗氧化酶,它能够将超氧自由基(一种常见的氧自由基)转化为分子氧和过氧化氢。
超氧自由基非常容易与生物体内的其他分子发生反应,导致细胞损伤。
超氧化物歧化酶的存在可以有效地清除超氧自由基,减少细胞的氧化损伤。
过氧化氢酶(catalase, CAT)过氧化氢酶是另一种重要的抗氧化酶。
它能够将过氧化氢(一种产生于氧自由基反应中的有毒物质)转化为水和氧气。
过氧化氢是一种强氧化剂,会导致蛋白质、脂质和DNA等生物分子的氧化损伤。
而过氧化氢酶的作用是将过氧化氢分解,从而减轻氧化损伤对细胞的影响。
谷胱甘肽过氧化物酶(glutathione peroxidase, GPx)谷胱甘肽过氧化物酶是一类依赖于谷胱甘肽的酶,它能够将多种过氧化物转化为相应的醇。
谷胱甘肽是一种三肽,包含谷氨酸、半胱氨酸和甘氨酸,它具有较强的还原能力,可以和氧自由基等产生活性物质反应而保护细胞。
抗氧化酶的工作机制抗氧化酶通过各自不同的反应机制来清除细胞内的氧自由基,起到抗氧化作用。
超氧化物歧化酶的工作机制超氧化物歧化酶通过催化超氧自由基的转化来发挥作用。
其反应式如下:2O2·⁻ + 2H⁺ → H2O2 + O2超氧化物歧化酶能够加速这一反应,从而将超氧自由基转化为水和氧气。
该酶钴离子和铜离子作为辅助因子,可以促进反应的进行。
过氧化氢酶的工作机制过氧化氢酶主要通过催化过氧化氢的分解来发挥作用。
其反应式如下:2H2O2 → 2H2O + O2过氧化氢酶能够提供合适的活化能,加速这一分解反应的进行。

谷胱甘肽过氧化物酶和硒的关系(一)
谷胱甘肽过氧化物酶和硒的关系
谷胱甘肽过氧化物酶 (Glutathione Peroxidase,GPx)
•GPx是一种重要的酶类,存在于细胞内和细胞外
•GPx能够催化谷胱甘肽(Glutathione,GSH)与过氧化氢(Hydrogen Peroxide,H2O2)等有害物质反应,将其还原为无害物质
•GPx具有抗氧化作用,能够防止有害物质对细胞的损害
硒
•硒是一种微量元素,是人体必需的营养物质之一
•硒存在于许多食物中,如鱼类、肉类、谷类等
•硒具有抗氧化作用,能够帮助清除体内的自由基
•硒还能够促进谷胱甘肽过氧化物酶的活性,增强其抗氧化能力谷胱甘肽过氧化物酶与硒的关系
•谷胱甘肽过氧化物酶的活性与硒的供应密切相关
•硒作为GPx活性中心的一部分,能够与GPx产生稳定的结合
•硒通过参与GPx的催化反应,增强了GPx对有害物质的还原能力和抗氧化能力
•缺乏硒会导致GPx活性下降,降低抗氧化能力,增加细胞受损的风险
结论
•谷胱甘肽过氧化物酶和硒之间存在密切的关系
•硒可以促进谷胱甘肽过氧化物酶的活性,提升细胞的抗氧化能力•适量的硒摄入有助于保护细胞免受有害物质的损害
•合理的膳食结构和均衡摄入硒的食物是维持谷胱甘肽过氧化物酶功能的重要措施。
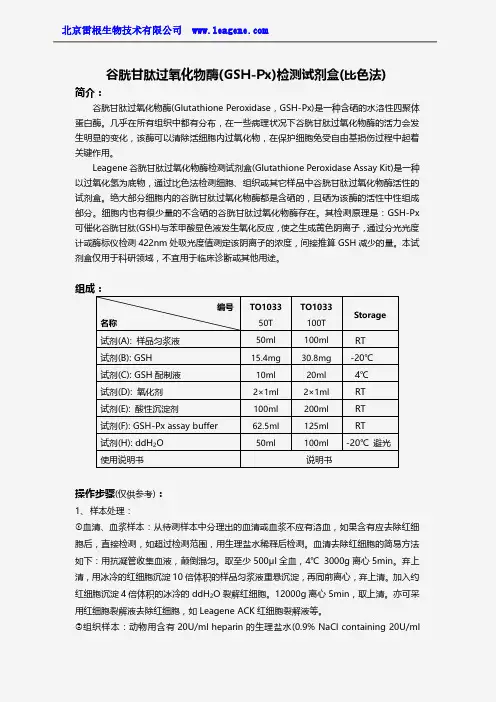

大鼠谷胱甘肽过氧化物酶正常范围大鼠谷胱甘肽过氧化物酶(glutathione peroxidase,GPx)是一种重要的抗氧化酶,具有保护细胞免受氧化应激损伤的重要功能。
它能够将有害的过氧化物质转化为无害的代谢产物,从而维护细胞内氧化还原平衡。
该酶的正常范围可作为综合评估大鼠健康状况的重要指标。
一般来说,正常大鼠的GPx活性应在一定的范围内。
实验研究表明,GPx活性与大鼠的年龄、性别、营养状况等因素相关。
首先,GPx活性随着大鼠的年龄增长而发生变化。
在幼年阶段,大鼠体内GPx活性较低。
随着成长,GPx活性逐渐增加,达到成年期的稳定水平。
然而,在老年阶段,GPx活性又会逐渐降低。
因此,根据大鼠的年龄,我们可以了解其GPx活性是否处于正常范围内。
其次,性别也会对大鼠GPx活性产生一定的影响。
一项研究发现,雄性大鼠的GPx活性明显高于雌性大鼠。
这可能与雄性大鼠对氧化应激的抵抗能力更强有关。
因此,在评估大鼠GPx活性时,应考虑到性别差异。
此外,营养状况也会对大鼠GPx活性产生影响。
一项研究发现,摄入富含谷胱甘肽的食物可以提高大鼠体内GPx活性。
这表明,适当的营养摄入对维持GPx活性的正常范围非常重要。
总结起来,大鼠GPx活性的正常范围受到多种因素的影响,包括年龄、性别以及营养状况等。
我们可以通过测量大鼠的GPx活性来评估其细胞内氧化还原平衡情况。
如果GPx活性超出正常范围,则可能存在氧化应激损伤等问题。
因此,掌握大鼠GPx活性的正常范围对于研究大鼠健康状况具有指导意义。
在实际应用中,我们可以通过特定的实验方法检测大鼠GPx活性,并结合其他指标综合评估大鼠的氧化应激状况。
这为大鼠健康管理和疾病研究提供了重要的参考依据。
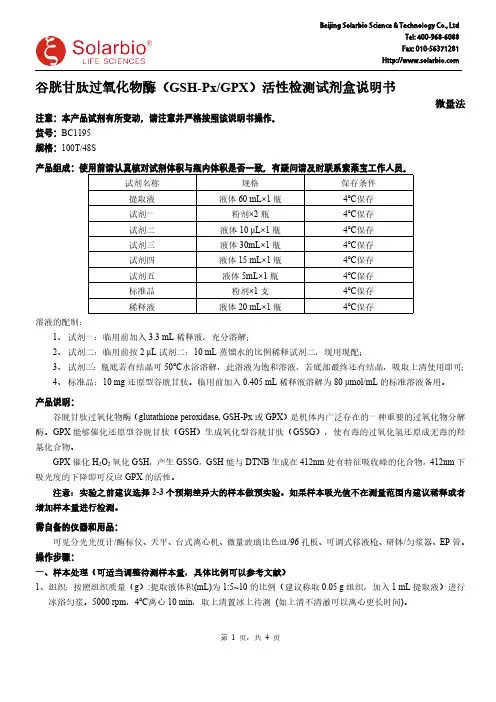
谷胱甘肽过氧化物酶(GSH-Px/GPX )活性检测试剂盒说明书微量法注意:本产品试剂有所变动,请注意并严格按照该说明书操作。
货号:BC1195规格:100T/48S产品组成:使用前请认真核对试剂体积与瓶内体积是否一致,有疑问请及时联系索莱宝工作人员。
试剂名称规格保存条件提取液液体60 mL×1瓶4℃保存试剂一粉剂×2瓶4℃保存试剂二液体10 μL×1瓶4℃保存试剂三液体30mL×1瓶4℃保存试剂四液体15 mL×1瓶4℃保存试剂五液体5mL×1瓶4℃保存标准品粉剂×1支 4℃保存稀释液液体20 mL×1瓶4℃保存溶液的配制:1、试剂一:临用前加入3.3 mL 稀释液,充分溶解;2、试剂二:临用前按2 μL 试剂二:10 mL 蒸馏水的比例稀释试剂二,现用现配;3、试剂三:瓶底若有结晶可50℃水浴溶解,此溶液为饱和溶液,若底部最终还有结晶,吸取上清使用即可;4、标准品:10 mg 还原型谷胱甘肽。
临用前加入0.405 mL 稀释液溶解为80 μmol/mL 的标准溶液备用。
产品说明:谷胱甘肽过氧化物酶(glutathione peroxidase, GSH-Px 或GPX )是机体内广泛存在的一种重要的过氧化物分解酶。
GPX能够催化还原型谷胱甘肽(GSH )生成氧化型谷胱甘肽(GSSG ),使有毒的过氧化氢还原成无毒的羟基化合物。
GPX 催化H 2O 2氧化GSH ,产生GSSG ,GSH 能与DTNB 生成在412nm 处有特征吸收峰的化合物,412nm 下吸光度的下降即可反应GPX 的活性。
注意:实验之前建议选择2-3个预期差异大的样本做预实验。
如果样本吸光值不在测量范围内建议稀释或者增加样本量进行检测。
需自备的仪器和用品:可见分光光度计/酶标仪、天平、台式离心机、微量玻璃比色皿/96孔板、可调式移液枪、研钵/匀浆器、EP 管。

谷胱甘肽对氧化应激的保护作用及其机制氧化应激是一种生理过程,指在细胞内外环境中产生的自由基和其他氧化性物质对细胞内的蛋白质、核酸和膜等分子的电子结构造成的影响。
长期以来,人们认为氧化应激是许多疾病的罪犯,如癌症、心血管疾病、糖尿病等。
在这样的情况下,寻找能够减轻氧化应激损伤的化合物备受关注。
而此时,谷胱甘肽就成为了研究的热门。
谷胱甘肽(glutathione,GSH)是一种三肽,由谷氨酸(glutamate)、半胱氨酸(cysteine)和甘氨酸(glycine)形成的。
GSH是细胞内最主要的抗氧化剂,可以保护细胞内的生物分子不受被氧化损伤。
近年来,越来越多的研究表明,GSH除了作为抗氧化剂防止氧化应激伤害外,还能调节细胞信号转导、细胞凋亡等生物学过程。
GSH含量的变化与机体很多疾病的发生、发展有着密切关系。
在生物体内,GSH的状态可以由其氧化形式(二硫键形式,GSSG)和还原形式(GSH)的比例反映出来。
长期以来,GSH的氧化还原状态被认为是细胞抗氧化能力和氧化应激响应的重要指标之一。
氧化应激状态的提高会导致GSH氧化还原状态的变化,例如GSSG水平升高,GSH水平下降。
因此,监测GSH的氧化还原状态对于评估氧化应激的程度以及细胞抗氧化能力的状况非常重要。
GSH保护细胞的机制有多种,一般主要包括以下几个方面。
首先,GSH可以直接降解有毒物质,如270.0,4-二氯苯氧基乙酰胺(CDNB)、二硫联苯(DTNB)等。
其次,GSH还可以与氧化剂等抗氧化损伤物质发生还原反应,生成具有抗氧化作用的还原性物质。
此外,GSH还能够维持其他抗氧化剂的代谢和再生,并通过调节肝脏、脾脏、淋巴细胞和肾上腺等生物器官和组织的代谢和解毒功能,发挥更全面的保护作用。
但是,GSH对于氧化应激的保护机制还没有被完全阐明。
研究表明,GSH除了参与直接降解有毒物质的反应外,还可以通过间接途径发挥抗氧化作用。
比如,GSH参与多种抗氧化酶的酶促辅助酶的再生,其中最显著的就是谷胱甘肽过酸化酶(glutathione peroxidase,GPx)和谷胱甘肽还原酶(glutathione reductase,GR)。



1.3.6.2 血或组织中谷胱甘肽过氧化物酶(GSH-Px)活力测定1.3.6.2.1 原理谷胱甘肽过氧化物酶(GSH-Px)是体内存在的一种含硒清除自由基和抑制自由基反应的系统。
对防止体内自由基引起膜脂质过氧化特别重要,其活力以催化GSH氧化的反应速度,及单位时间内GSH减少的量来表示,GSH和5,5’-二硫对硝基苯甲酸(DTNB)反应在GSH-Px催化下可生成黄色的5-硫代2-硝基苯甲酸阴离子,于423nm波长有最大吸收峰,测定该离子浓度,即可计算出GSH减少的量,由于GSH能进行非酶反应氧化,所以最后计算酶活力时,必须扣除非酶反应所引起的GSH减少。
1.3.6.2.2 试剂和仪器仪器:可见光分光光度计、酶标仪、低温高速离心机、匀浆器、恒温水浴锅、微量加样器试剂:叠氮钠磷酸缓冲液pH7.0N a N316.25mg 终浓度2.5mmol/LEDTA-N a27.44mg 终浓度0.2mmol/LN a2HPO4 1.732g 终浓度0.2mol/LN a H2PO4 1.076g 终浓度0.2mol/L加蒸馏水至100mL,用少量HCL、N a OH调pH7.0,4℃保存。
1mmol/L谷胱甘肽(还原型GSH)溶液GSH 30.7mg加叠氮钠磷酸缓冲液至100mL,临用前配制,冰冻保存1-2日。
1.25-1.5mmol/LH2O2溶液取30%H2O20.15-0.17mL,用双蒸水稀释至100mL,作为贮备液,4℃避光保存,临用前将贮备液用双蒸水稀释10倍即可。
偏磷酸沉淀液HPO316.7g(先用蒸馏水溶解)EDTA 0.5gN a Cl 280g加蒸馏水至1000mL,用普通滤纸过滤,室温保存。
0.32mol/LN a2HPO4溶液:N a2HPO422.7g加蒸馏水至500mL,室温保存。
DTNB显色液DTNB 40mg柠檬酸三钠 1.0g加蒸馏水至100mL,4℃避光保存1个月。
0.2M磷酸缓冲液pH7.40.9%生理盐水1.3.6.2.3 实验步骤1.3.6.2.3.1 样品制备溶血液:取鼠血10μl加入到1mL双蒸水中,充分振摇,使之全部溶血1:100待测,4h内测定酶活力。

谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)试剂盒使用说明微量法注意:正是测定之前选择2-3个预期差异大的样本做预测定。
货号:BC1195规格:100管/96样产品内容:试剂一:液体×1瓶,4℃保存。
试剂二:粉剂×1瓶,4℃保存。
试剂三:液体×1支,-20℃保存。
混合试剂配制:临用前,在试剂二中加入试剂一20mL,充分震荡溶解后加入全部试剂三,混匀。
(注意:必须现配现用,当天使用完)试剂四:液体×1瓶,4℃保存。
产品说明:GSH-Px是谷胱甘肽氧化还原循环中催化还原型谷胱甘肽(GSH)氧化的主要酶之一。
GSH-Px不仅能够特异地催化还原型谷胱甘肽与ROS反应,生成氧化型谷胱甘肽GSSG,从而保护生物膜免受ROS的损害,维持细胞的正常功能;而且具有保护肝脏、提高机体免疫力、拮抗有害金属离子对机体的伤害和增加机体抗辐射等能力。
GSH-Px催化H2O2氧化GSH,产生GSSG;谷胱甘肽还原酶(GR)催化NADPH还原GSSG,再生GSH,同时NADPH氧化生成NADP+;NADPH在340nm有特征吸收峰,而NADP+没有;通过测定340nm光吸收减少速率来计算GSH-Px活性。
自备仪器和用品:紫外分光光度计/酶标仪、低温离心机、水浴锅、可调节移液器、微量石英比色皿/96孔板和蒸馏水。
操作步骤:一、粗酶液提取:1.组织:按照组织质量(g):试剂一体积(mL)为1:5~10的比例(建议称取0.1g组织,加入1mL试剂一)进行冰浴匀浆。
10000rpm,4℃离心10min,取上清置冰上待测。
2.细菌、真菌:按照细胞数量104个:试剂一体积(ml)500~1000:1的比例,建议500万细胞加入1mL试剂一),冰浴超声波破碎细胞(率300w,超声3s,间隔7s,总时间3min)然后10000rpm,4℃,离心10min,取上清置冰上待测。
谷胱甘肽和谷胱甘肽过氧化物酶的关系
谷胱甘肽(Glutathione,GSH)和谷胱甘肽过氧化物酶(Glutathione Peroxidase,GPx)是两种在生物体内具有重要功能的分子。
谷胱甘肽是一种由谷氨酸、半胱氨酸和甘氨酸组成的三肽,它具有抗氧化、解毒和维持细胞内氧化还原平衡等多种生理功能。
谷胱甘肽可以直接与自由基、过氧化物等有害物质发生反应,将其转化为无害物质,从而保护细胞免受氧化损伤。
谷胱甘肽过氧化物酶是一种含硒的酶,它可以催化谷胱甘肽与过氧化物(如过氧化氢、超氧自由基等)发生氧化还原反应,将过氧化物还原为水和氧气,同时将谷胱甘肽氧化为氧化型谷胱甘肽(GSSG)。
谷胱甘肽过氧化物酶在细胞内的抗氧化防御系统中起着至关重要的作用。
谷胱甘肽和谷胱甘肽过氧化物酶之间存在着密切的关系。
谷胱甘肽是谷胱甘肽过氧化物酶的底物,谷胱甘肽过氧化物酶通过催化谷胱甘肽与过氧化物的反应来清除细胞内的过氧化物,从而保护细胞免受氧化损伤。
同时,谷胱甘肽过氧化物酶也可以将氧化型谷胱甘肽还原为还原型谷胱甘肽,维持谷胱甘肽的还原状态,从而保证其抗氧化功能的正常发挥。
谷胱甘肽和谷胱甘肽过氧化物酶是生物体内重要的抗氧化分子,它们相互作用,共同构成了细胞内的抗氧化防御系统,对于维持细胞的正常生理功能和机体的健康具有重要意义。
磷脂过氧化氢谷胱甘肽过氧化物酶磷脂过氧化氢和谷胱甘肽过氧化物酶是生物体内两种重要的氧化还原反应酶。
本文将从分子结构、生物学功能、代谢通路、调控机制等多个方面详细介绍这两种酶。
一、磷脂过氧化氢磷脂过氧化氢(phospholipid hydroperoxide, PLHP)是一种具有强氧化性的有机物,常常由脂肪酸、磷脂酰胆碱、脂肪酰肌醇等氧化生成。
PLHP会导致膜脂质的氧化损伤,严重的损伤可能导致生物膜的完整性失效。
1.分子结构磷脂过氧化氢酶是一种谷胱甘肽过氧化物酶家族(glutathione peroxidase,GPx)中的一个成员。
与一般的GPx不同的是,PHGPx有两个反应中心:一个是对PLHP的直接酶促还原,另一个是将草鱼卵黄急速酸化后形成的玉米油酸甘油磷酸(MPPC)还原为MPPOH的催化反应。
PHGPx 是一个多肽链蛋白,包括重链和轻链。
轻链含有一个谷胱甘肽,谷胱甘肽是由谷氨酸、半胱氨酸和甘氨酸三个氨基酸组成的三肽,是一种细胞内的重要抗氧化剂。
在还原反应中,谷胱甘肽经过金属茎德尔反应(metal-stimulated Delreaction)发生硫酯键的双反应,作为高效的氧化剂消耗过氧化氢类物质。
在是谷胱甘肽分子断环形式之后,还原次数可以在没有外源氧化剂的情况下进行数十次。
2.生物学功能在生物体内,磷脂过氧化氢可以经由多条代谢通路生成和消除。
PHGPx 所在的代谢通路是一种以半面体谷胱甘肽为还原试剂的代谢通路,这种代谢通路可以保护羊膜内皮细胞中的微血管系统,减少有害物质的产生,从而保护胎儿。
此外,PHGPx还具有改善思维能力、保护大脑神经细胞,调节生长发育和免疫功能等多种重要生物学功能。
3.代谢通路PHGPx代谢通路是由PHGPx、NADPH和谷胱甘肽三个组成部分组成的。
当细胞代谢产生PLHP,PHGPx催化PLHP和还原型谷胱甘肽反应,生成对应的水和还原型PLP。
在还原过程中,谷胱甘肽起到还原剂的作用。
谷胱甘肽过氧化物酶作用谷胱甘肽过氧化物酶,听起来有点高深,但其实它就像你生活中的小英雄,默默守护着你的身体。
想象一下,你正吃着一块巧克力蛋糕,心里美滋滋的,突然来了一阵“自由基”捣乱,就像小偷在你家里翻箱倒柜。
这个时候,谷胱甘肽过氧化物酶就像是那个英勇的警察,迅速赶到,帮你处理这些坏家伙,保证你吃完蛋糕后不会有“坏肚子”的烦恼。
大家都知道,身体里有一些东西是不请自来的,它们就像不速之客,叫人心烦。
自由基就是这么一号人物,过多的自由基就会让你感觉疲惫不堪,皮肤也会变得暗淡无光。
谷胱甘肽过氧化物酶的工作就是将这些不受欢迎的客人赶出去。
就像你的朋友在聚会上,看到有人喝得烂醉,马上把他拉到门外,避免一场“尴尬”的大戏。
说到这里,你可能会问,这个谷胱甘肽过氧化物酶到底是个什么玩意儿?简单来说,它是一种酶,主要存在于细胞内。
它的作用是催化一些反应,把那些自由基转化为无害的物质。
就像是把坏蛋变成了好人,这样你的身体才能保持健康,活力四射。
可以说,谷胱甘肽过氧化物酶就像是身体里的“绿茶婊”,一边清理战场,一边保持优雅,绝不让你掉链子。
有趣的是,这种酶的名字还来源于一种叫“谷胱甘肽”的物质。
谷胱甘肽可以说是我们身体里的“保镖”,它帮助我们对抗氧化压力,保护细胞不受伤害。
你可能听说过“抗氧化”这个词,它的意思就是抵抗那些让你衰老的坏东西。
想象一下,谷胱甘肽和谷胱甘肽过氧化物酶就像是一对好搭档,时刻准备着为你的健康打拼。
在生活中,我们也可以通过饮食来提高谷胱甘肽过氧化物酶的活性。
吃点富含硒和锌的食物,比如坚果、海鲜、全谷物,这样就能给这些小英雄补充能量,让它们更好地工作。
就好比给运动员加油,吃得好才能跑得快,身体才能棒棒哒。
再加上多喝水,保持身体的水分平衡,简直是给这些酶们开了一扇窗,让它们可以自由地“呼吸”。
除了饮食,生活方式也很重要。
保证充足的睡眠,别让自己熬夜,毕竟谁都不想当个熊猫嘛。
适度运动,像散步、游泳,都是给身体充电的好方式。
谷胱甘肽过氧化物酶正常值范围【谷胱甘肽过氧化物酶正常值范围】谷胱甘肽过氧化物酶(Glutathione Peroxidase,简称GPx)是一种重要的抗氧化酶,它可以清除体内的过氧化物,保护细胞免受氧化应激的损害。
正常的GPx活性水平对于维持身体健康至关重要。
那么,关于谷胱甘肽过氧化物酶的正常值范围,我们是怎样来进行综合评估和了解呢?1. 谷胱甘氨酸谷胱甘氨酸是一种三肽,在体内具有重要的抗氧化作用。
它可以帮助GPx清除过氧化氢等有害物质,保护细胞免受损害。
了解谷胱甘氨酸的含量对于评估GPx的正常值范围具有重要意义。
2. 维生素E维生素E是一种脂溶性维生素,其具有抗氧化作用,可以帮助GPx在体内发挥作用。
维生素E的含量是否充足,直接影响了GPx的正常活性水平。
在评估GPx正常值范围的时候,我们也需要考虑体内维生素E的水平。
3. GPx活性水平GPx的活性水平是评估其正常值范围的主要依据。
一般来说,GPx活性水平应该能够维持在一个稳定的范围内,以保证体内氧化应激的平衡。
过低的GPx活性水平可能导致氧化应激损伤,而过高的活性水平也可能导致其他问题的发生。
通过检测GPx活性水平,我们可以更准确地了解其正常值范围。
4. 个人观点在我看来,谷胱甘肽过氧化物酶的正常值范围并不是一个简单的数字,而是涉及到细胞内抗氧化平衡的重要指标。
它的正常范围会受到许多因素的影响,包括个体差异、环境因素、饮食习惯等。
我们在评估GPx的正常范围时,需要考虑到这些因素,以便更准确地判断一个人的抗氧化能力是否正常。
对于谷胱甘肽过氧化物酶正常值范围的评估,我们不仅需要考虑到其活性水平,还需要结合谷胱甘氨酸、维生素E等因素进行综合评估。
只有全面了解这些因素,我们才能更准确地判断一个人的抗氧化能力是否正常,以及是否存在潜在的健康风险。
【Words】谷胱甘肽过氧化物酶(Glutathione Peroxidase,GPx)是一种抗氧化酶,其在维持机体内氧化还原平衡中起着重要作用。
谷胱甘肽(GSH)及其生理功用谷胱甘肽(GSH)、胺基酸与人体健康你最近可能常常会听到这些名词:「自由基」和「抗氧化剂」。
的确,许多研究者曾经发现身体内之自由基,在本质上会造成许多严重的疾病,包括心脏病、癌症、白内障以及许多其它疾病。
幸运的是研究者也发现只要适度补充体内抗氧化剂就可以消除自由基,有助预防疾病。
但你知道自由基是什么?为何需要抗氧化剂?谷胱甘肽为最佳抗氧化剂我们知道身体进行正常生理代谢,把食物转变成为能量以供给细胞做燃料,同时制造的副产品就是「自由基」。
自由基是一种不安定的含氧分子,最外层轨道仅带有不成对、奇数的电子,极端不稳定,会抽取其它分子内所含有之电子以构成安定搭配,为能达到这种目的,就会破坏细胞内分子。
假如它从细胞或你体内构造精致的细胞膜、细胞核中抓走电子的话,身体内的细胞就遭受破坏、停止有效的工作,发生突变甚至死亡。
再者,被掳夺走电子的分子本身,也会转变成自由基,开始做一些危险性的阶梯式反应,只有等到身体可以消除自由基、免除细胞遭受循环性破坏后,细胞的阶梯式反应才得以停止。
到目前为止,科学家们已经鉴定出两类具破坏性的含氧自由基,即氢氧自由基(hydroxyl radicals),以及超氧自由基(superoxide amino radicals)。
我们的身体在制造能量的过程中,可以创造自由基,当然也可以制造解毒剂。
身体内的解毒剂包括有抗氧化酵素,例如谷胱甘肽过氧化酶(glutathione peroxidase GSH-PX)、过氧化氢酶(catalase, CAT),和超氧化物歧化酶(superoxide dismutase, SOD)。
这些抗氧化酵素可以对抗体内的自由基;一旦自由基形成之后,立刻被抗氧化酵素中和、甚至去除。
抗氧化酵素集体性的帮助细胞维持还原作用(获得电子)以及氧化作用(放弃电子)之间的健康稳定性平衡。
科学家们把这种进行中之代谢程序比喻为氧化还原反应(redox, reduction- oxidation)。
谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)试剂盒使用说明
微量法注意:正是测定之前选择2-3个预期差异大的样本做预测定。
货号:BC1195
规格:100管/96样
产品内容:
试剂一:液体×1瓶,4℃保存。
试剂二:粉剂×1瓶,4℃保存。
试剂三:液体×1支,-20℃保存。
混合试剂配制:临用前,在试剂二中加入试剂一20mL,充分震荡溶解后加入全部试剂三,混匀。
(注意:必须现配现用,当天使用完)
试剂四:液体×1瓶,4℃保存。
产品说明:
GSH-Px是谷胱甘肽氧化还原循环中催化还原型谷胱甘肽(GSH)氧化的主要酶之一。
GSH-Px不仅能够特异地催化还原型谷胱甘肽与ROS反应,生成氧化型谷胱甘肽GSSG,从而保护生物膜免受ROS的损害,维持细胞的正常功能;而且具有保护肝脏、提高机体免疫力、拮抗有害金属离子对机体的伤害和增加机体抗辐射等能力。
GSH-Px催化H2O2氧化GSH,产生GSSG;谷胱甘肽还原酶(GR)催化NADPH还原GSSG,再生GSH,同时NADPH氧化生成NADP+;NADPH在340nm有特征吸收峰,而NADP+没有;通过测定340nm光吸收减少速率来计算GSH-Px活性。
自备仪器和用品:
紫外分光光度计/酶标仪、低温离心机、水浴锅、可调节移液器、微量石英比色皿/96孔板和蒸馏水。
操作步骤:
一、粗酶液提取:
1.组织:按照组织质量(g):试剂一体积(mL)为1:5~10的比例(建议称取0.1g组织,
加入1mL试剂一)进行冰浴匀浆。
10000rpm,4℃离心10min,取上清置冰上待测。
2.细菌、真菌:按照细胞数量104个:试剂一体积(ml)500~1000:1的比例,建议500万细
胞加入1mL试剂一),冰浴超声波破碎细胞(率300w,超声3s,间隔7s,总时间3min)然后10000rpm,4℃,离心10min,取上清置冰上待测。
3.血清等液体:直接测定。
二、测定操作:
1.分光光度计预热30min,调节波长到340nm,蒸馏水调零。
2.混合试剂在25℃或者37℃(哺乳动物)水浴中预热30min以上。
3.空白管:依次在1mL石英比色皿中加入20μL蒸馏水、160μL预热的混合试剂,20μL 试剂四,迅速混匀后于340nm处测定第10s和第190s的吸光值,分别记为A空1和A空,△A空白管=A空1﹣A空2。
4.测定管:依次在1mL石英比色皿中加入20μL上清液、160μL预热的混合试剂,20μL 试剂四,迅速混匀后于340nm处测定第10s和第190s的吸光值,分别记为A测1和A测2,△A测定管=A测1﹣A测2。
注意:空白管只需测定一次。
三、GSH-Px活性计算:
A.使用微量石英比色皿测定:
(1).按蛋白浓度计算
GSH-Px活力单位定义:一定温度中,每mg蛋白每分钟催化1nmol NADPH氧化为1个酶活单位。
GSH-Px(U/mg prot)=[(△A测定管-△A空白管)÷ε÷d×V反总×109]÷(Cpr×V样)÷T
=536×(△A测定管-△A空白管)÷Cpr
(2).按样本质量计算
GSH-Px活力单位定义:一定温度中,每g样本每分钟催化1nmol NADPH氧化为1个酶活单位。
GSH-Px(U/g)=[(△A测定管-△A空白管)÷ε÷d×V反总×109]÷(W×V样÷V样总)÷T
=536×(△A测定管-△A空白管)÷W
(3).按细胞数量计算
GSH-Px活力单位定义:一定温度中,每104个细胞每分钟催化1nmol NADPH氧化为1个酶活单位。
GSH-Px(U/104cell)=[(△A测定管-△A空白管)÷ε÷d×V反总×109]÷(细胞数量×V 样÷V样总)÷T
=536×(△A测定管-△A空白管)÷细胞数量
(4).按液体体积计算
GSH-Px活力单位定义:一定温度中,每毫升液体每分钟催化1nmol NADPH氧化为1个酶活单位。
GSH-Px(U/ml)=[(△A测定管-△A空白管)÷ε÷d×V反总×109]÷V样÷T
=536×(△A测定管-△A空白管)
ε:NADPH摩尔消光系数6.22×103L/mol/cm;d:比色皿光径,1cm;V反总:反应体系总体积,200μL=2×10-4L;106:1mol=1×106μmol;Cpr:上清液蛋白浓度(mg/mL);V样:加入反应体系中上清液体,20μL=0.02mL;V样总:加入提取液体积,1mL;W,样本质量,g;T:反应时间,3min。
B.使用96孔板测定:
(1).按蛋白浓度计算
GSH-Px活力单位定义:一定温度中,每mg蛋白每分钟催化1nmol NADPH氧化为1个酶活单位。
GSH-Px(U/mg prot)=[(△A测定管-△A空白管)÷ε÷d×V反总×109]÷(Cpr×V样)÷T
=1027×(△A测定管-△A空白管)÷Cpr
(2).按样本质量计算
GSH-Px活力单位定义:一定温度中,每g样本每分钟催化1nmol NADPH氧化为1个酶活单位。
GSH-Px(U/g)=[(△A测定管-△A空白管)÷ε÷d×V反总×109]÷(W×V样÷V样总)÷T
=1027×(△A测定管-△A空白管)÷W
(3).按细胞数量计算
GSH-Px活力单位定义:一定温度中,每104个细胞每分钟催化1nmol NADPH氧化为1个酶活单位。
GSH-Px(U/104cell)=[(△A测定管-△A空白管)÷ε÷d×V反总×109]÷(细胞数量×V 样÷V样总)÷T
=1027×(△A测定管-△A空白管)÷细胞数量
(4).按液体体积计算
GSH-Px活力单位定义:一定温度中,每毫升液体每分钟催化1nmol NADPH氧化为1个酶活单位。
GSH-Px(U/ml)=[(△A测定管-△A空白管)÷ε÷d×V反总×109]÷V样÷T
=1027×(△A测定管-△A空白管)
ε:NADPH摩尔消光系数6.22×103L/mol/cm;d:比色皿光径,0.5cm;V反总:反应体系总体积,200μL=2×10-4L;106:1mol=1×106μmol;Cpr:上清液蛋白浓度(mg/mL);V样:加入反应体系中上清液体,20μL=0.02mL;V样总:加入提取液体积,1mL;W,样本质量,g;T:反应时间,3min。
注意事项:
1.样品处理等过程均需要在冰上进行,且须在当日测定酶活力。
2.混合试剂和底物液须临用前配制,配完后置于冰上,当天使用完。
3.测定过程操作须迅速。
4.细胞中GSH-Px活性测定时,细胞数目须在300万-500万之间,细胞中GSH-Px的提取
时可加试剂一后研磨或超声波处理,不能用细胞裂解液处理细胞。