高考化学离子反应真题汇编(含答案)及解析1
- 格式:doc
- 大小:476.50 KB
- 文档页数:13

高考化学离子反应真题汇编( 含答案) 及解析一、高中化学离子反应1.向含a mol (NH4)2Fe(SQ)2溶液中逐7^加入b mol NaOH溶液,下列说法不正确的是A. (NH4)2Fe(SQ)2是复盐B.b = a 时,溶液中离子浓度大小关系为:c(Fe2+) = c(NH4+)C. b = 2a时,发生的离子反应为:Fe2++ 2OH=Fe(OH)2 JD.当2avbw 4a 时可能发生的离子反应为: 3 NH4++ 2Fe2++ 70H=2Fe(OH)2 J + 3NH • H2O 【答案】B【解析】【分析】【详解】A. (NH4)2Fe(SQ)2是由NH4+和Fe2+> SQ2」构成的盐,在溶液中能电离出2种阳离子,为复盐,正确, A 不选;B. b=a时,Fe2+先和NaOH反应生成Fe(OH)2沉淀,有一半的Fe2+生成沉淀,NH4+不反应,Fe2+、NH4+都水解且相互抑制水解,所以存在c(Fe2+)<c(NH4+),错误,B选;C. b=2a时,Fe2+先和NaOH反应生成Fe(OH)2沉淀且Fe2+完全反应,离子方程式为Fe2 + +2OH =Fe(OH)?^ ,正确,C 不选;D,当2avbw 4a时,Fe2+完全反应,部分NH4+反应生成NH3 . H2O,所以可能发生离子反应3NH4++2Fe2++7OH — 2Fe(OHk J +3NH3 - H2O,正确,D 不选。
答案选B。
2.一定能在下列溶液中大量共存的离子组是( )A,水电离产生的H+浓度为1X1。
12molL-1的溶液:NH4+、Na\ C「、HCO3-B.能使pH试纸变深蓝色的溶液:Na+、AlO2-、ST、O32-C.含有大量Fe3+的溶液:SCN、「、K+、BrD. pH=1 的水溶液中:Al>、NH4+、CH3COO、Br【答案】B【解析】【分析】【详解】A、水电离产生的H+浓度为1X1d2mol/L,说明水的电离受到抑制,该溶液可能为酸或碱溶液,HCO3-既能与酸反应又能与碱反应,NH4+与碱反应,能大量共存,A错误;B、能使pH试纸变深蓝色的溶液,为碱性溶液,碱性条件下该组离子之间不反应,能大量共存,B 正确;G Fe3+与SCN不口厂都能发生反应,不能大量共存,C错误;D、pH=1的水溶液呈酸性,CH3CO6与H+反应,不能大量共存,D错误。

高考化学离子反应试题( 有答案和解析 )一、高中化学离子反应1. 向含有 FeBr 2 溶液中通入一定量的 Cl 2(还原性: Fe 2+>Br -),表示该反应的离子方程式肯定错误的是( )A .2Fe 2++ Cl 2=2Fe 3++ 2Cl -B . 10Fe 2++2Br -+ 6Cl 2=10Fe 3++Br 2+ 12Cl -C . 2Br -+ Cl 2=Br 2+ 2Cl -D . 2Fe 2++ 4Br -+ 3Cl 2 =2Br 2+ 2Fe 3 ++ 6Cl -【答案】 C【解析】【分析】2+> Br -22+反应,后与还原性: Fe,则向含有 FeBr 2溶液中通入一定量的FeCl 时,氯气先与Br -反应。
【详解】A. 当通入少量的氯气时,氯气只与亚铁离子反应,其反应的离子方程式为 2++ Cl 23+2Fe=2Fe+2Cl -,故 A 正确;B. 当溴化亚铁与氯气 5:3 反应时,其反应的离子方程式为2+-+ 6Cl3+10Fe +2Br2=10Fe +Br 2+12Cl -,故 B 正确;C. 由分析可知,氯气先与亚铁离子反应,所以离子方程式中一定有亚铁离子参与,故 C 错误;D. 当通入过量氯气时,氯气能将亚铁离子和溴离子都氧化,反应的离子方程式为 2Fe 2++4Br -+ 3Cl 2=2Br 2+ 2Fe 3++ 6Cl -,故 D 正确;综上所述,答案为C 。
2. 有一份澄清溶液,可能含有 Na + 、 K +、 NH 4+、 Ca 2+ 、Fe 3 +、 SO 42- 、 CO 32- 、 SO 32- 、Cl - 、-中的若干种,且离子的物质的量浓度均为-I 0.1mol L ·1(不考虑水解和水的电离 )。
往该溶液 中加入过量的盐酸酸化 BaCl 2 溶液,无沉淀生成。
另取少量原溶液,设计并完成如下实验:则关于原溶液的判断中不正确的是A .是否存在 ++Na 、 K 需要通过焰色反应来确定4层的颜色变化,能判断出溶液中-肯定存在B .通过 CCl IC .试样加足量氯水无气体产生,说明溶液中32-肯定不存在COD .肯定不存在的离子是Ca 2+ 、 Fe 3+、 SO 4 2- 、 CO 32- 、 Cl -【答案】 A【解析】【分析】澄清溶液,往该溶液中加入过量的 BaCl 2 和盐酸的混合溶液,无白色沉淀生成,无SO 42-,加足量氯水,无气体,则无 CO 32-,溶液加四氯化碳分液,下层紫红色,则有I -,上层加硝酸钡和稀硝酸有白色沉淀,有SO 32- ,无 Ca 2+、 Fe 3+,溶液中一定含阳离子,且离子浓度都为 0.1mol?L -1 ;根据电荷守恒,一定含有 NH 4+、 Na +、 K +,一定不存在 Cl -;滤液中加硝酸酸化的硝酸银有白色沉淀,是过程中加氯水时引入的氯离,结合溶液为电中性来解答。

(化学)高考化学离子反应真题汇编(含答案)一、高中化学离子反应1.向含有FeBr 2溶液中通入一定量的Cl 2(还原性:Fe 2+>Br -),表示该反应的离子方程式肯定错误的是( ) A .2Fe 2++Cl 2=2Fe 3++2Cl -B .10Fe 2++2Br -+6Cl 2=10Fe 3++Br 2+12Cl -C .2Br -+Cl 2=Br 2+2Cl -D .2Fe 2++4Br -+3Cl 2=2Br 2+2Fe 3++6Cl - 【答案】C 【解析】 【分析】还原性:Fe 2+>Br -,则向含有FeBr 2溶液中通入一定量的Cl 2时,氯气先与Fe 2+反应,后与Br -反应。
【详解】A .当通入少量的氯气时,氯气只与亚铁离子反应,其反应的离子方程式为2Fe 2++Cl 2=2Fe 3++2Cl -,故A 正确;B .当溴化亚铁与氯气5:3反应时,其反应的离子方程式为10Fe 2++2Br -+6Cl 2=10Fe 3++Br 2+12Cl -,故B 正确;C .由分析可知,氯气先与亚铁离子反应,所以离子方程式中一定有亚铁离子参与,故C 错误;D .当通入过量氯气时,氯气能将亚铁离子和溴离子都氧化,反应的离子方程式为2Fe 2++4Br -+3Cl 2=2Br 2+2Fe 3++6Cl -,故D 正确; 综上所述,答案为C 。
2.X 溶液中含有下表所示离子中的某5种,且其离子浓度均为10.1mol L -⋅(不考虑水的电离和离子水解)。
向X 溶液中加入足量稀盐酸,有气体生成,反应前后阴离子种类不变。
下列叙述错误的是( )A .原溶液中一定含有2Mg +B .X 溶液中不可能含有3HCO -和23CO -C .X 溶液中含有3种阳离子、2种阴离子D .生成气体的离子反应方程式为23323Fe NO 4H 3Fe NO 2H O +-++++=+↑+【答案】C【分析】各种离子的物质的量浓度均为0.1mol/L ,向溶液X 中加入足量的盐酸,有气体生成,且反应溶液中阴离子的种类没有变化,产生气体不可能是二氧化碳,则不含OH -、HCO 3-和CO 32-;根据表中的离子,可推知是Fe 2+、NO 3-在酸性环境下生成的一氧化氮,加入盐酸,生成气体的离子反应方程式为23323FeNO 4H 3Fe NO 2H O +-++++=+↑+,NO 3-反应后有剩余,故溶液中阴离子种类不变,所以原来溶液中含有Cl ﹣。


最新高中化学离子反应真题汇编(含答案)1(1)一、高中化学离子反应1.有一份澄清溶液,可能含有 Na+、K+、NH4+、Ca2+、Fe3+、SO42-、CO32-、SO32-、Cl-、I-中的若干种,且离子的物质的量浓度均为 0.1mol·L-1(不考虑水解和水的电离)。
往该溶液中加入过量的盐酸酸化 BaCl2溶液,无沉淀生成。
另取少量原溶液,设计并完成如下实验:则关于原溶液的判断中不正确的是A.是否存在 Na+、K+需要通过焰色反应来确定B.通过 CCl4层的颜色变化,能判断出溶液中 I-肯定存在C.试样加足量氯水无气体产生,说明溶液中 CO32-肯定不存在D.肯定不存在的离子是 Ca2+、Fe3+、SO42-、CO32-、Cl-【答案】A【解析】【分析】澄清溶液,往该溶液中加入过量的BaCl2和盐酸的混合溶液,无白色沉淀生成,无SO42-,加足量氯水,无气体,则无CO32-,溶液加四氯化碳分液,下层紫红色,则有I-,上层加硝酸钡和稀硝酸有白色沉淀,有SO32-,无Ca2+、Fe3+,溶液中一定含阳离子,且离子浓度都为0.1mol•L-1;根据电荷守恒,一定含有NH4+、Na+、K+,一定不存在Cl-;滤液中加硝酸酸化的硝酸银有白色沉淀,是过程中加氯水时引入的氯离,结合溶液为电中性来解答。
【详解】A. 根据溶液中离子浓度均为0.1mol/L,且溶液呈电中性,溶液中一定存在 Na+、K+,不需要焰色反应来确定,A项错误;B. 通过CCl4 层的颜色变化,能判断出溶液中 I-肯定存在,B项正确;C. 试样加足量的Cl2水,没有气体产生,说明无CO32-,C项正确;D. 由分析可知,肯定不存在的离子是Ca2+、Fe3+、SO42-、CO32-、Cl-,D项正确;答案选A。
2.某溶液可能含有Cl-、SO42-、CO32-、NH4+、Al3+、Cu2+、Fe3+和K+中的若干种。
为检验其中含有的离子,进行如下实验:取该溶液10mL,加入过量的氢氧化钡溶液并加热,产生使湿润的红色石蕊试纸变蓝色的气体,同时产生白色沉淀,过滤;向上述滤液中通入足量CO2气体,产生白色沉淀。
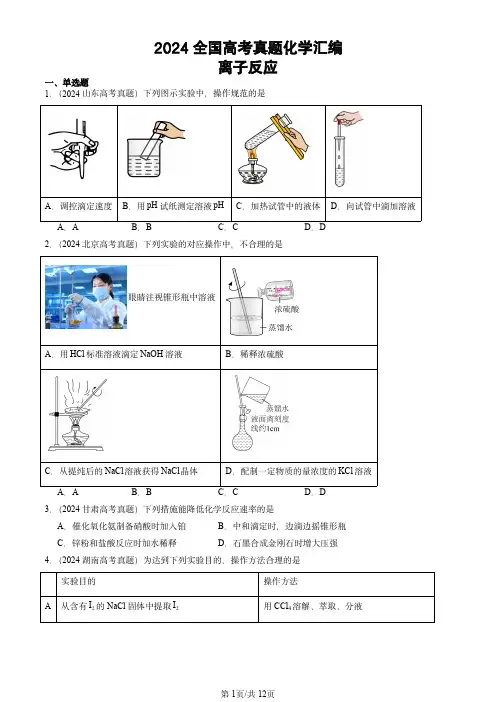
2024全国高考真题化学汇编离子反应一、单选题1.(2024山东高考真题)下列图示实验中,操作规范的是A.调控滴定速度B.用pH试纸测定溶液pH C.加热试管中的液体D.向试管中滴加溶液A.A B.B C.C D.D2.(2024北京高考真题)下列实验的对应操作中,不合理的是眼睛注视锥形瓶中溶液3.(2024甘肃高考真题)下列措施能降低化学反应速率的是A.催化氧化氨制备硝酸时加入铂B.中和滴定时,边滴边摇锥形瓶C.锌粉和盐酸反应时加水稀释D.石墨合成金刚石时增大压强4.(2024湖南高考真题)为达到下列实验目的,操作方法合理的是实验目的操作方法A从含有2I的NaCl固体中提取2I用CCl4溶解、萃取、分液B 提纯实验室制备的乙酸乙酯依次用NaOH 溶液洗涤、水洗、分液、干燥C 用NaOH 标准溶液滴定未知浓度的3CH COOH 溶液用甲基橙作指示剂进行滴定D从明矾过饱和溶液中快速析出晶体用玻璃棒摩擦烧杯内壁A .AB .BC .CD .D5.(2024全国高考真题)对于下列过程中发生的化学反应,相应离子方程式正确的是A .试管壁上的银镜用稀硝酸清洗:322Ag 2H NO Ag NO H OB .工业废水中的2Pb 用FeS 去除:22Pb S PbSC .海水提溴过程中将溴吹入2SO 吸收塔:22224Br SO 2H O 2Br SO 4HD .用草酸标准溶液测定高锰酸钾溶液的浓度:22424222MnO 5C O 16H 2Mn 10CO 8H O6.(2024浙江高考真题)室温下,2H S 水溶液中各含硫微粒物质的量分数δ随pH 变化关系如下图[例如22-2-2c H S δH S =c HS +c HS +c S]。
已知: -18-17sp sp 2K (FeS)=6.310K Fe(OH)=4.910 ,。
下列说法正确的是A .溶解度:FeS 大于2Fe(OH)B .以酚酞为指示剂(变色的pH 范围8.2~10.0),用NaOH 标准溶液可滴定2H S 水溶液的浓度C .忽略2-S 的第二步水解,0.10mol/L 的2Na S 溶液中2-S 水解率约为62%D .0.010mol/L 的2FeCl 溶液中加入等体积0.20mol/L 的2Na S 溶液,反应初始生成的沉淀是FeS 7.(2024浙江高考真题)在溶液中能大量共存的离子组是A .+-2+-3H I Ba NO 、、、B .3++--Fe K CN Cl 、、、C .+2--2+3Na SiO Br Ca、、、D .+2---4433NH SO CH COO HCO 、、、二、解答题8.(2024全国高考真题) 2222CO NH H O (俗称过氧化脲)是一种消毒剂,实验室中可用尿素与过氧化氢制取,反应方程式如下:22222222CO NH +H O =CO NH H O (一)过氧化脲的合成烧杯中分别加入 -32225mL30%H O ρ=1.11g cm、40mL 蒸馏水和12.0g 尿素,搅拌溶解。

高中化学离子反应真题汇编(含答案)含解析(1)一、高中化学离子反应1.某溶液仅含Fe2+、Na+、Al3+、SO42-、NO3-、Cl-中的4种离子,所含离子的物质的量均为1mol。
若向该溶液中加入过量的稀硫酸,有气泡产生,且溶液中阴离子种类不变(不考虑水的电离和离子的水解),下列说法不正确的是A.若向该溶液中加入足量的NaOH溶液,充分反应后,过滤、洗涤、灼烧最终所得固体质量为72gB.若向该溶液中加入过量的稀硫酸,产生的气体遇空气能变成红棕色C.该溶液中所含的离子是:Fe2+、Na+、SO42-、NO3-D.若向该溶液中加入过量的稀硫酸和KSCN溶液,溶液显血红色【答案】A【解析】【分析】加入过量的稀硫酸,有气泡产生,且溶液中阴离子种类不变,气体只能为NO,为Fe2+、NO3-之间氧化还原反应生成的,由于阴离子种类不变,则原溶液中一定存在SO42-,又溶液中含有四种离子,所含离子的物质的量均为1mol,根据电荷守恒,一定还含有带一个单位正电荷的阳离子,即一定含有Na+,据此分析作答。
【详解】A.向该溶液中加入足量的NaOH溶液,充分反应后,过滤、洗涤、灼烧,最终所得固体为氧化铁,其质量为:0.5mol×160g/mol=80g,A选项错误;B.若向该溶液中加入过量的稀硫酸,生成的气体为一氧化氮,NO易被氧化成红棕色的二氧化氮,B选项正确;C.根据以上分析可知,该溶液中所含的离子是:Fe2+、Na+、SO42-、NO3-,C选项正确;D.该溶液中加入硫酸,硝酸根离子在酸性条件下具有氧化性,将亚铁离子氧化成铁离子,铁离子与KSCN溶液反应显血红色,D选项正确;答案选A。
2.有一份澄清溶液,可能含有 Na+、K+、NH4+、Ca2+、Fe3+、SO42-、CO32-、SO32-、Cl-、I-中的若干种,且离子的物质的量浓度均为 0.1mol·L-1(不考虑水解和水的电离)。
往该溶液中加入过量的盐酸酸化 BaCl2溶液,无沉淀生成。


高考化学离子反应真题汇编(含答案)含解析1(1)一、高中化学离子反应1.某白色粉末由两种物质组成,为鉴别其成分进行如下实验:①取少量样品加入足量水仍有部分固体未溶解;再加入足量稀盐酸,有气泡产生,固体全部溶解;②取少量样品加入足量稀硫酸有气泡产生,振荡后仍有固体存在。
该白色粉末可能为 A .NaHCO 3、Al (OH )3 B .AgCl 、NaHCO 3C .Na 2SO 3、BaCO 3D .Na 2CO 3、CuSO 4【答案】C 【解析】 【详解】A . NaHCO 3、Al (OH )3中加入足量稀硫酸有气泡产生,生成硫酸钠、硫酸铝、二氧化碳和水,最终无固体存在,A 项错误;B .AgCl 不溶于酸,固体不能全部溶解,B 项错误;C .亚硫酸钠和碳酸钡溶于水,碳酸钡不溶于水使部分固体不溶解,加入稀盐酸,碳酸钡与盐酸反应生成氯化钡、二氧化碳和水,固体全部溶解,再将样品加入足量稀硫酸,稀硫酸和碳酸钡反应生成硫酸钡沉淀和二氧化碳和水,符合题意,C 项正确;D . Na 2CO 3、CuSO 4中加热足量稀硫酸,振荡后无固体存在,D 项错误; 答案选C 。
2.下列反应的离子方程式正确的是( )A .红褐色固体3Fe(OH)全部溶于氢碘酸:332Fe(OH)3H Fe 3H O +++=+B .水杨酸溶于3NaHCO 溶液中:C .将等浓度的2Ba(OH)溶液与4NaHSO 液按体积比2:3混合:224422Ba 2SO 3H 3OH 2BaSO 3H O +-+-+++=↓+D .洁厕灵(含HCl )与84消毒液混合后产生氯气:2Cl H ClO Cl OH -+--++=↑+ 【答案】C 【解析】 【分析】 【详解】A .Fe(OH)3溶于氢碘酸,Fe 3+会氧化I -得到I 2,正确的离子反应方程式应为:2Fe(OH)3+2I -+6H +===2Fe 2++6H 2O+I 2,A 选项错误;B .水杨酸中酚羟基不能与NaHCO 3发生反应,正确的离子反应方程式为:+HCO 3-→+CO 2↑+H 2O ,B 选项错误;C .等浓度的Ba(OH)2溶液与NaHSO 4溶液按体积比2:3,则两者物质的量之比为2:3,两者混合后,2molBa 2+消耗2molSO 42-,3molH +消耗3molOH -,反应的离子反应方程式为:224422Ba 2SO 3H 3OH 2BaSO 3H O +-+-+++=↓+,C 选项正确;D .84消毒液的主要成分是NaClO ,具有强氧化性,可还原洁厕灵中的HCl ,反应的离子反应方程式为:Cl -+ClO -+2H +===Cl 2↑+H 2O ,D 选项错误; 答案选C 。

【化学】高考化学离子反应真题汇编(含答案)及解析1(1)一、高中化学离子反应1.下列反应的离子方程式正确的是A.大理石溶于醋酸溶液中:CaCO3+2H+===Ca2++CO2↑+H2OB.往硫酸铜溶液中滴加氢氧化钡溶液:Ba2++2OH-+Cu2++SO42-===BaSO4↓+Cu(OH)2↓C.用FeCl3溶液腐蚀印刷电路板:Fe3++Cu===Fe2++Cu2+D.铁与稀盐酸反应:2Fe+6H+===2Fe3++3H2↑【答案】B【解析】【分析】离子方程式的书写错误,常见的有电荷不守恒、原子不守恒、反应产物写错、该拆的没拆、不该拆的拆了、反应没写全等等。
【详解】A.醋酸是弱酸,不能拆,A错误;B.同时生成了两种沉淀,B正确;C.两边电荷不守恒,C错误;D.铁与稀盐酸反应,应该生成Fe2+,D错误;答案选B。
2.某溶液中含有SO42-、SO32-、SiO32-、Br-、CO32-、Na+,向该溶液中通入过量的Cl2,下列判断正确的是①反应前后,溶液中离子浓度基本保持不变的有SO42-、Na+;②有胶状物质生成;③有气体产生;④溶液颜色发生变化;⑤共发生了2个氧化还原反应。
A.②③④B.①②③C.①③⑤D.②④⑤【答案】A【解析】【详解】向溶液中通入过量的Cl2,Cl2可以氧化SO32-成为SO42-,所以SO32-浓度降低,SO42-浓度增大,Cl2也可以和Br-发生置换反应,使Br-浓度降低,生成的溴溶于水中使溶液颜色发生变化,Cl2溶于水生成的盐酸还可以跟CO32-发生反应生成CO2,使CO32-浓度降低,和SiO32-生成H2SiO3白色胶状沉淀,使SiO32-浓度降低,所以离子浓度基本保持不变的只有Na+。
Cl2溶于溶液中发生了3个氧化还原反应,其中2个是Cl2分别和SO32-、Br-发生的,另一个是Cl2和水的歧化反应,所以②③④是正确的,故选A。
【点睛】Cl2和SO32-发生氧化还原反应,使SO32-浓度降低,还要考虑到生成了SO42-,使SO42-浓度增大,所以溶液中的SO32-、SO42-浓度都发生了变化。

(化学)高考化学离子反应题20套(带答案)1一、高中化学离子反应1.某校化学兴趣小组用如图所示过程除去AlCl 3溶液中含有的Mg 2+、K +杂质离子并尽可能减少AlCl 3的损失。
,下列说法正确的是( )A .NaOH 溶液可以用氨水来代替B .溶液a 中含有Al 3+、K +、Cl -、Na +、OH -C .溶液b 中只含有NaClD .向溶液a 中滴加盐酸需控制溶液的pH 【答案】D 【解析】 【分析】 【详解】A .用氨水,则Mg 2+、Al 3+均转化为沉淀,不能分离,则不能用氨水代替NaOH ,A 错误;B .Al 3+与过量NaOH 反应,溶液a 中含AlO 2-、K +、Cl -、Na +、OH -,B 错误;C .K +、Cl -、Na +在整个过程中不参加反应,则溶液b 中含KCl 、NaCl ,C 错误;D .因氢氧化铝能溶于盐酸,则向溶液a 中滴加盐酸需控制溶液的pH ,D 正确; 答案选D 。
【点睛】本题考查混合物分离、提纯实验方案的设计,为高频考点,把握实验流程中发生的反应为解答的关键,侧重分析与实验能力的考查,注意氢氧化铝的两性。
2.下列反应,不能用离子方程式:Ca 2++OH -+HCO 3-→CaCO 3↓+H 2O 表示的是A .碳酸氢钠与足量的氢氧化钙B .氢氧化钙与足量的碳酸氢钙C .碳酸氢钙与足量的氢氧化钠D .氢氧化钠与足量的碳酸氢钙【答案】C 【解析】 【分析】 【详解】A .碳酸氢钠与足量的氢氧化钙反应,3HCO -少量:2+332Ca +OH +HCO =CaCO +H O --;故A 正确;B .向碳酸氢钙中加入氢氧化钙,3HCO -先和OH -反应生成碳酸根,再结合钙离子生成沉淀: 2+332Ca +OH +HCO =CaCO +H O ↓--,故B 正确;C .碳酸氢钙与足量的氢氧化钠反应,碳酸氢钙少量,钙离子和3HCO -满足1:2关系:2+33322-Ca +2OH +2HCO =CaCO +CO H O +2↓--,故C 错误;D .氢氧化钠与足量的碳酸氢钙反应:2+332Ca +OH +HCO =CaCO +H O ↓--,故D 正确; 答案选C 。
2022-2024全国高考真题化学汇编离子反应一、单选题1.(2024浙江高考真题)下列物质不属于...电解质的是 A .2CO B .HCl C .NaOH D .4BaSO2.(2022浙江高考真题)下列物质属于非电解质的是A .CH 4B .KIC .NaOHD .CH 3COOH3.(2022全国高考真题)某白色粉末样品,可能含有24Na SO 、23Na SO 、223Na S O 和23Na CO 。
取少量样品进行如下实验:①溶于水,得到无色透明溶液①向①的溶液中滴加过量稀盐酸,溶液变浑浊,有刺激性气体逸出。
离心分离。
①取①的上层清液,向其中滴加2BaCl 溶液有沉淀生成。
该样品中确定存在的是A .24223Na SO Na S O 、B .23223Na SO Na S O 、C .2423Na SO Na CO 、D .2323Na SO Na CO 、4.(2023北京高考真题)下列离子方程式与所给事实不相符的是A .2Cl 制备84消毒液(主要成分是NaClO ):22Cl 2OH Cl ClO H O ---+=++B .食醋去除水垢中的3CaCO :2322CaCO 2H Ca H O CO +++=++↑C .利用覆铜板制作印刷电路板:3222Fe Cu 2Fe Cu ++++=+D .2Na S 去除废水中的2Hg +:22Hg S HgS +-+=↓二、多选题5.(2022湖南高考真题)下列离子方程式正确的是A .2Cl 通入冷的NaOH 溶液:---22Cl +2OH =Cl +ClO +H OB .用醋酸和淀粉-KI 溶液检验加碘盐中的-3IO :--+322O +5I +6H =3I +3H O IC .4FeSO 溶液中加入22H O 产生沉淀:+2+22232Fe +H O +4H O=2Fe(OH)+4H ↓D .3NaHCO 溶液与少量的2Ba(OH)溶液混合:-2+-332HCO +Ba +OH BaCO +H O =↓参考答案1.A【详解】A.CO2在水溶液中能导电,是生成的碳酸电离,不是自身电离,不属于电解质,A符合题意;B.HCl溶于水电离出离子导电,属于电解质,B不符合题意;C.NaOH在水溶液和熔融状态均能电离离子而导电,属于电解质,C不符合题意;D.BaSO4在熔融状态能电离离子而导电,属于电解质,D不符合题意;故选A。
高考化学离子反应各地方试卷集合汇编及解析1一、高中化学离子反应1.下列离子方程式书写及评价合理的是( )A.A B.B C.C D.D【答案】B【解析】【分析】【详解】A.Mg(HCO3)2溶液中加入足量NaOH溶液,反应生成碳酸钠、氢氧化镁沉淀和水,正确的离子方程式为:Mg2++2HCO3−+4OH−═Mg(OH)2↓+2CO32−+2H2O,故A错误;B.1mol/L的NaAlO2溶液和2.5mol/L的HCl溶液等体积互相均匀混合,设溶液体积为1L,偏铝酸钠和HCl的物质的量分别为1mol、2.5mol,1mol偏铝酸钠消耗1molHCl生成1mol 氢氧化铝,剩余的1.5molHCl能够溶解0.5mol氢氧化铝,反应的离子方程式为:2AlO2−+5H+═Al3++Al(OH)3↓+H2O,故B正确;C.Fe3O4与过量的稀HNO3反应,生成的亚铁离子被稀硝酸氧化成了铁离子,正确的离子方程式为:3Fe3O4+NO3−+28H+═9Fe3++14H2O+NO↑,故C错误;D.NaClO溶液与FeCl2溶液混合,二者发生氧化还原反应,正确的离子反应为:2Fe2++5ClO−+5H2O═2Fe(OH)3↓+Cl−+4HClO,故D错误;答案选B 。
2.向0.02mol·L -1CuSO 4溶液中匀速滴加1mol·L -1氨水,先观察到有浅蓝色沉淀[Cu 2(OH)2SO 4]生成,后沉淀溶解,逐渐变为深蓝色溶液。
该实验过程体系的pH 和电导率随时间的变化如图所示。
下列说法正确的是A .c(Cu 2+):a 点=b 点B .bc 段生成浅蓝色沉淀的反应为-2-42+4222Cu +2OH +SO =Cu (OH)SO ↓ C .d 点时:()()+2-44c NH <2c SO D .导电能力:()2++434NH >Cu NH ⎡⎤⎣⎦ 【答案】D 【解析】 【分析】c 到d 溶液pH 突变,说明c 点沉淀达到最大值,a 到c 发生生成沉淀的反应:2-2++32422442Cu +2NH H O+SO =Cu (OH)SO 2NH ↓+⋅,c 到e 发生沉淀溶解反应:224Cu (OH)SO +328NH H O ⋅=2()234Cu NH +⎡⎤⎣⎦+8H 2O+SO 42-+2OH -,据此分析解答。
2014年—2023年高考化学离子反应真题汇编+答案(真题部分)1.(2023湖南,5,3分)下列有关电极方程式或离子方程式错误的是()A.碱性锌锰电池的正极反应:MnO2+H2O+e-MnO(OH)+OH-B.铅酸蓄电池充电时的阳极反应:Pb2++2H2O-2e-PbO2+4H+C.K3[Fe(CN)6]溶液滴入FeCl2溶液中:K++Fe2++[Fe(CN)6]3-KFe[Fe(CN)6]↓D.TiCl4加入水中:TiCl4+(x+2)H2O TiO2·xH2O↓+4H++4Cl-2.(2023浙江1月选考,7,3分)下列反应的离子方程式不正确...的是()A.Cl2通入氢氧化钠溶液:Cl2+2OH-Cl-+ClO-+H2OB.氧化铝溶于氢氧化钠溶液:Al2O3+2OH-2Al O2-+H2OC.过量CO2通入饱和碳酸钠溶液:2Na++C O32-+CO2+H2O2NaHCO3↓D.H2SO3溶液中滴入氯化钙溶液:S O32-+Ca2+CaSO3↓3.(2022湖南,11,4分)(双选)下列离子方程式正确的是()A.Cl2通入冷的NaOH溶液:Cl2+2OH-Cl-+ClO-+H2OB.用醋酸和淀粉-KI溶液检验加碘盐中的I O3−:I O3−+5I-+6H+3I2+3H2OC.FeSO4溶液中加入H2O2产生沉淀:2Fe2++H2O2+4H2O2Fe(OH)3↓+4H+D.NaHCO3溶液与少量的Ba(OH)2溶液混合:HC O3−+Ba2++OH-BaCO3↓+H2O4.(2022全国甲,9,6分)能正确表示下列反应的离子方程式为()A.硫化钠溶液和硝酸混合:S2-+2H+H2S↑B.明矾溶液与过量氨水混合:Al3++4NH3+2H2O Al O2−+4N H4+C.硅酸钠溶液中通入二氧化碳:Si O32−+CO2+H2O HSi O3−+HC O3−D.将等物质的量浓度的Ba(OH)2和NH4HSO4溶液以体积比1∶2混合:Ba2++2OH-+2H++S O42−BaSO4↓+2H2O5.(2022浙江1月选考,13,2分)下列实验对应的离子方程式不正确的是()A.将碳酸氢钙溶液与过量的澄清石灰水混合:HC O3−+Ca2++OH-CaCO3↓+H2OB.将少量NO2通入NaOH溶液:2NO2+2OH-N O3−+N O2−+H2OC.将少量SO2通入NaClO溶液:SO2+H2O+2ClO-S O32−+2HClOD.向氨水中滴入少量硝酸银溶液:Ag++2NH3·H2O Ag(NH3)2++2H2O6.(2022浙江6月选考,13,2分)下列反应的离子方程式不正确...的是()A.盐酸中滴加Na2SiO3溶液:Si O32−+2H+H2SiO3↓B.Na2CO3溶液中通入过量SO2:C O32−+2SO2+H2O2HS O3−+CO2C.乙醇与K2Cr2O7酸性溶液反应:3CH3CH2OH+2Cr2O72−+16H+ 3CH3COOH+4Cr3++11H2OD.溴与冷的NaOH溶液反应:Br2+OH-Br-+BrO-+H+7.(2022湖北,4,3分)下列各组离子在给定溶液中能大量共存的是()A.在0.1 mol·L-1氨水中:Ag+、Cu2+、N O3−、S O32−B.在0.1 mol·L-1氯化钠溶液中:Fe3+、I-、Ba2+、HC O3−C.在0.1 mol·L-1醋酸溶液中:S O42−、N H4+、Br-、H+D.在0.1 mol·L-1硝酸银溶液中:K+、Cl-、Na+、C O32−8.(2019海南单科,11,4分)(双选)能正确表示下列反应的离子方程式为()A.向FeBr2溶液中通入过量Cl2:2Fe2++Cl22Fe3++2Cl-B.向碳酸钠溶液中通入少量CO2:C O32−+CO2+H2O2HC O3-C.向碘化钾溶液中加入少量双氧水:3H2O2+I-I O3-+3H2OD.向硫化钠溶液中通入过量SO2:2S2-+5SO2+2H2O3S↓+4HS O3-9.(2019浙江4月选考,13,2分)不能..正确表示下列变化的离子方程式是()A.二氧化硫与酸性高锰酸钾溶液反应:5SO2+2H2O+2Mn O4-2Mn2++5S O42−+4H+B.酸性碘化钾溶液中滴加适量双氧水:2I-+2H++H2O2I2+2H2OC.硅酸钠溶液和盐酸反应:Si O32−+2H+H2SiO3↓D.硫酸铜溶液中加少量的铁粉:3Cu2++2Fe2Fe3++3Cu10.(2018浙江4月选考,13,2分)下列离子方程式正确的是()A.大理石与醋酸反应:C O32−+2CH3COOH2CH3COO-+H2O+CO2↑B.高锰酸钾与浓盐酸制氯气的反应:Mn O4-+4Cl-+8H+Mn2++2Cl2↑+4H2OC.漂白粉溶液吸收少量二氧化硫气体:SO2+H2O+ClO-S O42−+Cl-+2H+D.氢氧化钠溶液与过量的碳酸氢钙溶液反应:OH-+Ca2++HC O3-CaCO3↓+H2O11.(2017江苏单科,6,2分)下列指定反应的离子方程式正确的是()A.钠与水反应:Na+2H2O Na++2OH-+H2↑B.电解饱和食盐水获取烧碱和氯气:2Cl-+2H2O H2↑+Cl2↑+2OH-C.向氢氧化钡溶液中加入稀硫酸:Ba2++OH-+H++S O42−BaSO4↓+H2OD.向碳酸氢铵溶液中加入足量石灰水:Ca2++HC O3-+OH-CaCO3↓+H2O12.(2016海南单科,3,2分)下列反应可用离子方程式“H++OH-H2O”表示的是()A.NaHSO4溶液与Ba(OH)2溶液混合B.NH4Cl溶液与Ca(OH)2溶液混合C.HNO3溶液与KOH溶液混合D.Na2HPO4溶液与NaOH溶液混合13.(2015江苏单科,6,2分)常温下,下列各组离子一定能在指定溶液中大量共存的是()A.使酚酞变红色的溶液中:Na+、Al3+、S O42−、Cl-=1×10-13 mol·L-1的溶液中:N H4+、Ca2+、Cl-、N O3-B. K Wc(H+)C.与Al反应能放出H2的溶液中:Fe2+、K+、N O3-、S O42−D.水电离的c(H+)=1×10-13 mol·L-1的溶液中:K+、Na+、Al O2-、C O32−14.(2015安徽理综,10,6分)下列有关NaClO和NaCl混合溶液的叙述正确的是()A.该溶液中,H+、N H4+、S O42−、Br-可以大量共存B.该溶液中,Ag+、K+、N O3-、CH3CHO可以大量共存C.向该溶液中滴入少量FeSO4溶液,反应的离子方程式为:2Fe2++ClO-+2H+Cl-+2Fe3++H2OD.向该溶液中加入浓盐酸,每产生1 mol Cl2,转移电子约为6.02×1023个15.(2015广东理综,8,4分)水溶液中能大量共存的一组离子是()A.N H4+、Ba2+、Br-、C O32−B.Cl-、S O32−、Fe2+、H+C.K+、Na+、S O42−、Mn O4-D.Na+、H+、N O3-、HC O3-16.(2015江苏单科,9,2分)下列指定反应的离子方程式正确的是()A.氯气溶于水:Cl2+H2O2H++Cl-+ClO-B.Na2CO3溶液中C O32−的水解:C O32−+H2O HC O3-+OH-C.酸性溶液中KIO3与KI反应生成I2:I O3-+I-+6H+I2+3H2OD.NaHCO3溶液中加足量Ba(OH)2溶液:HC O3-+Ba2++OH-BaCO3↓+H2O17.(2015山东理综,12,5分)下列表示对应化学反应的离子方程式正确的是()A.向稀HNO3中滴加Na2SO3溶液:S O32−+2H+SO2↑+H2OB.向Na2SiO3溶液中通入过量SO2:Si O32−+SO2+H2O H2SiO3↓+S O32−C.向Al2(SO4)3溶液中加入过量NH3·H2O:Al3++4NH3·H2O[Al(OH)4]-+4N H4+D.向CuSO4溶液中加入Na2O2:2Na2O2+2Cu2++2H2O4Na++2Cu(OH)2↓+O2↑18.(2015四川理综,2,6分)下列有关CuSO4溶液的叙述正确的是()A.该溶液中Na+、N H4+、N O3-、Mg2+可以大量共存B.通入CO2气体产生蓝色沉淀C.与H2S反应的离子方程式:Cu2++S2-CuS↓D.与过量浓氨水反应的离子方程式:Cu2++2NH3·H2O Cu(OH)2↓+2N H4+19.(2014大纲全国,11,6分)下列离子方程式错误..的是()A.向Ba(OH)2溶液中滴加稀硫酸:Ba2++2OH-+2H++S O42−BaSO4↓+2H2OB.酸性介质中KMnO4氧化H2O2:2Mn O4-+5H2O2+6H+2Mn2++5O2↑+8H2OC.等物质的量的MgCl2、Ba(OH)2和HCl溶液混合:Mg2++2OH-Mg(OH)2↓D.铅酸蓄电池充电时的正极反应:PbSO4+2H2O-2e-PbO2+4H++S O42−20.(2014江苏单科,7,2分)下列指定反应的离子方程式正确的是()A.Cu溶于稀HNO3:Cu+2H++N O3-Cu2++NO2↑+H2OB.(NH4)2Fe(SO4)2溶液与过量NaOH溶液反应制Fe(OH)2:Fe2++2OH-Fe(OH)2↓C.用CH3COOH溶解CaCO3:CaCO3+2H+Ca2++H2O+CO2↑D.向NaAlO2溶液中通入过量CO2制Al(OH)3:CO2+Al O2-+2H2OAl(OH)3↓+HC O3-21.(2014北京理综,9,6分)下列解释事实的方程式不正确...的是()A.测0.1 mol/L氨水的pH为11:NH3·H2O N H4++OH-B.将Na块放入水中,产生气体:2Na+2H2O2NaOH+H2↑C.用CuCl2溶液做导电实验,灯泡发光:CuCl2Cu2++2Cl-D.Al片溶于NaOH溶液中,产生气体:2Al+2OH-+2H2O2Al O2-+3H2↑22.(2014四川理综,3,6分)能正确表示下列反应的离子方程式是()A.Cl2通入NaOH溶液:Cl2+OH-Cl-+ClO-+H2OB.NaHCO3溶液中加入稀盐酸:C O32−+2H+CO2↑+H2OC.AlCl3溶液中加入过量稀氨水:Al3++4NH3·H2O Al O2-+4N H4++2H2OD.Cu溶于稀HNO3:3Cu+8H++2N O3-3Cu2++2NO↑+4H2O23.(2014江苏单科,3,2分)25 ℃时,下列各组离子在指定溶液中一定能大量共存的是()A.pH=1的溶液中:Na+、K+、Mn O4-、C O32−B.c(H+)=1×10-13 mol·L-1的溶液中:Mg2+、Cu2+、S O42−、N O3-C.0.1 mol·L-1 NH4HCO3溶液中:K+、Na+、N O3-、Cl-D.0.1 mol·L-1 FeCl3溶液中:Fe2+、N H4+、SCN-、S O42−24.(2014山东理综,12,5分)下列有关溶液组成的描述合理的是()A.无色溶液中可能大量存在Al3+、N H4+、Cl-、S2-B.酸性溶液中可能大量存在Na+、ClO-、S O42−、I-C.弱碱性溶液中可能大量存在Na+、K+、Cl-、HC O3-D.中性溶液中可能大量存在Fe3+、K+、Cl-、S O42−25.(2014广东理综,8,4分)水溶液中能大量共存的一组离子是()A.Na+、Ca2+、Cl-、S O42−B.Fe2+、H+、S O32−、ClO-C.Mg2+、N H4+、Cl-、S O42−D.K+、Fe3+、N O3-、SCN-2014年—2023年高考化学离子反应真题汇编+答案(真题部分)1.B2.D3. AC4. D5. C6. D7. C8. BD9. D10. D11. B12. C13. B14. D15. C16. D17. D18. A19. C20. D21. C22. D23. C24. C25. C。
(化学)高考化学离子反应题20套(带答案)及解析一、高中化学离子反应1.向含有FeBr2溶液中通入一定量的Cl2(还原性:Fe2+>Br-),表示该反应的离子方程式肯定错误的是()A.2Fe2++Cl2=2Fe3++2Cl-B.10Fe2++2Br-+6Cl2=10Fe3++Br2+12Cl-C.2Br-+Cl2=Br2+2Cl-D.2Fe2++4Br-+3Cl2=2Br2+2Fe3++6Cl-【答案】C【解析】【分析】还原性:Fe2+>Br-,则向含有FeBr2溶液中通入一定量的Cl2时,氯气先与Fe2+反应,后与Br-反应。
【详解】A.当通入少量的氯气时,氯气只与亚铁离子反应,其反应的离子方程式为2Fe2++Cl2=2Fe3++2Cl-,故A正确;B.当溴化亚铁与氯气5:3反应时,其反应的离子方程式为10Fe2++2Br-+6Cl2=10Fe3++Br2+12Cl-,故B正确;C.由分析可知,氯气先与亚铁离子反应,所以离子方程式中一定有亚铁离子参与,故C错误;D.当通入过量氯气时,氯气能将亚铁离子和溴离子都氧化,反应的离子方程式为2Fe2++4Br-+3Cl2=2Br2+2Fe3++6Cl-,故D正确;综上所述,答案为C。
2.某固体混合物X,含有NH4NO3、AgNO3、Cu(NO3)2和NaNO3中的一种或几种,进行如下实验:①取少量X溶于水,逐滴加入NaOH溶液直至过量,先出现沉淀Y,后沉淀溶解得到溶液Z,并释放出能使湿润红色石蕊试纸变蓝的气体A;②往溶液Z中逐滴加入稀盐酸直至过量,先产生沉淀,后沉淀全部溶解。
下列说法不正确...的是()A.气体A为NH3,溶液Z呈碱性B.通过上述实验无法确定是否存在NaNO3C.X中一定有NH4NO3和Cu(NO3)2,且n(NH4NO3) ≥ 4n[Cu(NO3)2]D.向X中中直接加入过量稀盐酸,最终固体能全部溶解【答案】C【解析】【分析】①能使湿润红色石蕊试纸变蓝的气体为氨气,则由①可知:混合物X中一定有NH4NO3,因出现沉淀Y,则至少含Cu(NO3)2、AgNO3的一种,沉淀Y至少含AgOH、Cu(OH)2中的一种,Z 至少含[Ag(NH 3)2]+、[Cu(NH 3)4]2+中的一种;②往溶液Z 中逐滴加入稀盐酸直至过量,先产生沉淀,后沉淀全部溶解,则Z 中含[Cu(NH 3)4]2+,不含[Ag(NH 3)2]+,沉淀Y 为Cu(OH)2,混合物X 中一定有Cu(NO 3)2,一定不含AgNO 3;③综上所述,混合物X 中一定有Cu(NO 3)2和NH 4NO 3,一定不含AgNO 3,可能含有NaNO 3,发生如下反应:Cu(NO 3)2+2NaOH=Cu(OH)2↓+2NaNO 3,NH 4NO 3+NaOH=NaNO 3+NH 3↑+H 2O ,Cu(OH)2+4NH 3=[Cu(NH 3)4]2++2OH -,据此解答。
(化学)高考化学离子反应真题汇编(含答案)含解析1一、高中化学离子反应1.下列离子方程式中正确的是A .向 CH 2BrCOOH 中加入足量的氢氧化钠溶液并加热:Δ--222CH BrCOOH +OH CH BrCOO +H O −−→B .用氢氧化钠溶液除去铝片表面的氧化膜:Al 3++4OH -→AlO 2-+2H 2OC .次氯酸钠溶液中通入少量的CO 2气体:ClO -+CO 2+H 2O→HClO+HCO 3-D .等体积、等浓度的Ca (HCO )2溶液和NaOH 溶液混合:2+2--2-3332Ca +2HCO +2OH CaCO +CO +2H O →↓【答案】C【解析】【分析】【详解】A .向CH 2BrCOOH 中加入足量的氢氧化钠溶液并加热,羧基和氢氧化钠发生中和反应,溴原子在碱中发生水解反应,反应的化学方程式为:CH 2BrCOOH+2OH -CH 2(OH)COO -+H 2O ,A 选项错误;B .用氢氧化钠溶液除去铝片表面的氧化膜,氧化膜的成分为氧化铝,反应的离子方程式为:Al 2O 3+2OH -===2AlO 2-+H 2O ,B 选项错误;C .次氯酸钠溶液中通入少量的CO 2气体,次氯酸的酸性大于碳酸氢根,则次氯酸钠与二氧化碳反应生成碳酸氢根,反应的方程式为:ClO -+CO 2+H 2O→HClO+HCO 3-,C 选项正确;D .等体积、等浓度的Ca(HCO)2溶液和NaOH 溶液反应,Ca 2+和OH -为1:1,正确的离子反应方程式为Ca 2++HCO 3-+OH -===CaCO 3↓+H 2O ,D 选项错误;答案选C 。
【点睛】判断离子反应方程式的正误,关键在于抓住离子反应方程式是否符合客观事实、化学式的拆分是否准确、是否遵循质量守恒和电荷守恒、氧化还原反应中得失电子是否守恒等。
2.某固体混合物X ,含有NH 4NO 3、AgNO 3、Cu(NO 3)2和NaNO 3中的一种或几种,进行如下实验:①取少量X 溶于水,逐滴加入NaOH 溶液直至过量,先出现沉淀Y ,后沉淀溶解得到溶液Z ,并释放出能使湿润红色石蕊试纸变蓝的气体A ;②往溶液Z 中逐滴加入稀盐酸直至过量,先产生沉淀,后沉淀全部溶解。
高中化学离子反应真题汇编(含答案)及解析一、高中化学离子反应1.向0.02mol·L -1CuSO 4溶液中匀速滴加1mol·L -1氨水,先观察到有浅蓝色沉淀[Cu 2(OH)2SO 4]生成,后沉淀溶解,逐渐变为深蓝色溶液。
该实验过程体系的pH 和电导率随时间的变化如图所示。
下列说法正确的是A .c(Cu 2+):a 点=b 点B .bc 段生成浅蓝色沉淀的反应为-2-42+4222Cu +2OH +SO =Cu (OH)SO ↓ C .d 点时:()()+2-44c NH <2c SO D .导电能力:()2++434NH >Cu NH ⎡⎤⎣⎦ 【答案】D 【解析】 【分析】c 到d 溶液pH 突变,说明c 点沉淀达到最大值,a 到c 发生生成沉淀的反应:2-2++32422442Cu +2NH H O+SO =Cu (OH)SO 2NH ↓+⋅,c 到e 发生沉淀溶解反应:224Cu (OH)SO +328NH H O ⋅=2()234Cu NH +⎡⎤⎣⎦+8H 2O+SO 42-+2OH -,据此分析解答。
【详解】A .a 到b 发生2-2++32422442Cu +2NH H O+SO =Cu (OH)SO 2NH ↓+⋅,c(Cu 2+)减小,故c(Cu 2+):a 点>b 点,A 错误; B .bc 段生成浅蓝色沉淀的反应为2-2++32422442Cu +2NH H O+SO =Cu (OH)SO 2NH ↓+⋅、而不是-2-42+4222Cu +2OH +SO =Cu (OH)SO ↓,B 错误;C .c 点沉淀达到最大值,此时溶质为(NH 4)2SO 4,c 到d ,pH 突变,但导电率几乎不变,故d 点,溶质为(NH 4)2SO 4和32NH H O ⋅,那么d 点溶液中电荷守恒为:c(NH 4+)+c(H +)=c(OH -)+2c(SO 42-),因此时pH >7,c(H +)<c(OH -),故c(NH 4+)>2c(SO 42-),C 错误;D .b ’点之前释放NH 4+,导电能力增强,b ’之后释放()2+34Cu NH ⎡⎤⎣⎦和OH -,导电能力降低,说明导电能力()2++434NH >Cu NH ⎡⎤⎣⎦,D 正确。
高考化学离子反应真题汇编(含答案)及解析1一、高中化学离子反应1.向0.02mol·L -1CuSO 4溶液中匀速滴加1mol·L -1氨水,先观察到有浅蓝色沉淀[Cu 2(OH)2SO 4]生成,后沉淀溶解,逐渐变为深蓝色溶液。
该实验过程体系的pH 和电导率随时间的变化如图所示。
下列说法正确的是A .c(Cu 2+):a 点=b 点B .bc 段生成浅蓝色沉淀的反应为-2-42+4222Cu +2OH +SO =Cu (OH)SO ↓ C .d 点时:()()+2-44c NH <2c SO D .导电能力:()2++434NH >Cu NH ⎡⎤⎣⎦ 【答案】D 【解析】 【分析】c 到d 溶液pH 突变,说明c 点沉淀达到最大值,a 到c 发生生成沉淀的反应:2-2++32422442Cu +2NH H O+SO =Cu (OH)SO 2NH ↓+⋅,c 到e 发生沉淀溶解反应:224Cu (OH)SO +328NH H O ⋅=2()234Cu NH +⎡⎤⎣⎦+8H 2O+SO 42-+2OH -,据此分析解答。
【详解】A .a 到b 发生2-2++32422442Cu +2NH H O+SO =Cu (OH)SO 2NH ↓+⋅,c(Cu 2+)减小,故c(Cu 2+):a 点>b 点,A 错误; B .bc 段生成浅蓝色沉淀的反应为2-2++32422442Cu +2NH H O+SO =Cu (OH)SO 2NH ↓+⋅、而不是-2-42+4222Cu +2OH +SO =Cu (OH)SO ↓,B 错误;C .c 点沉淀达到最大值,此时溶质为(NH 4)2SO 4,c 到d ,pH 突变,但导电率几乎不变,故d 点,溶质为(NH 4)2SO 4和32NH H O ⋅,那么d 点溶液中电荷守恒为:c(NH 4+)+c(H +)=c(OH -)+2c(SO 42-),因此时pH >7,c(H +)<c(OH -),故c(NH 4+)>2c(SO 42-),C 错误;D .b ’点之前释放NH 4+,导电能力增强,b ’之后释放()2+34Cu NH ⎡⎤⎣⎦和OH -,导电能力降低,说明导电能力()2++434NH >Cu NH ⎡⎤⎣⎦,D 正确。
答案选D 。
【点睛】找到起点、恰好完全反应的点以及分析每一段所发生的反应是解决本类题的关键。
2.下列反应的离子方程式表达正确的是A .向FeBr 2溶液中通入过量Cl 2:2Fe 2++Cl 2=2Fe 3++2Cl -B .向碳酸钠溶液中通入少量CO 2:CO 32-+CO 2+H 2O =2HCO 3-C .向碘化钾溶液中加入少量双氧水:3H 2O 2+I -=IO 3-+3H 2OD .Fe(OH)3固体溶于HI 溶液:Fe(OH)3+3H +=Fe 3++3H 2O 【答案】B 【解析】 【分析】 【详解】A. 过量的Cl 2不仅会氧化亚铁离子,还可以和Br -发生反,FeBr 2中Fe 2+与Br -之比为1:2,所以离子方程式为2Fe 2++3Cl 2+4Br -=2Fe 3++6Cl -+2Br 2,A 项错误;B. 向碳酸钠溶液中通入少量CO 2,Na 2CO 3、CO 2、H 2O 发生反应产生NaHCO 3,反应的离子方程式为:CO 32-+CO 2+H 2O=2HCO 3-,B 项正确;C. H 2O 2具有氧化性,在酸性条件下,会将I -氧化为I 2,反应的离子方程式为:H 2O 2+2H ++2I -=I 2+2H 2O ,C 项错误;D. Fe(OH)3与HI 发生中和反应的同时,还有生成的Fe 3+与I -之间的氧化还原反应,还缺少Fe 3+与I -生成Fe 2+和I 2的反应,D 项错误; 答案选B 。
【点睛】本题考查离子方程式的书写,明确反应实质是解题关键,注意离子方程式反应遵循客观事实、原子个数守恒、电荷守恒、量比关系等。
例如本题A 项向FeBr 2溶液中通入过量Cl 2,氯气不仅可以氧化亚铁离子,还可以与溴离子发生反应,同时根据量比关系FeBr 2中Fe 2+与Br -之比为1:2。
3.常温下,下列各组离子在相应的条件下能大量共存的是( ) A .由水电离产生的c(H +)=1×10-10mol•L -1的溶液中:NO 3-、Fe 2+、Na +、SO 42- B .w+K c(H )=10-10mol•L -1的溶液中:NH 4+、I -、Cl -、K +C .-+c(OH )c(H )=1×106的溶液中:K +、Na +、Cl -、HCO 3- D .惰性电极电解AgNO 3后的溶液中:SO 32-、K +、Na +、S 2- 【答案】B 【解析】【分析】 【详解】A .由水电离产生的c(H +)=1×10-10mol•L -1的溶液可能是碱性溶液,也可能是酸性溶液。
在酸性溶液中,H +、NO 3-和Fe 2+发生氧化还原不能大量共存,在碱性溶液中,Fe 2+和OH -反应生成Fe(OH)2,不能大量共存,A 不符合题意;B .w+=(OH )(H )K c c =10-10mol•L -1<10-7 mol•L -1,其溶液为酸性溶液,NH 4+、I -、Cl -、K +不生成气体,不产生沉淀,也不生成水,可以大量共存,B 符合题意;C .-+(OH )(H )c c =1×106的溶液为碱性溶液,HCO 3-与OH -反应生成CO 32-和H 2O ,不能大量共存,C 不符合题意;D .用惰性电极电解AgNO 3溶液,阴极Ag +放电,阳极溶液中的OH -放电,总反应方程式为4AgNO 3+2H 2O 4Ag +O 2↑+4HNO 3,溶液中含有HNO 3,则SO 32-和S 2-会与HNO 3发生氧化还原,不能大量共存,D 不符合题意。
答案选B 。
4.一定能在下列溶液中大量共存的离子组是( )A .水电离产生的H +浓度为1×10-12mol·L -1的溶液:NH 4+、Na +、Cl -、HCO 3-B .能使pH 试纸变深蓝色的溶液:Na +、AlO 2-、S 2-、O 32-C .含有大量Fe 3+的溶液:SCN -、I -、K +、Br -D .pH =1的水溶液中:Al 3+、NH 4+、CH 3COO -、Br - 【答案】B 【解析】 【分析】 【详解】A 、水电离产生的H +浓度为1×10-12mol/L ,说明水的电离受到抑制,该溶液可能为酸或碱溶液,HCO 3-既能与酸反应又能与碱反应,NH 4+与碱反应,能大量共存,A 错误;B 、能使pH 试纸变深蓝色的溶液,为碱性溶液,碱性条件下该组离子之间不反应,能大量共存,B 正确;C 、Fe 3+与SCN –和I –都能发生反应,不能大量共存,C 错误;D 、pH =1的水溶液呈酸性,CH 3COO -与H +反应,不能大量共存,D 错误。
答案选B 。
5.烧杯中盛有100mL 0.1mol/L 的NaHSO 4溶液,向其中逐滴滴加0.1mol/L 的Ba(OH)2溶液,烧杯中某些物质(或微粒)的物质的量的变化曲线如图。
下列说法正确的是A.曲线a表示Ba2+的物质的量的变化B.曲线c表示OH-的物质的量的变化C.加入Ba(OH)2溶液50mL反应的离子方程式为 Ba2++OH-+H++SO42-→BaSO4↓+H2O D.加入Ba(OH)2溶液大于50mL后,反应的离子方程式为 OH-+H+→H2O【答案】B【解析】【分析】【详解】A.由图象曲线变化可知,在加入的氢氧化钡溶液体积小于100mL前,曲线a表示离子的浓度减小,此段曲线a表示的是硫酸根离子,当Ba( OH)溶液体积大于100mL后,曲线a表示的是钡离子浓度,故A错误;B.由图可知,曲线c表示离子的浓度先减小后增大,50mLBa( OH)2溶液加入时为0,此时100mL0.1mol/L的NaHSO4恰好和0.1mol/L的Ba(OH)2反应,继续加入Ba( OH)2溶液后,OH-的浓度逐渐增大,则直线c表示OH-的物质的量的变化,故B正确;C.加入Ba(OH)2溶液50mL,两者恰好完全反应,其反应的化学方程式为: Ba2++2OH-+2H ++SO42-=BaSO4↓+2H2O,故C错误;D.加入Ba(OH)2溶液大于50mL后,硫酸氢钠中氢离子已经反应完全,此时的反应为钡离子与硫酸根离子反应生成硫酸钡的反应,反应的离子方程式为:Ba2++ SO42-=BaSO4↓,故D错误;故选B。
6.下列离子在溶液中能够共存并且在加入少量的Na2O2固体后原离子浓度能基本保持不变的是()A.NH4+、Ba2+、Cl-、NO3-B.K+、AlO2-、Cl-、SO42-C.Ca2+、Mg2+、NO3-、HCO3-D.Na+、Cl-、CO32-、NO3-【答案】B【解析】【分析】【详解】Na2O2固体会与溶液中的水发生反应,生成氢氧化钠和氧气;A. NH4+与氢氧根离子反应生成弱电解质一水合氨,加入过氧化钠后NH4+的浓度变化较大,A项错误;B. K+、AlO2-、Cl-、SO42-之间不反应,在溶液中能够大量共存,且加入过氧化钠后各离子浓度基本不变,B项正确;C. Ca2+、Mg2+、HCO3-都能够与氢氧根离子反应,加入过氧化钠后它们的离子浓度变化较大,C项错误;D. 反应生成Na+,加入过氧化钠后钠离子浓度变化较大,D项错误;答案选B。
7.某强酸性溶液 X 中可能含有 Ba2+、A13+、NH4+、Fe2+、Fe3+、CO32-、SO32-、SO42-、C1-、NO2-中的一种或几种,现取 X 溶液进行连续实验,实验过程及产物如下:根据以上信息,下列判断正确的是A.X 溶液中一定存在 A13+、NH4+、Fe3+、SO42-B.X 溶液中可能存在 SO32-、C1-、NO2-C.向溶液 J 中加入过量的溶液 E,最终溶液中可能含有两种溶质D.沉淀 I 一定是 Al (OH)3【答案】D【解析】【分析】【详解】强酸性溶液中一定不会存在CO32-和SO32-离子,加入过量硝酸钡生成沉淀,则该沉淀为BaSO4沉淀,说明溶液中含有SO42-离子,生成气体A,A连续氧化生成D和E,则A为NO,D为NO2,E为HNO3,说明溶液中含有还原性离子,一定为Fe2+离子,溶液B中加入过量NaOH溶液,生成气体F,则F为NH3,说明溶液中含有NH4+离子,溶液H中通入过量CO2气体,生成沉淀I,则I为Al(OH)3,H为NaAlO2,说明溶液中含有Al3+离子,溶液中含有Fe2+离子,就一定不含NO2-离子,含有SO42-离子就一定不含Ba2+离子,不能确定是否含有的离子Fe3+和Cl-,根据上述分析,溶液中一定含有A13+、NH4+、Fe2+、SO42-;一定不存在Ba2+、CO32-、SO32-、NO2-;可能存在Fe3+和Cl-,故A、B错误;溶液H中含有前几步加入的过量的Ba2+、Na+、OH-、NO3-和生成的 AlO2-,通入过量CO2,得到的溶液J中含有Ba2+、Na+、NO3-和HCO3-,加入过量的硝酸(溶液E),最终溶液中有硝酸钠、硝酸钡和过量的硝酸,故C错误;沉淀I 是 Al (OH)3,故D正确;故选D。