2020年(生物科技行业)分子生物学实验指导
- 格式:docx
- 大小:48.48 KB
- 文档页数:7

实验一小鼠肝组织DNA的提取及鉴定【实验目的】1、掌握动物组织DNA提取的方法;2、掌握紫外分光光度法检测、鉴定DNA浓度和纯度的方法。
【实验原理】获得相当纯度和完整性的基因组DNA,可用于DNA酶切图谱、多态性分析、基因诊断、构建基因组文库等。
因此,DNA样品质量的好坏将直接关系到实验的成败。
较理想的DNA样品应达到以下三点要求:①不应存在对酶有抑制作用的有机溶剂和过高浓度的金属离子;②最大程度地降低蛋白质、多糖和脂类分子的污染;③排除RNA分子的污染和干扰。
DNA以核蛋白形式存在于细胞中,提取DNA的原则是即要将DNA与蛋白质、脂类和糖类等成分分离,又要保持DNA分子的完整。
本实验中,用阴离子去垢剂十二烷基磺酸钠(SDS)消化破裂细胞膜、核膜,并使组织蛋白变性沉淀,DNA从核蛋白中游离分开;为控制组织中脱氧核糖核酸酶(DNase)对DNA的降解,加入柠檬酸钠或乙二胺四乙酸二钠(EDTA-Na2)以除去激动该酶的金属离子,SDS也能使DNase变性失活;蛋白酶K DNA酶;分离后的DNA用饱和酚/氯仿抽提除去蛋白质,接着用氯仿抽提以除去DNA溶液中微量酚的污染;最后用无水乙醇沉淀DNA,得到欲提取的基因组DNA。
260nm处DNA有最大吸收峰,测DNA的A260,可计算其浓度。
而蛋白质在280nm处有最大吸收峰,可测定A260nm/A280nm比值,检测DNA的纯度,该比值介于1.8~2.0之间。
【实验器材和试剂】1、动物小白鼠2、设备移液器、台式离心机、水浴箱、陶瓷研钵等;751紫外分光光度计、石英比色皿、洗瓶、滤纸等。
3、试剂(1)基因组DNA提取试剂盒(北京康为世纪生物科技公司):包括Buffer CL、Buffer PP、Buffer GE、RNase A、Proteinase K(7)生理盐水,4℃贮存(8)无水乙醇、70%乙醇【操作步骤】1、制备肝匀浆迅速处死小白鼠,称取新鲜肝脏组织50 mg,用预冷生理盐水洗去血液,滤纸吸干后剪碎组织,将剪碎组织放于组织匀浆器或研钵中研磨,同时加入300 μl Buffer CL。
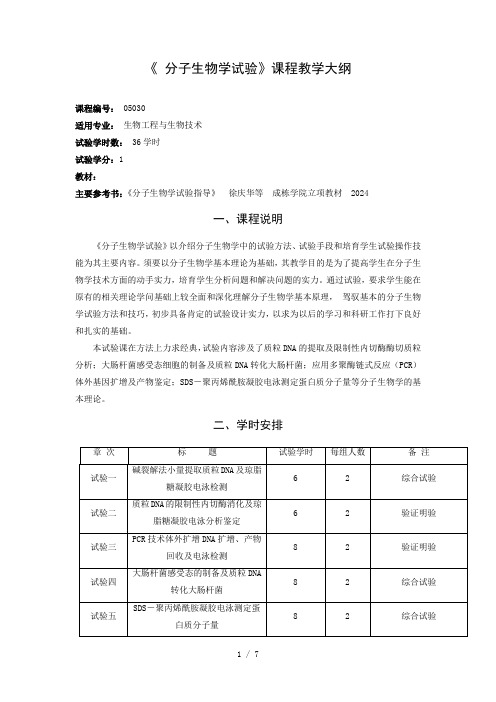
《分子生物学试验》课程教学大纲课程编号: 05030适用专业:生物工程与生物技术试验学时数:36学时试验学分:1教材:主要参考书:《分子生物学试验指导》徐庆华等成栋学院立项教材 2024一、课程说明《分子生物学试验》以介绍分子生物学中的试验方法、试验手段和培育学生试验操作技能为其主要内容。
须要以分子生物学基本理论为基础,其教学目的是为了提高学生在分子生物学技术方面的动手实力,培育学生分析问题和解决问题的实力。
通过试验,要求学生能在原有的相关理论学问基础上较全面和深化理解分子生物学基本原理,驾驭基本的分子生物学试验方法和技巧,初步具备肯定的试验设计实力,以求为以后的学习和科研工作打下良好和扎实的基础。
本试验课在方法上力求经典,试验内容涉及了质粒DNA的提取及限制性内切酶酶切质粒分析;大肠杆菌感受态细胞的制备及质粒DNA转化大肠杆菌;应用多聚酶链式反应(PCR)体外基因扩增及产物鉴定;SDS-聚丙烯酰胺凝胶电泳测定蛋白质分子量等分子生物学的基本理论。
二、学时安排三、教学内容及教学基本要求试验一碱裂解法小量提取质粒DNA及琼脂糖凝胶电泳检测一、试验特点试验类型:综合试验类别:专业基础安排学时:6 每组人数:2二、试验目的1、驾驭碱裂解法小量提取质粒DNA和试剂盒提取质粒DNA的原理和方法。
2、驾驭琼脂糖凝胶的制备及外源DNA的检测原理。
3、了解质粒DNA的粗略定量方法。
三、试验内容提要1、将单菌落接种于3m1含相应抗生素的LB培育基中,37℃摇菌过夜;2、12,000rpm离心30sec,收集菌体;3、加200u1溶液I(含RNaseA 100ug/ml ),振荡悬浮菌体;4、加200ul新配制的溶液II,颠倒混匀;5、溶液澄清后马上加入预冷的200u1溶液III混匀后冰上放置5~10 min;6、4℃、12,000rpm离心15min,取上清,加0.7倍异丙醇混匀,室温静置5min;7、12,000rpm离心10min,70%乙醇洗涤沉淀,抽干后溶于适量水或TE,-20℃保存备用。

可编辑修改精选全文完整版分子生物学实验方法与步骤表达蛋白的SDS-聚丙烯酰胺凝胶电泳分析一、原理细菌体中含有大量蛋白质,具有不同的电荷和分子量。
强阴离子去污剂SDS与某一还原剂并用,通过加热使蛋白质解离,大量的SDS 结合蛋白质,使其带相同密度的负电荷,在聚丙烯酰胺凝胶电泳(PAGE)上,不同蛋白质的迁移率仅取决于分子量。
采用考马斯亮兰快速染色,可及时观察电泳分离效果。
因而根据预计表达蛋白的分子量,可筛选阳性表达的重组体。
二、试剂准备1、30%储备胶溶液:丙烯酰胺(Acr)29.0g,亚甲双丙烯酰胺(Bis)1.0g,混匀后加ddH2O,37O C溶解,定容至100ml, 棕色瓶存于室温。
2、1.5M Tris-HCl(pH 8.0:Tris 18.17g加ddH2O溶解, 浓盐酸调pH至8.0,定容至100ml。
3、1M Tris-HCl(pH 6.8:Tris 12.11 g加ddH2O溶解, 浓盐酸调pH至6.8,定容至100ml。
4、10% SDS:电泳级SDS 10.0 g加ddH2O 68℃助溶,浓盐酸调至pH 7.2,定容至100ml。
5、10电泳缓冲液(pH 8.3:Tris 3.02 g,甘氨酸18.8 g,10% SDS 10ml加ddH2O溶解, 定容至100ml。
6、10%过硫酸铵(AP): 1gAP加ddH2O至10ml。
7、2SDS电泳上样缓冲液:1M Tris-HCl (pH 6.82.5ml,-巯基乙醇1.0ml,SDS 0.6 g,甘油2.0ml,0.1%溴酚兰1.0ml,ddH2O 3.5ml。
8、考马斯亮兰染色液:考马斯亮兰0.25 g,甲醇225ml,冰醋酸 46ml,ddH2O 225ml。
9、脱色液:甲醇、冰醋酸、ddH2O以3∶1∶6配制而成。
二、操作步骤采用垂直式电泳槽装置(一)聚丙烯酰胺凝胶的配制1、分离胶(10%的配制:ddH2O 4.0ml30%储备胶 3.3ml1.5M Tris-HCl2.5ml10% SDS 0.1ml10% AP 0.1ml取1ml上述混合液,加TEMED(N,N,N’,N’-四甲基乙二胺10μl 封底,余加TEMED4μl ,混匀后灌入玻璃板间,以水封顶,注意使液面平。

《分子生物学实验技术实验操作指南》目录1 植物基因序列分析 (3)2 引物设计的原则 (4)3 试剂的配置和灭菌 (5)4 植物基因组DNA的提取 (6)5 DNA的定量 (8)6 DNA的电泳 (9)8 PCR产物的回收 (12)9 PCR产物连接T载体和感受态细胞的转化 (14)10 菌落(液)PCR (17)11 质粒DNA的提取 (19)12 质粒DNA的酶切 (21)1 植物基因序列分析1.基因组DNA(genomic DNA, gDNA):功能基因包括三个基本序列:5’上游区,转录区和3’下游区。
2.5’上游区和3’下游区:转录起始位点上游和转录终止位点下游的序列,主要起到基因表达调控作用。
3.转录区:转录起始位点和转录终止位点之间的序列,经核不均一RNA最终被加工为成熟的mRNA。
4.信使RNA(messenger RNA, mRNA):由DNA的一条链作为模板转录而来的,携带遗传信息的能指导蛋白合成的一类单链核糖核酸。
由编码区、上游的5’非编码区和下游3’非编码区组成,5’端带有7-甲基鸟苷-三磷酸帽子结构,3’端有多腺苷酸尾巴。
5.互补DNA(complementary DNA, cDNA):具有与某mRNA链呈互补的碱基序列的单链DNA。
6.蛋白质编码区(sequence coding for amino acids in protein, CDS):与蛋白质序列一一对应的DNA序列,且该序列中间不含其它非该蛋白质对应的序列。
只有外显子,不含内含子。
7.5’非翻译区(5’-untranslated region, 5’UTR):mRNA位于基因转录起始位点至编码区翻译起始密码子之间顺序。
8.3’非翻译区(3’-untranslated region, 3’UTR):mRNA位于编码区翻译终止密码子下游一段不被翻译的序列。
2 引物设计的原则1.引物长度:一般为20-25bp。
若产物长度等于或小于500bp,可选用16-18bp的引物;若产物长达5kb,则需要用更长的引物。

实验一RT-PCR法钓取小鼠肝脏GAPDH基因一、TRlzol试剂提取小鼠肝脏总RNATRIzol RNA提取试剂盒是由GIBCOBRL公司推出的产品,其操作方法简捷、方便,lh之内即可完成,所制备的RNA可用于cDNA合成及Northern blot等。
【试剂】TRlZOL试剂氯仿异丙醇75%乙醇(DEPC水配制)无RNase水【操作方法】(1)收获细胞1~5×106;或50-100mg组织,加TRlzol试剂lml匀浆。
(2),移入1.5ml Ep管中,室温静置5min。
(3)每1ml TRIZOL中加氯仿0.2m1,摇振15s,置室温2~3min。
(4)4℃离心,12,000g×15min。
(5)仔细吸取上层水相,移至另一Ep管中。
(6)加0.5ml异丙醇,混匀,置室温10min。
(7)4℃离心,12,000g×10min。
(8)弃上清,加75%乙醇1m1,轻轻摇振,充分洗涤沉淀,4℃离心,7500g×5min。
(9)弃上清,真空干燥后,沉淀重悬于50μl无RNase水中。
一70℃保存备用。
二、核酸的定量(1)分光光度法测定核酸浓度。
组成核酸分子的碱基,均具有一定的吸收紫外线特性,最大吸收波长为250~270nm之间。
例如腺嘌呤的最大紫外线吸收值在260.5nm,胞嘧啶:267nm 鸟嘌呤:276nM胸腺嘧啶:264.5 nm尿嘧啶259nm。
这些碱基与戊糖、磷酸形成核苷酸后,其最大吸收峰不会改变,但核苷酸最大吸收波长是260nm,吸收低谷在230nm,这个物理特性为紫外分光光度法测定核酸溶液浓度提供了基础。
在波长260nm紫外线下,1OD值的光密度相当于双链DNA浓度为50ug/ ml;单链DNA或RNA为40ug/ml;单链寡核苷酸为20ug/ml。
另外,还可以通过测定260nm和280nm的紫外线吸收值,然后根据其比值来估计核酸的纯度。
DNA样品的比值为1.8,RNA样品的比值为2.0。

分子生物学实验指导(总45页) -CAL-FENGHAI.-(YICAI)-Company One1-CAL-本页仅作为文档封面,使用请直接删除分子生物学实验指导分子生物学实验课程的内容是从亚克隆一个基因直到最终表达出该基因产物的一个完整的科研项目。
以表达纳豆激酶为例,从已经克隆在pMD-18-T 载体上的纳豆激酶酶原基因上用PCR扩增出837bp的纳豆激酶成熟肽基因片段,与T载体连接后转入DH5菌中筛选鉴定,然后用双酶切下纳豆激酶成熟肽基因片段,插入带有6个组氨酸标签的原核表达载体pET-Trx,在表达菌BL(21)DE3中诱导表达出纳豆激酶蛋白质并用SDS-PAGE鉴定。
整套实验围绕纳豆激酶基因的亚克隆、重组、转化、筛选直到表达这一研究顺序进行操作。
其间共涉及学习约11种基因操作的基本技术,我们按这些操作技术出现的先后顺序分别编为实验一至实验十一。
各个实验之间具有很强的逻辑性和连贯性,前一个实验的结果就是下一个实验的原料。
整套实验设计实际上是一个基因操作实验平台,随时能根据需要更改外源基因和表达载体或进一步扩充实验内容。
我们在每年的教学实践中会不断增加目的基因和表达载体的种类,以便于学生实验小组能够从事不同的项目,减少雷同,增加兴趣。
分子生物学实验的宗旨是让学生在独立实践操作中学习分子生物学的基本研究方法和体会分子生物学研究的严密逻辑和科研理念。
实验教学的组织方式是科研项目式管理,即在教师的总体指导下,在给定的实验材料和实验条件的基础上,让学生独立思考、自行规划实验流程、制定实验计划、准备实验材料、动手操作、整理和分析实验结果,最后完成实验项目,写出实验论文。
因此学生在实验前要认真预习实验内容,结合学过的分子生物学原理,弄懂每一步实验的目的和原理,了解实验的内容和总体实验方案,写出分子生物学大实验《开题报告》,交教师审阅和讨论修改后才能进入实验室操作。
在实验过程中,教师不干涉学生的实验安排和操作程序,仅以导师的身份对学生的实验操作进行现场巡回指导、回答学生的疑问、为学生示范一些高档实验仪器和软件的使用,提供公用的试剂(如酶)等,并对学生的每一步实验结果进行评价和把关。
(生物科技行业)分子生物学考题综合练习壹、单项选择题(共25小题,1分/题,共25分)1、真核生物的TATA盒是()A、DNA合成的起始位点B、RNA聚合酶和DNA模板稳定结合处C、RNA聚合酶的活性中心D、翻译起始点E、转录起始点2、下列哪中杂交方式不属于核酸分子杂交()?A、原位杂交;B、斑点杂交;C、Southern杂交;D、Northern杂交;E、Western杂交。
3、指导合成蛋白质的结构基因大多数为()A、高度重复序列;B、回文序列;C、单拷贝序列;D、中度重复序列4、下列关于大肠杆菌DNA聚合酶Ⅲ的叙述哪壹项是正确的?()A、具有3’→5’核酸外切酶活性B、不需要引物C、需要4种不同的三磷酸核苷D、dUTP是它的壹种作用物E、能够将二个DNA片段连起来5、下列不属于真核生物基因表达调控的反式作用因子是()A、GC岛;B、亮氨酸拉链;C、同源异形域蛋白;D、HLH蛋白P S:Zincfinger、Leuzipper(亮氨酸拉链)、HTH、bHLH6、真核细胞中的mRNA帽子结构是()A、7-甲基鸟嘌呤核苷三磷酸;B、7-甲基尿嘧啶核苷三磷酸;C、7-甲基腺嘌呤核苷三磷酸;D、7-甲基胞嘧啶核苷三磷酸7、下列是几种DNA分子的碱基组成比例,哪壹种DNA的Tm值最高()。
A、G+C=35%B、G+C=25%C、G+C=40%D、A+T=80%E、A+T=15%8、真核生物中,存在于核仁的RNApol是()A、RNApolⅢ(核质---tRNA\5srRNA\Alu序列和部分snRNA);B、RNApolⅡ(核质---hnRNA\snRNA);C、RNApolⅠ(核仁---rRNA)9、在DNA复制时,下列所有因子对DNA链解旋和解链都是必需的,但()除外A、负超螺旋傾向解旋B、通过解旋酶解开不稳定的碱基对C、需要拓扑异构酶的作用D、SSB蛋白酶的活性E、需要以ATP的形式供应能量10、连接酶作用是()A、催化DNA俩条链间形成磷酸二酯键B、将螺旋解链C、催化DNA链俩段间形成磷酸二酯键D、去除引物,填补空缺E、催化DNA俩条链间形成氢键11、可作为重组DNA的目的基因的是()A、mRNAB、tRNAC、rRNAD、基因组DNAE、mRNA和基因组DNA12、DNA的二级结构是()A、α-螺旋;B、β-折叠;C、双螺旋结构;D、三叶草结构13、σ因子专壹性表当下()A、识别启动子的特异序列;B、和核心酶结合;C、属于RNA聚合酶的壹个亚基;D、参和三元复合物的形成。
分子生物学实验技术使用指南背景随着生物科技的飞速发展,分子生物学实验技术变得日益重要。
无论是基础研究还是应用研究,分子生物学实验技术都扮演着关键角色。
本文将深入探讨几种常用的分子生物学实验技术,并提供使用指南。
1. DNA提取技术DNA提取是分子生物学实验中的第一步。
合理高效的DNA提取可以确保后续实验的顺利进行。
常用的DNA提取方法包括Phenol/Chloroform法、Qiagen柱法等。
对于不同的样品类型,选择合适的方法非常关键。
例如,对于植物样品,除了常规提取方法外,还可以使用植物基因组DNA提取试剂盒进行快速提取。
2. PCR技术PCR(聚合酶链式反应)是分子生物学实验中的常用技术。
它使得我们能够在实验室中迅速扩增DNA片段。
在PCR过程中,引物的设计非常重要。
合理严谨的引物设计能够提高扩增效率,并避免非特异扩增。
此外,选择适当的扩增条件和酶的浓度也是成功PCR实验的关键。
3. 限制性内切酶消化限制性内切酶消化可以用于DNA片段的切割和鉴定。
合理选择适合的限制酶是至关重要的。
在消化反应中,反应的时间和温度是需要特别注意的因素。
此外,对于限制性内切酶的消化产物的鉴定,可以使用琼脂糖凝胶电泳或PCR扩增来进行。
4. 基因克隆技术基因克隆是分子生物学实验中常用的技术手段。
在基因克隆过程中,选择合适的酶切位点和载体是至关重要的。
克隆之前,需要仔细设计引物以扩增目标基因。
成功克隆后,还需要验证所克隆基因的准确性。
这可以通过测序和进一步的功能检测来完成。
5. 蛋白质免疫印迹技术蛋白质免疫印迹技术是研究蛋白质表达和相互作用的重要技术。
在进行免疫印迹实验前,需要制备合适的细胞裂解液来提取蛋白质。
之后,需要将蛋白质样品进行分离,并转移到膜上。
此外,合适的抗体选择和浓度优化也对实验结果有重要影响。
6. 基因组测序技术基因组测序是分子生物学研究中不可或缺的技术。
高通量测序技术的发展使得基因组测序变得更加快速和准确。
分⼦⽣物学实验指导(精)分⼦⽣物学实验指导⽣物技术教学室编宁夏⼤学⽣命科学学院2008年8⽉实验⼀分⼦⽣物学实验技术多媒体演⽰[⽬的要求]通过多媒体试验录像进⼀步掌握分⼦⽣物学基本操作技术。
[教学⽅式]多媒体光盘演⽰。
[实验内容]基本的分⼦⽣物学实验操作技术包括核酸凝胶电泳技术;质粒提取;转化;重组体的筛选;PCR技术等。
实验⼆琼脂糖凝胶电泳检测DNA[⽬的要求]通过本实验学习琼脂糖凝胶电泳检测DNA的⽅法和技术[实验原理]琼脂糖凝胶电泳是分离鉴定和纯化DNA⽚段的常⽤⽅法。
DNA分⼦在琼脂糖凝胶中泳动时有电荷效应和分⼦筛效应,DNA分⼦在⾼于等电点的pH溶液中带负电荷,在电场中向正极移动。
由于糖磷酸⾻架在结构上的重复性质,相同数量的双链DNA⼏乎具有等量的净电荷,因此它们能以同样的速度向正极⽅向移动。
不同浓度琼脂糖凝胶可以分离从200bp⾄50 kb的DNA⽚段。
在琼脂糖溶液中加⼊低浓度的溴化⼄锭(Ethidum bromide ,EB),在紫外光下可以检出 10ng的DNA条带,在电场中,pH8.0条件下,凝胶中带负电荷的DNA向阳极迁移。
琼脂糖凝胶有如下特点:(1) DNA的分⼦⼤⼩在凝胶基质中其迁移速率与碱基对数⽬的常⽤对数值成反⽐,分⼦越⼤迁移得越慢。
(2) 琼脂糖浓度⼀个特定⼤⼩的线形DNA分⼦,其迁移速度在不同浓度的琼脂糖凝胶中各不相同。
DNA电泳迁移率(u)的对数与凝胶浓度(t)成线性关系。
(3) 电压低电压时,线状DNA⽚段迁移速率与所加电压成正⽐。
但是随着电场强度的增加,不同分⼦量DNA⽚段的迁移率将以不同的幅度增长,随着电压的增加,琼脂糖凝胶的有效分离范围将缩⼩。
要使⼤于2kb的DNA⽚段的分辨率达到最⼤,所加电压不得超过5v/cm。
(4) 电泳温度DNA在琼脂糖凝胶电泳中的电泳⾏为受电泳时的温度影响不明显,不同⼤⼩的DNA⽚段其相对迁移速率在4℃与30℃之间不发⽣明显改变,但浓度低于0.5%的凝胶或低熔点凝胶较为脆弱,最好在4℃条件下电泳。
生物科技行业)分子生物学实验指导分子生物学实验指导动植物检疫专业2012 , 2分子生物学实验注意事项1.课前要提前预习实验内容,了解实验设计的原理,理清实验顺序,制定实验方案(没有方案或方案不合理者不能进入实验操作)。
2.由于实验内容多,时间短,多数实验需要同时或穿插进行,壹定要做好统筹安排。
3.实验课中的所有单项实验都属于壹个整体流程。
实验时间安排上没有上下午晚上等严格的作息安排,壹切服从实验进度,必须在理论课上课期间完成。
4.实验的每壹步都要详细地记录操作内容、时间、步骤、结果等,以备查询!5.对任何自己不熟悉的实验仪器都不要随意操作(尤其是微量移液器!)。
在操作的过程中发现任何意外的现象都要及时向任课教师汇报。
6.写作实验报告或实验论文壹定要文理通顺、逻辑清晰、图表说明详细,讨论分析透彻。
7.在实验室内不能大声喧哗。
8.在实验的过程中制造的任何垃圾都要丢到垃圾筐里(或先放在自己的桌面壹角),严禁随地丢弃!特别注意对废弃细菌的杀灭和有毒垃圾的定点投放。
9.实验结束后要把用过的器皿清洗后归放整齐且清点数目,向教师汇报征得同意后方可离开实验实。
10.值日组的同学最后离开,等待清扫实验室的卫生,关闭门窗水电。
11.实验时损坏的任何物品都要及时申报。
实验壹质粒DNA 的提取1.目的学会最常用的小量制备质粒 DNA 的碱裂解方法。
2.原理根据共价闭合环状质粒 DNA 和线性 DNA 在拓扑学上的差异来分离。
在 pH12.0 12.5 这个狭窄的范围内,线性 DNA 双螺旋结构解开而被变性。
尽管在这项的条件下共价闭合环状质粒 DNA 也会变性,但俩条互补链彼此互相盘绕,仍会紧密结合在壹起。
当加入 pH4.8 的乙酸钾高盐缓冲液使 pH 恢复中性时,共价闭合环状质粒 DNA 复性快,而线性的染色体 DNA 复性缓慢,经过离心和蛋白质和大分子 RNA 壹起沉淀下去。
3.器材超净工作台,接种环,酒精灯,台式离心机,旋涡混合器,微量移液取样器,1.5ml 微量离心管,恒温摇床,摇菌试管,双面微量离心管架,试管架,标签纸,磁力搅拌机。
4.试剂pMD18-T-F 载体菌, LB 培养基 1000ml (含 100ug/ml 氨苄青霉素) ,葡萄糖 /Tris/EDTA (GTE ) 溶液(溶液 I ), NaOH/SDS 溶液(溶液 II ),KAc 溶液( pH4.8 )(溶液 III ), RNaseA ,95% 乙醇, 70% 乙醇, TEbuffer( pH8.0 )。
5 .实验准备 氨苄青霉素储存液(无菌水配制 5mg/ml ,分装后 -20 C 保存),配制 LB 培养基(胰化蛋白 胨 10g ,酵母提取物 5g ,NaCl10g 加 200mLddwater 搅拌完全溶解, 用约 200 L5NNaOH 调 pH 至 7.0 ,加 ddwater 至 1L ,121 C20min 灭菌);溶液 I ( 50mmol/L 葡萄糖, 25mmol/LTrisHClpH8.0 ,10mmol/LEDTApH8.0 );溶液 II ( 0.2mol/LNaOH , 1%SDS ); 溶液 III( 60mL5mol/LKac ,加冰乙酸调 pH4.8 ,补 ddwater 至 100ml ),70% 乙醇( -20C 保存),TEbuffer ( 10mmol/LTrisHClpH8.0 , 1mmol/LEDTApH8.0 );10mg/mLRNaseA (RNA 酶 A 溶于 10mmol/LTrisHClpH7.5 , 15mmol/LNaCl 中);摇菌试管洗净且盖上棉 花塞、 1.5ml 离心管装入铝制饭盒、移液器吸头装入相应的吸头盒, 壹起高压灭菌 ( 121 C30min )。
6 .操作步骤(1)在超净工作台中取 5mlLB (Amp + ),加入灭菌的摇菌管中。
( 2)从超低温冰箱中取出保存 pMD-18T-F 的菌种(操作完后迅速把菌种放回超低温冰柜 中,切不可将菌融化! ),在超净工作台上用烧红的接种环刮壹下,再把接种环于无菌 LB 培 养液(含 100ug/ml 氨苄青霉素)中搅拌壹下, 37 C 摇床中摇 20h 。
( 3)取 1.5ml 的菌液于 1.5ml 离心管中, 15000rpm 离心 1min ,弃上清液 (尽量弃干净) , 留沉淀备用。
4 )在沉淀中加入 100 l 溶液 I ,盖上盖后立即在涡旋混合器上混匀,室温下静置 5min 。
等待的同时,取壹个塑料盒,装上适量的冰块备用。
)5 )加入 200 l 溶液 II ,盖上盖后上下颠倒几次混匀,插入冰中,放置 5min 。
6)加入 150 l 溶液 III ,盖上盖后上下颠倒几次混匀,插入冰中,放置 5min 。
7 )15000rpm 离心 5min ,小心吸取 400 l 上清液于另壹个干净的 要将白色沉淀物带入! ),加入 800 l95% 乙醇,盖上盖后立即在涡旋混合器上混匀,室温下静置 5min 。
小心弃掉上清液,尽量倒置弃干净10 )离心管倒置于 37 C 培养箱中(或室温)空气干燥。
(管底的沉淀质粒 DNA 用肉眼几 乎见不见!)。
(11 )pMD18-T-F 加入 30 l 无菌蒸馏水或 TE 缓冲液,用记号笔标记后放入冰箱中备用。
(12 )在剩余的菌液中倒入少许 84 消毒液,待溶液变清亮后随废液和剩余的冰块壹起倒入 下水池。
清理桌面,清洗仪器,撰写实验报告1.5ml 离心管中,(不 8 ) 15000rpm 离心 10min ,小心弃掉上清液,加入 500 l70% 乙醇,盖上盖后立即在涡 旋混合器上混匀。
15000rpm 离心 10min ,小心弃掉上清液,尽量倒置弃干净 9 )再加入 500 l70% 乙醇, 盖上盖后立即在涡旋混合器上混匀。
15000rpm 离心 10min ,(1)影响本实验结果的因素有哪些?实验二、质粒DNA 的酶切1.目的学会用限制性内切酶切割质粒 DNA 。
2.原理II 型限制性内切酶能识别双链 DNA 内部的特殊序列且在识别位点处将双链切断,形成粘性末端或齐平末端,通过电用酶切后的 DNA 混合物能够确认和分离酶切片段。
3 .器材旋涡混合器,微量移液取样器,移液器吸头, 1.5ml 微量离心管,双面微量离心管架,水漂,恒温水浴。
4.试剂pMD18-T-F 质粒, EcoRI , BamHI ,内切酶缓冲液( 10 ×), 10 ×电泳加样缓冲液5 .实验准备配制 TAE电泳缓冲液(50 储存液),1000 溴化乙锭储存液(0.5mg/ml ),10 加样缓冲液,1.5ml 离心管装入铝制饭盒(灭菌)、移液器吸头装入相应的吸头盒(灭菌)6.操作步骤( 1)混合下列溶液于壹个无菌的1.5ml 微量离心管中:pMD18-T-FDNA(或 pUCm-T-F)6 μL10 ×酶切缓冲液(用 EcoRI 的缓冲液) 2μLddwater30 μLEcoRI1 μLBamHI1 μL总体积 40 μL( 2)先准备壹个冰盒且放入壹定量的冰块。
从-20 ℃冰柜中取出限制性内切酶,立即插入冰块中。
( 3)用壹只手的手指捏在盛放酶的微量离心管的上部(以免手指的给酶液加温),另壹只手持微量移液器,小心翼翼地吸取 1 μL限制性内切酶。
(4 )在酶切样品混合液中加入限制性内切酶后(立即把内切酶原液送回冰柜!),轻轻震动微量离心管使管中的溶液混匀。
再在离心机中 1000rpm 离心 10 秒。
取出后插到水漂的孔中,在推荐的最适酶切温度水浴中温育 1-3h (壹般是 37 ℃)。
(5)酶切后取少量酶切产物和合适的已知分子量的DNA (如先前的 PCR 产物)对比以确认切下的片断是否为自己想要的片断。
(6)酶切后的质粒能够回收备用。
(7)清理桌面垃圾,清洗实验仪器。
撰写实验报告。
7.思考(1)酶切反应混合物的体积是否对酶切效果有影响?为什么?( 2)如何估计 DNA 用量和酶的用量?(3)在吸取内切酶的时候如何操作才能别免浪费?实验三、质粒DNA 的PCR 扩增1.目的学会 PCR 操作的基本技术。
2.原理是将待扩增的 DNA 模板加热变性,和其俩侧互补的寡聚核苷酸引物复性,然后经过耐热的DNA 聚合酶延伸。
再进入下壹轮变性—复性—延伸的循环, n 次循环后 DNA 可被扩增(1+X )n倍。
其中 <25nt 的引物退火温度 T m=2 (A+T )+4 (G+C )。
3 .器材旋涡混合器,微量移液取样器,移液器吸头, 0.2mlPCR 微量管,双面微量离心管架, PCR 仪,台式离心机,琼脂糖凝胶电泳系统,水漂,恒温水浴。
4.试剂3U/ μ lTaqDNA聚合酶, PCR 缓冲液( 10 ×,MgCl 2free ), 25mMMgCl 2,dNTP ,引物,模板质粒 pMD18-T-F ,无菌 ddwater 。
5 .实验准备dNTP 混合液(每种 25mM ),TAE 电泳缓冲液, 1000 溴化乙锭储存液( 0.5mg/ml ),10 加样缓冲液, 1.5ml 离心管装入铝制饭盒(灭菌)、移液器吸头装入相应的吸头盒(灭菌)。
合成的引物:Senseprimer5'-GGATCCGCGCAATCTGTTCCTTATGGC-3' Antisenseprimer5'-GAATTCTTGTGCAGCTGCTTGTACGTTG-3' 目的基因模板质粒:已经克隆在 pMD18-T-F 载体上的 781bpNDV-F 基因。
待扩增的 F 片段长度: 837bp 。
6 .操作步骤(1)在 0.2mlPCR 微量离心管中配制 50 μl反应体系。
ddwater32 μl10 ×PCRbuffer (不含 MgCl 2) 5μl 25mMMgCl 23 μl2.5mmol/LdNTP4 μ l (每d种NTP 终浓度 0.2mM )10 μ mol/LPrimer12 μ12.l5 (— 25pmoles )10 μmol/Lprimer22 μl( 12.5 — 25pmoles )模板质粒 1 μl(1×10 -3pmoles ) 3U/ μlTaq 酶 1μl(3u )总体积 50 μl( 2)根据厂商的操作手册设置 PCR 仪的循环程序:①94 ℃5min②94 ℃1min③60℃ 1min④72℃ 1min50s⑤g oto ② 29times⑥72℃ 10min (3)PCR 结束后,取 10 μl产物进行琼脂糖凝胶电泳。
观察胶上是否有预计的主要产物带。