原子结构模型 电子排布
- 格式:ppt
- 大小:1.87 MB
- 文档页数:33

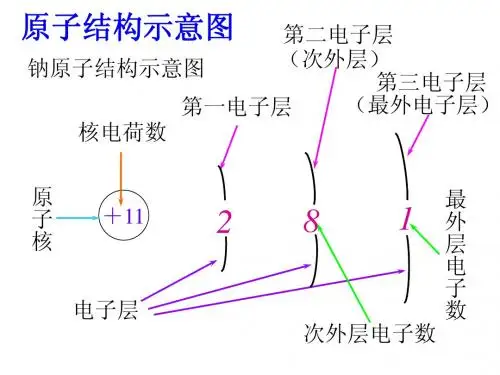
原子核外电子层排布知识精讲:1、原子结构示意图①圆圈内的数字:表示原子的质子数②+:表示原子核的电性③弧线:表示电子层④弧线上的数字:表示该电子层上的电子数2、核外电子排布的规律:①第一层最多容纳2个电子;②第二层最多容纳8个电子;③最外层最多容纳8个电子(若第一层为最外层时,最多容纳2个电子)3、元素周期表与原子结构的关系:①同一周期的元素,原子的电子层数相同,电子层数=周期数②同一族的元素,原子的最外层电子数相同,最外层电子数=主族数4、元素最外层电子数与元素性质的关系金属元素:最外层电子数<4 易失电子非金属元素:最外层电子数≥4 易得电子稀有气体元素:最外层电子数为8(He 为2)不易得失电子最外层电子数为8(若第一层为最外层时,电子数为2)的结构叫相对稳定结构。
5、离子中质子数与电子数的关系:阳离子:质子数>电子数阴离子:质子数<电子数质子数真题讲解:(2017山西)小美从某粒子结构示意图(如图)中,获取了下列信息,其中错误的是A.它有两个电子层B.它的核电荷数为12C.它表示阴离子D.它表示相对稳定结构答案:C解析:从题中所给原子结构示意图中可以看出,该粒子为镁离子,为阳离子,有两个电子层,核电荷数为12,最外层电子数为8,具有相对稳定结构。
(2017河南)右图为钠的原子结构示意图。
下列说法不正确的是A.钠原子的质子数为11 B.图中n的值为10C.钠在反应中易失去电子D.钠元素位于第三周期答案:B解析:由图可知,钠原子有11个质子,所以n=8;最外层一个电子,容易失去一个电子;钠原子有三个电子层,位于第三周期。
故答案选B。
(2017青岛)已知元素周期表中第三周期各元素原子结构示意图如下,下列分析错误的是A.以上原子的核外都有三个电子层B.Na+和Mg2+的核外电子数不相同C.Na与S形成化合物的化学式为Na2S D.在化学反应中氯原子容易得到电子答案:B解析:Na+和Mg2+的核外电子数相同,都是10;故答案选B。
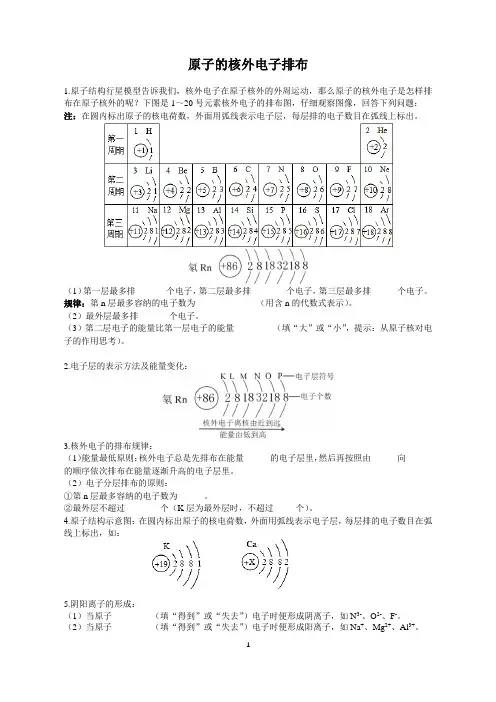
原子的核外电子排布1.原子结构行星模型告诉我们,核外电子在原子核外的外周运动,那么原子的核外电子是怎样排布在原子核外的呢?下图是1~20号元素核外电子的排布图,仔细观察图像,回答下列问题:注:在圆内标出原子的核电荷数,外面用弧线表示电子层,每层排的电子数目在弧线上标出。
(1)第一层最多排_______个电子,第二层最多排________个电子,第三层最多排______个电子。
规律:第n层最多容纳的电子数为______________(用含n的代数式表示)。
(2)最外层最多排_______个电子。
(3)第二层电子的能量比第一层电子的能量_________(填“大”或“小”,提示:从原子核对电子的作用思考)。
2.电子层的表示方法及能量变化:3.核外电子的排布规律:(1)能量最低原则:核外电子总是先排布在能量______的电子层里,然后再按照由______向______的顺序依次排布在能量逐渐升高的电子层里。
(2)电子分层排布的原则:①第n层最多容纳的电子数为______。
②最外层不超过________个(K层为最外层时,不超过_____个)。
4.原子结构示意图:在圆内标出原子的核电荷数,外面用弧线表示电子层,每层排的电子数目在弧线上标出,如:5.阴阳离子的形成:(1)当原子_________(填“得到”或“失去”)电子时便形成阴离子,如N3-、O2-、F-。
(2)当原子_________(填“得到”或“失去”)电子时便形成阳离子,如Na+、Mg2+、Al3+。
规律:a.当原子的最外层电子数大于4时,原子易______(填“得”或“失”)电子形成_____离子(填“阴”或“阳”)。
b.当原子的最外层电子数小于4时,原子易______(填“得”或“失”)电子形成_____离子(填“阴”或“阳”)。
6.“8e”稳定结构:___________________________________________。

碳原子激发态电子排布式
碳原子激发态电子排布式:
1、碳原子的结构:
碳原子是包含稳定的6个电子的原子。
碳原子的核外电子结构被形容为2s2 2p2,这表示它有两个2s框架电子和两个2p轨道电子。
2s框架电子排布在它的第一层,而2p轨道电子排布在它的第二层。
2、激发态电子排布:
在碳原子激发态下,其电子排布将发生变化。
一旦激发,两个2s框架电子被激发到更高能量的2p轨道上。
这样,激发后的碳原子会变成
4s0 4p,也就是说,激发后会有4个2p轨道电子。
其中,有两个电子是原电子,另外两个电子则是新出现的激发态电子。
3、电子分布:
在此激发态下,电子由远到近排列,由2s轨道开始,再到2p轨道,后来2p轨道再次被激发,激发的电子由3d轨道占位,它们与2p轨道电子无任何分离,交替环绕着核心。
因此,在激发态电子排布中,每个轨道中的电子数为4个。
4、各电子的分布:
排布在2s轨道中的电子有两个,它们是原始结构中的电子,被称为核
心电子。
排布在2p轨道中的电子也有两个,但这两个电子来自于激发状态,称为激发电子。
排布在3d轨道中的电子也有两个,它们也是来自于激发态,称为非核心激发电子。
总之,碳原子的激发态电子排布式为4s0 4p2 3d2,即,每个轨道中的电子数共计4个。





原子的结构和元素的电子排布一、原子的结构原子是物质的基本单位,由原子核和核外电子组成。
1.原子核:原子核由质子和中子组成,质子带正电,中子不带电。
原子核的质量主要集中在原子核上。
2.核外电子:核外电子带负电,围绕原子核高速运动。
电子在原子核外的空间中存在不同的能级,这些能级被称为电子层。
二、电子层和能级1.电子层:电子层是核外电子按能量大小分布的不同的空间区域。
常见的电子层有K层、L层、M层等。
2.能级:能级是电子层内的不同能量状态。
同一电子层内,能级越高,电子的能量越大。
三、元素的电子排布元素的电子排布是指一个原子中电子在各电子层的分布情况。
电子排布遵循能量最低原理、保里不相容原理和洪特规则。
1.能量最低原理:原子核外电子先占有能量最低的电子层,然后再依次占据能量更高的电子层。
2.保里不相容原理:一个原子中,不可能有两个或两个以上的电子具有完全相同的四个量子数(主量子数、角量子数、磁量子数、自旋量子数)。
3.洪特规则:在等价轨道(具有相同能量的轨道)上,电子将优先单独占据一个轨道,且自旋方向相同。
四、元素周期表与电子排布元素周期表是按照原子序数递增的顺序排列的一张表,它反映了元素的原子结构和性质。
元素周期表中的元素按照电子排布的规律分布在不同的周期和族。
1.周期:周期表中,垂直的列称为周期。
每个周期代表一个电子层的填充。
周期数等于电子层数。
2.族:周期表中,水平的行称为族。
同一族元素具有相同的价电子数,即最外层电子数。
五、电子排布与元素性质元素的电子排布决定了其化学性质。
最外层电子数目的不同,使得元素在化学反应中得失电子的能力不同,从而表现出不同的化学性质。
1.金属元素:金属元素的最外层电子数较少,易失去电子,表现为还原性。
2.非金属元素:非金属元素的最外层电子数较多,易获得电子,表现为氧化性。
3.稀有气体元素:稀有气体元素的最外层电子数已达到稳定结构,不易参与化学反应,表现为稳定性。
原子的结构和元素的电子排布是化学学科的基础知识。

原子的排布和结构
原子的排布和结构是由原子核和核外电子决定的。
核外电子的排布规律是根据电子的能量不同,按照从里到外的顺序,分为1、2、3、4、5、6、7层,电子层最多能容纳2n2个电子(n为层序数)。
电子的能量越低,离核越近;能量越高,离核越远。
最外层电子数不超过8个(第一层为最外层时,不超过2个)。
在书写原子结构示意图时,要遵循核外电子排布的一般规律,如核外电子总是尽先排在能量最低的电子层里,第一层排满才能排第二层,第二层排满才能排第三层等。
每个电子层最多能容纳2n2个电子(n为层序数,第一层n=1,第二层n=2),最外层电子数不超过8个。
1/ 1。
原子结构示意图规则一、原子核外电子排布的原理处于稳定状态的原子,核外电子将尽可能地按能量最低原理排布,另外,由于电子不可能都挤在一起,它们还要遵守保里不相容原理和洪特规则,一般而言,在这三条规则的指导下,可以推导出元素原子的核外电子排布情况,在中学阶段要求的前36号元素里,没有例外的情况发生。
1.最低能量原理电子在原子核外排布时,要尽可能使电子的能量最低。
怎样才能使电子的能量最低呢?比方说,我们站在地面上,不会觉得有什么危险;如果我们站在20层楼的顶上,再往下看时我们心理感到害怕。
这是因为物体在越高处具有的势能越高,物体总有从高处往低处的一种趋势,就像自由落体一样,我们从来没有见过物体会自动从地面上升到空中,物体要从地面到空中,必须要有外加力的作用。
电子本身就是一种物质,也具有同样的性质,即它在一般情况下总想处于一种较为安全(或稳定)的一种状态(基态),也就是能量最低时的状态。
当有外加作用时,电子也是可以吸收能量到能量较高的状态(激发态),但是它总有时时刻刻想回到基态的趋势。
一般来说,离核较近的电子具有较低的能量,随着电子层数的增加,电子的能量越来越大;同一层中,各亚层的能量是按s、p、d、f的次序增高的。
这两种作用的总结果可以得出电子在原子核外排布时遵守下列次序:1s、2s、2p、3s、3p、4s、3d、4p……2.保里不相容原理我们已经知道,一个电子的运动状态要从4个方面来进行描述,即它所处的电子层、电子亚层、电子云的伸展方向以及电子的自旋方向。
在同一个原子中没有也不可能有运动状态完全相同的两个电子存在,这就是保里不相容原理所告诉大家的。
根据这个规则,如果两个电子处于同一轨道,那么,这两个电子的自旋方向必定相反。
也就是说,每一个轨道中只能容纳两个自旋方向相反的电子。
这一点好像我们坐电梯,每个人相当于一个电子,每一个电梯相当于一个轨道,假设电梯足够小,每一个电梯最多只能同时供两个人乘坐,而且乘坐时必须一个人头朝上,另一个人倒立着(为了充分利用空间)。