重庆大学2011化学综合考研真题
- 格式:pdf
- 大小:1.10 MB
- 文档页数:5

西安科技大学2011年硕士研究生入学考试试题(A)────────────────────────────────────────────────科目编号:814 科目名称:有机化学考生须知:1、答案必须写在答题纸上,写在试题或草稿纸上不给分。
2、答题须用蓝、黑色钢笔或圆珠笔,用铅笔、红色笔者不给分。
3、答题必须写清题号,字迹要清楚,卷面要保持整洁。
4、试题要随答题纸一起交回。
5、注意第三、第四和第五题,有选作提示:按照卷面答题顺序得分。
一、选择(10小题, 共20分)[2分](1) 有强大爆炸力的三硝基甘油属于下列哪类物质:(A) 酸(B) 碱(C) 脂(D) 酯[2分](2) 从庚烷、1-庚炔、1,3-己二烯中区别出1-庚炔最简明的办法是采用: (A)Br2 + CCl4(B) Pd + H2(C) KMnO4,H+(D) AgNO3,NH3溶液[2分](3) 下列化合物有对映异构的应是:[2分](4) 羧酸的沸点比相对分子质量相近的烃,甚至比醇还高。
主要原因是: (A) 分子极性(B) 酸性(C) 形成二缔合体(D) 分子内氢键[2分](5) 下列化合物中哪些可能有顺反异构体?(A) CHCl=CHCl (B) CH2=CCl2(C) 1-戊烯(D) 2-甲基-2-丁烯[2分](6) 合成格氏试剂一般在下列哪一溶剂中反应?(A) 醇(B) 醚(C) 酯(D) 石油醚[2分](7) 起硝化反应的主要产物是:[2分](8) 在测定沙海葵毒素结构中主要反应有两个:一是用过碘酸,二是用臭氧,目的是:A 前者为了氧化切断双键,后者为了氧化切断邻二醇键B 前者为了氧化切断邻二醇键,后者为了氧化切断双键C 切断双键D 切断邻二醇键[2分](9) 下面化合物羰基活性最差的是:(A) PhCHO (B) CH3CHO(C) PhCOCH3(D) CH3COCH3[2分](10) 邻甲基乙苯在KMnO4,H+作用下主要产物是:(A) 邻甲基苯甲酸(B) 邻苯二甲酸(C) 邻甲基苯乙酸(D) 邻乙基苯甲酸二、填空题12小题,共30分)[2分](1) 下列化合物的CCS名称是:[2分](2) 写出下列反应的主要有机产物(如有立体化学问题请注明)。
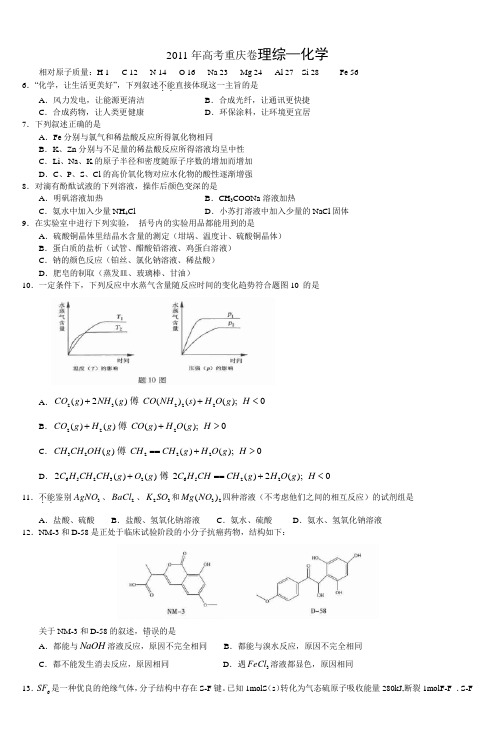
2011年高考重庆卷理综—化学相对原子质量:H 1 C 12 N 14 O 16 Na 23 Mg 24 Al 27 Si 28 Fe 566.“化学,让生活更美好”,下列叙述不能..直接体现这一主旨的是 A .风力发电,让能源更清洁 B .合成光纤,让通讯更快捷C .合成药物,让人类更健康D .环保涂料,让环境更宜居7.下列叙述正确的是A .Fe 分别与氯气和稀盐酸反应所得氯化物相同B .K 、Zn 分别与不足量的稀盐酸反应所得溶液均呈中性C .Li 、Na 、K 的原子半径和密度随原子序数的增加而增加D .C 、P 、S 、Cl 的高价氧化物对应水化物的酸性逐渐增强8.对滴有酚酞试液的下列溶液,操作后颜色变深的是A .明矾溶液加热B .CH 3COONa 溶液加热C .氨水中加入少量NH 4ClD .小苏打溶液中加入少量的NaCl 固体9.在实验室中进行下列实验, 括号内的实验用品都能用到的是A .硫酸铜晶体里结晶水含量的测定(坩埚、温度计、硫酸铜晶体)B .蛋白质的盐析(试管、醋酸铅溶液、鸡蛋白溶液)C .钠的颜色反应(铂丝、氯化钠溶液、稀盐酸)D .肥皂的制取(蒸发皿、玻璃棒、甘油)10.一定条件下,下列反应中水蒸气含量随反应时间的变化趋势符合题图10 的是A .23222()2()()()();0CO g NH g CO NH s H O g H ++<B .222()()()();0CO g H g CO g H O g H ++>C .32222()()();0CH CH OH g CH CH g H O g H ==+>D .6523265222()()2()2();0C H CH CH g O g C H CH CH g H O g H +==+<11.不能..鉴别3AgNO 、2BaCl 、23K SO 和32()Mg NO 四种溶液(不考虑他们之间的相互反应)的试剂组是 A .盐酸、硫酸 B .盐酸、氢氧化钠溶液 C .氨水、硫酸 D .氨水、氢氧化钠溶液12.NM-3和D-58是正处于临床试验阶段的小分子抗癌药物,结构如下:关于NM-3和D-58的叙述,错误..的是A .都能与NaOH 溶液反应,原因不完全相同B .都能与溴水反应,原因不完全相同C .都不能发生消去反应,原因相同D .遇3FeCl 溶液都显色,原因相同13.6SF 是一种优良的绝缘气体,分子结构中存在S-F 键。

水分析化学选择题1、在滴定分析法测定中出现的下列情况,哪种导致系统误差?( ) DA 试样未经充分混匀;B 滴定管的读数读错;C 滴定时有液滴溅出;D 砝码未经校正;一 52、分析测定中出现的下列情况,何种属于系统误差?( ) CA 滴定管未经校准;B 砝码读错;C 天平的两臂不等长;D 滴定时有溶液溅出;一 53、分析测定中出现的下列情况,何种属于偶然误差?( ) DA 某分析人员几次读取同一滴定管的读数不能取得一致;B 某分析人员读取滴定管读数时总是偏高或偏低;C 甲乙两人用同样的方法测定,但结果总不能一致;D 滴定时发现有少量溶液溅出。
一54、可用下法中哪种方法减小分析测定中的偶然误差?( ) DA 进行对照试验;B 进行空白试验;C 进行仪器校准;D 增加平行试验的次数。
一55、分析测定中的偶然误差,就统计规律来讲,其( ) CA 数值固定不变;B 有重复性;C 大误差出现的几率小,小误差出现的几率大;D 正误差出现的几率大于负误差一56、用电光天平称物,天平的零点为-0.3mg,当砝码和环码加到11.3500g时,天平停点为+4.5mg。
此物重为:( ) BA 11.3545gB 11.3548gC 11.3542gD 11.0545g 九17、滴定分析的相对误差一般要求为0.1%,滴定时耗用标准溶液的体积应控制在:( ) CA 10ml以下;B 10ml;C 10~40ml;D 50ml;一58、由计算器算得(2.236×1.1124)/(1.036×0.2000)的结果为12.004471,按有效数字运算规则应将结果修约为:( C )A 12.0045B 12.0;C 12.00;D 12.004 一69、今欲配制一升0.01000mol/LK2Cr2O7(摩尔质量为294.2g/mol)溶液。
所用分析天平的准确度为±0.1mg。
若相对误差要求为±0.2%,则称取K2Cr2O7应称准至:( C )A 0.1g;B 0.01g;C 0.001g;D 0.0001g;一510、滴定分析法要求相对误差为±0.1%,若称取试样的绝对误差为0.0002g,则一般至少称取试样:( ) BA 0.1g;B 0.2g;C 0.3g;D 0.4g;一511、欲测某水泥熟料中的SO3含量,由五人分别进行测定。

1一.填空题(20分,每空一分)1. 流体流动时产生摩擦阻力的根本原因是;2. 流体在圆管内作滞流流动时,阻力与流速的次方成比例;作完全湍流时,则阻力与流速的次方成比例。
3.流量q v增加一倍,孔板流量计压差计读数为原来的倍;转子流量计的环隙面积A0为原来的倍。
4.离心泵在启动前应灌水,否则会发生现象;离心泵的安装高度应低于允许安装高度,否则会发生现象。
5. 和为正位移泵,不能通过出口阀门来调节流量。
6. 非球形颗粒的体积、表面积和比表面积须通过两个参数确定,包括颗粒直径和。
7.在传热实验中,用饱和水蒸汽加热空气,总传热系数K接近于侧的对流给热系数;因此若强化该传热过程,应从侧着手。
8.对于水吸收CO2的低浓度系统,如在水中加碱,对此系统的k g,K G。
9. 某精馏塔在操作时,加料热状态由原来的饱和液体进料改为冷液进料,且保持F,xF,R,D不变,则此时塔顶物料浓度xD,塔底物料浓度xW。
10. 用溶剂S分离A、B液相混合物(A为溶质),二相平衡时萃取相中y A = 0.3,y S= 0.6;萃余相中x A = 0.15, x S = 0.05,则分配系数k A为,选择性系数β为。
11. 已知在常压及25℃下水份在某湿物料与空气之间的平衡关系为:相对湿度φ=100%时,平衡含水量x* = 0.02kg水/kg绝干料;相对湿度φ= 40%时, 平衡含水量x* = 0.007 kg水/kg绝干料。
现该物料含水量为0.23kg水/kg绝干料, 令其与25℃, φ=40%的空气接触, 则该物料的自由含水量为kg水/kg绝干料, 结合水含量为kg水/kg绝干料。
二.选择题(20分,每题2分)1. 用一气蚀余量为2m的离心泵输送处于沸腾状态下的塔底液体(p0=p v),若泵前管路的全部流动阻力为1.5m液柱,则此泵的安装位置必须。
A. 高于塔底液面3.5没的上方B. 高于塔底液面1.5m的上方C. 低于塔底液面4m的下方D. 低于塔底液面2 m的下方2.某液体在内径为d1的直管中作定态流动,平均流速为u1,当它以相同的体积流量通过某内径为d2(d2=d1/2)的直管时,若流动为完全湍流,阻力系数不变,h f2为h f1的倍。


重庆大学化学化工学院研究生复试基础化学笔试试卷第一篇:重庆大学化学化工学院研究生复试基础化学笔试试卷重庆大学化学化工学院研究生复试基础化学笔试试卷一.单选题。
(10分)1.0k时,任何绝对完美晶体的熵值是(A)A零B大于零B小于零D不能确定2.水结成冰时下列状态函数为零的是(D)A.△UB.△SC.△HD.△G3.已知一个反应由三步反应组成,这三步反应的平衡常数为K1,K2,K3。
则这个反应的平衡常数为(A)(注意:这题的具体题目简化了,但是题目意思一模一样)A.K1K2K3B.K1/K2/K3C.K3/ K2/K1D.不能确定。
4.二.填空题。
(20分)1.将两只锌棒分别插入容度为0.10mol/l,0.50mol/l的硫酸锌溶液中组成原电池,请写出原电池图式___。
2.[Pt(NH)4Cl2]的中心体为___,配位数为___,配位原子是___,命名为___。
3.已知某种元素的电子数是30,请写出其核外电子排布式___,该元素符号是___。
4.已知一氧化碳和水在高温条件下发生反应新生成水煤气(化学方程式省略),其焓大于零,二熵小于零,升高温度反应向___(正向,逆向)。
5。
三.简答题(20分)1,简述酸碱度的变化对重铬酸钾氧化性的影响,说明原因。
2.FeCl3和Na2C03能得到Fe2(C03)3吗?为什么?写出相应的方程式。
3.比较HF,HCL,HBr三者的沸点的高低,说明原因。
4.使用杂化轨道理论简述NH4+和SiCl4的杂化类型,并指出分子构型。
四.计算题(20分)1.已知由白锡生成灰锡的反应焓变为-219.80kJ/mol(估计不是这个数字),熵变为9.10j/k/mol.是通过计算,指出是白锡更加稳定还是灰锡更加稳定。
2.亚铁离子能被溴氧化为铁离子。
已知E(Fe3+/Fe2+)标准=(数据忘了),E(Br/Br-)=(数据忘了).①求此反应的标准电动势。
②标准平衡常数③若溴离子为0.1mol/l,铁离子和亚铁离子的比值为1,求此时的电动势。
2011年高考重庆理综化学试题赏析以下数据可供解题时参考:相对原子质量:H 1 C 12 N 14 O 16 Na 23 Mg 24 Al 27 Si 28 Fe 56第一部分(选择题共126分)本大题包括21小题。
每小题6分,共126分。
每小题只有一个....选项符合题意。
6.“化学,让生活更美好”,下列叙述不能..直接体现这一主旨的是A.风力发电,让能源更清洁B.合成光纤,让通讯更快捷C.合成药物,让人类更健康D.环保涂料,让环境更宜居分析与赏析:考察化学与生活,涉及风力发电、光导纤维、合成药物、环保涂料。
风力发电,是开发新能源,与化学无关。
光导纤维用于光通讯,合成药物用于治疗疾病,都正确,环保涂料,减少室内环境会污染,。
选择A。
7.下列叙述正确的是A.Fe分别与氯气和稀盐酸反应所得氯化物相同B.K、Zn分别与不足量的稀盐酸反应所得溶液均呈中性C.Li、Na、K的原子半径和密度随原子序数的增加而增加D.C、P、S、Cl的高价氧化物对应水化物的酸性逐渐增强分析与赏析:考察反应原理、元素周期律知识,涉及铁与盐酸、氯气的反应,K与盐酸、水的反应,锌与盐酸的反应,涉及原子半径、密度和最高价氧化物的水化物的酸性强弱比较。
Fe与氯气反应生成氯化铁,Fe与盐酸反应生成FeCl2,氯化物不同;K与HCl反应,过量的K会与水反应,溶液呈碱性,锌与HCl反应后生成ZnCl2,属于强酸弱碱盐,溶液呈酸性;Li、Na、K的原子半径依次增大,但密度,K反常,比Na小;酸性:HClO4>H2SO4>H3PO4>H2CO3,D项正确,选择D。
8.对滴有酚酞试液的下列溶液,操作后颜色变深的是A.明矾溶液加热B.CH3COONa溶液加热C.氨水中加入少量NH4Cl D.小苏打溶液中加入少量的NaCl固体分析与赏析:考察化学平衡移动与实验现象的关系。
A项,明矾水解呈酸性,滴酚酞无色,加热,促进水解,C(H+)增大,颜色依旧无色;B项,CH3COONa溶液水解呈碱性,滴入酚酞显红色,加热,促进水解,C(OH-)增大,红色加深;C项,氨水电离,生成OH-离子,溶液呈碱性,滴入酚酞显红色,加NH4Cl,增大C(NH4+),降低C(OH-),颜色变浅;D项,NaHCO3水解成碱性,滴入酚酞显红色,少量的NaCl固体,平衡不移动,C(OH-)不变,颜色没有变化。
试卷号:B070005(答案)注:各主观题答案中每步得分是标准得分,实际得分应按下式换算:第步实际得分本题实际得分解答第步标准得分解答总标准得分N=N ⨯一、对的在题末括号内填“+”、错的填“-”。
(本大题分9小题, 每小题1分, 共9分)1、-2、+3、+4、+5、-6、-7、+8、-9、+二、将一个或两个正确答案的代码填入题末的括号内。
若正确答案只有一个,多选时,该题为0分;若正确答案有两个,只选一个且正确,给1分,选两个且都正确给2分,但只要选错一个,该小题就为0分。
(本大题分14小题, 每小题2分, 共28分)1、(2)2、(3)3、(3)4、(4)5、(5)6、(2)7、(1)8、(4)9、(3)(4)10、(2)(4)11、(3) 12、(4) 13、(2) 14、(4)三、填空题。
(本大题共11小题,总计23分)1、Fe2+ 1 分2、没有方向性和饱和性 1 分3、波动 1 分4、-61.2kJ⋅mol-1 2 分5、3CaCO3+2Na3PO4⋅12H2O=Ca3(PO4)2↓+3Na2CO3+24H2O或3CaCO3(s)+2PO43-(aq)=Ca3(PO4)2(s)+3CO32-(aq) 2 分6、sp3正四面体不等性sp3三角锥形0.5 分/ 空7、晶 1 分玻璃 1 分8、利用核反应时原子核与原子核或原子核与基本粒子间相互作用时,原子核发生变化而释放的能量 2 分9、还原,+4 , +6氧化,+6 , +3 0.5 分/ 空10、1. 重金属2. 无机阴离子3. 放射性物质4. 有机农药及有机化合物5. 致癌物质(任填3 种)每种1 分,共3 分11、(本小题4分)标准电极电势、离子浓度、电极材料、电极表面性质、电流密度及温度等因素(答出前三种及后三种中任一种即给满分) 4 分四、根据题目要求,通过计算解答下列各题。
(本大题共5小题,总计40分)1、(本小题5分)Al(OH)3+3H+=Al3++3H2OK={c(Al3+)/c}/{c(H+)/c}3={{c(Al3+)/c}{c(OH-)/c}3}/{{c(H+)/c}3{c(OH-)/c}3}=K{Al(OH)3}/(K)3=5⨯10-33/(1⨯10-14)3=5⨯109 5 分2、(本小题8分)(1) ∆r G(298.15 K) = ∑ν∆f G(298.15 K) = -5.3 kJ⋅mol-1,ln K(298.15 K) = -∆r G(298.15 K) / (RT) = 2.138K(298.15 K) = 8.48 4 分(2) ∆r H(298.15 K) = ∑ν∆f H(298.15 K) = -57.9 kJ⋅mol-1,∆r S(298.15 K) = [∆r H(298.15 K) -∆r G(298.15 K)]/T= -0.176kJ⋅mol-1⋅K-1,∆r G(1000 K) ≈∆r H(298.15 K) - T∆r S(298.15 K) = 118.5 kJ⋅mol-1ln K(1000 K) = -∆r G(1000 K) / (RT) = -14.25K(1000 K) = 6.46⨯10-7 8 分[ 也可利用范托夫等压方程式求K(1000K) ]3、(本小题8分)(1) c(H+)=3.63⨯10-3 mol⋅dm-3α={{c(H+)/c}/0.10}⨯100%=3.63% 2 分(2)K=(c1/c)α12=(c2/c)α22=(c1/10c)α22所以α2=(10α12)1/2=11.5%c2(H+)=c2α2=(0.010 mol⋅dm-3)⨯11.5%=1.15⨯10-3 mol⋅dm-3pH= - lg c2(H+)=2.94 6 分(3)K=(c/c)α2=0.10(3.63%)2=1.32⨯10-48 分4、(本小题8分)K={c(ClO-)/c}⋅{c(Cl-)/c}/{p(Cl2)/p}⋅{c(OH-)/c}=K⋅K/(K)2 =9.0⨯1015 5 分E=0.05917 Vlg K/n=0.94 V 8 分5、(本小题11分)(1) ∆r G(298.15 K) = ∑ν∆f G(298.15 K) = -32.86 kJ⋅mol-1 < 0所以常温常压下合成氨反应可自发进行 2 分(2) ∆r H(298.15 K) = ∑ν∆f H(298.15 K) = -92.86 kJ⋅mol-1 3 分∆r S(298.15 K) = ∑νS(298.15 K) = -198.7 J⋅mol-1⋅K-1 4 分所以T≤∆r H(298.15 K) / ∆r S(298.15 K) = 467.3 K ( 或194.1℃) 6 分(3) ∆r G(400 K) ≈∆r H(298.15 K) - T∆r S(298.15 K)= -13.38 kJ⋅mol-18 分ln K(400 K) = -∆r G(400 K) / (RT) = 4.023所以K(400 K) = 55.9 10 分。
重庆大学2011年硕士研究生入学考试试题科目代码:847科目名称:结构力学特别提醒:答题一律做在答题纸上(包括填空题、选择题、改错题等),直接做在试卷不给分。
总分:150分1.填空题(每小题6分,共30分)1.1 图1.1所示体系为几何 体系,多余约束数为 个。
图1.11.2 图1.2所示两结构中,若EI 2>EI 1,则横梁杆端弯矩M BA 及M DC 的大小关系为 。
图1.21.3 图1.3(a)所示结构的力法基本体系为图1.3(b)所示,力法典型方程为111122 1211222 20c c X X X X δδ∆δδ∆++=⎧⎨++=⎩。
其中,自由项 1c ∆= 、 2c ∆= 。
(a)(b)2图1.3第 1 页 共 5 页1.4 图1.4所示结构中,AB 杆的杆端弯矩M BA = 。
BC 杆的轴力F N BC = 。
图1.41.5 图1.5所示体系中,12m m m ==,EI 为常数,不计阻尼。
质点1m 上承受简谐荷载,设荷载频率θ由零开始逐渐增大,当其刚好达到 时,质点2m 的振幅便达到无穷大。
图1.52. 绘图2所示结构的M 、F Q 、F N 图。
(12分)图23. 计算图3所示桁架中杆件1、2的轴力。
(10分)图3第 2 页 共 5 页4.用力法计算并作图4所示结构的M 图;求截面B 的转角B ,并勾绘变形曲线。
各杆EI 相同,为常数。
(14分)图45. 用位移法计算图5所示结构,并作M 、F Q 、F N 图。
EI 为常数。
(15分)图56. 用力矩分配法计算图6所示结构,并作M 图。
各杆EI 相同,为常数。
(12分)图6第 3 页 共 5 页7. 图7所示纵次梁上的移动荷载可任意移动。
试求主梁支座截面A左侧的剪力F Q A左的最大值和最小值。
(12分)图78. 图8所示刚架,各杆EI、EA及杆长l均相同,l=4m。
用矩阵位移法先处理法计算时:(1)结构刚度矩阵[K]中至少有多少个零元素?并求出其中k、55k的值;(2)试形成结构的综合结点荷载列阵{P}。