β不饱和羧酸的反应
- 格式:ppt
- 大小:1.30 MB
- 文档页数:72

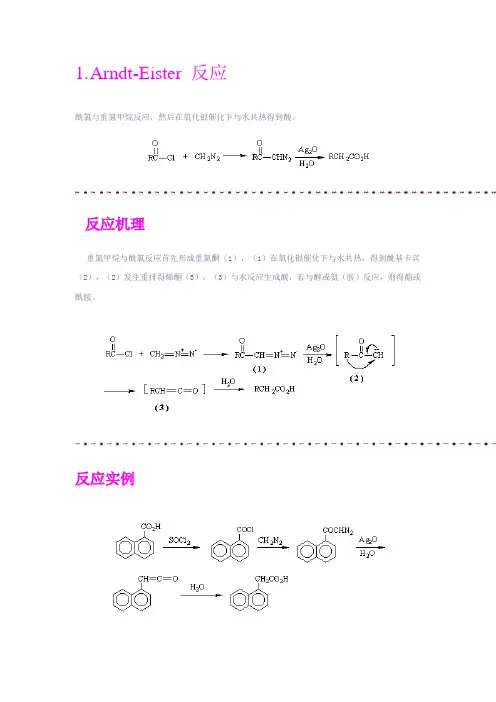
1.A rndt-Eister 反应酰氯与重氮甲烷反应,然后在氧化银催化下与水共热得到酸。
反应机理重氮甲烷与酰氯反应首先形成重氮酮(1),(1)在氧化银催化下与水共热,得到酰基卡宾(2),(2)发生重排得烯酮(3),(3)与水反应生成酸,若与醇或氨(胺)反应,则得酯或酰胺。
反应实例2.Baeyer----Villiger 反应反应机理过酸先与羰基进行亲核加成,然后酮羰基上的一个烃基带着一对电子迁移到-O-O-基团中与羰基碳原子直接相连的氧原子上,同时发生O-O键异裂。
因此,这是一个重排反应具有光学活性的3---苯基丁酮和过酸反应,重排产物手性碳原子的枸型保持不变,说明反应属于分子内重排:不对称的酮氧化时,在重排步骤中,两个基团均可迁移,但是还是有一定的选择性,按迁移能力其顺序为:醛氧化的机理与此相似,但迁移的是氢负离子,得到羧酸。
反应实例酮类化合物用过酸如过氧乙酸、过氧苯甲酸、间氯过氧苯甲酸或三氟过氧乙酸等氧化,可在羰基旁边插入一个氧原子生成相应的酯,其中三氟过氧乙酸是最好的氧化剂。
这类氧化剂的特点是反应速率快,反应温度一般在10~40℃之间,产率高。
3.Beckmann 重排肟在酸如硫酸、多聚磷酸以及能产生强酸的五氯化磷、三氯化磷、苯磺酰氯、亚硫酰氯等作用下发生重排,生成相应的取代酰胺,如环己酮肟在硫酸作用下重排生成己内酰胺:反应机理在酸作用下,肟首先发生质子化,然后脱去一分子水,同时与羟基处于反位的基团迁移到缺电子的氮原子上,所形成的碳正离子与水反应得到酰胺。
迁移基团如果是手性碳原子,则在迁移前后其构型不变,例如:反应实例4.Birch还原芳香化合物用碱金属(钠、钾或锂)在液氨与醇(乙醇、异丙醇或仲丁醇)的混合液中还原,苯环可被还原成非共轭的1,4-环己二烯化合物。
反应机理首先是钠和液氨作用生成溶剂化点子,然后苯得到一个电子生成自由基负离子(Ⅰ),这是苯环的л电子体系中有7个电子,加到苯环上那个电子处在苯环分子轨道的反键轨道上,自由基负离子仍是个环状共轭体系,(Ⅰ)表示的是部分共振式。

6 缩合反应缩合反应一般指两个或多个有机化合物分子形成较大的分子的反应,此外缩合反应也可以发生在分子内。
缩合过程常伴有小分子消除。
通过缩合反应可以形成碳碳键、碳杂键,进而达到增碳、引入官能团以及成环等目的,在药物合成中占有重要地位。
本章内容主要为含活泼氢化合物(醛、酮和酯)之间的缩合反应。
6.1alpha-羟烷化、alpha-卤烷化和alpha-氨(胺)烷化反应指在底物分子的某位置引入alpha-羟烷基、alpha-卤烷基和alpha-氨烷基的反应。
alpha是指羟基(卤素和氨(胺)基)直接与引入的烷基的碳相连。
6.1.1alpha-羟烷化(1)羰基alpha碳的alpha-羟烷化(羟醛缩合)具活泼氢的醛(酮)在碱(或酸)的催化下,自身或交叉缩合,生成beta-羟基醛或酮的反应。
最初是因为烯醇负离子对一个醛(aldehyde)加成得到醇(alcohol)而得名(aldol)。
反应机理为烯醇(负离子)对羰基的亲核加成。
①具活泼氢的醛或酮的自身缩合反应可以是碱催化的。
根据反应条件的不同,生成的beta-羟基醛或酮可以发生消除而生成烯,如丁醛的羟醛缩合反应。
也可以用酸催化,比如硫酸、盐酸以及离子交换树脂等。
碱能催化的原因在于碱可以夺取底物的质子,使其形成烯醇负离子;酸能催化的原因在于酸既能质子化羰基,使之更容易被亲核试剂进攻,也能帮助烯醇式的形成,又能催化脱水。
对称酮缩合产物单一。
对于不对称酮,不论碱催化或酸催化,反应主要发生在含氢较多的alpha碳原子上,得到beta羟基酮或其脱水物。
②芳醛与具活泼氢的醛或酮的缩合芳醛与具活泼氢的醛或酮的缩合可生成b羟基芳丙醛(酮),并进一步消除生成更稳定的芳丙烯醛(酮),即Claisen-Schmidt反应。
消除产物以反式构型为主,如苯甲醛与苯乙酮的缩合。
这与过渡态的稳定性有关(反式共平面消除)。
芳醛与两个alpha位都含活泼氢的酮反应时,酸催化倾向于在含氢较少的位置缩合,碱催化与此相反。




1. Aldol Condensation:羟醛缩合是一种有机反应:烯醇或烯醇负离子和羰基化合物反应形成β-羟基醛或者β-羟基酮,然后发生脱水得到共轭烯酮。
反应第一步为羟醛反应,第二部反应为脱水反应。
酸催化碱催化图例使用OCH3 做碱2.Baeyer –Villiger Oxidation酮在过氧化物如过氧化氢、过氧化羧酸等氧化下,在羰基和一个邻近烃基之间引入一个氧原子,得到相应的酯的化学反应。
醛可以进行同样的反应,氧化的产物是相应的羧酸。
2.Baylis –Hillman Reactionαβ-不饱和化合物与亲电试剂(醛、酮)在合适的催化剂作用下,生成烯烃α-位加成产物的反应。
催化剂一般采用DABCO(14-二氮双环222辛烷的缩写形式,俗称:三亚乙基二胺),生成物为烯丙基醇1。
贝里斯-希尔曼反应经历叔胺与活化烯烃的Michael 加成反应启动的加成-消除反应历程4. Beckmann Rearrangement是一个由酸催化的重排反应,反应物肟在酸的催化作用下重排为酰胺。
若起始物为环肟,产物则为内酰胺。
α-二酮、α-酮酸、α-叔烃基酮反式、α-二烷基氨基酮、α-羟基酮和β-酮醚生成的肟在路易,又斯酸或质子酸的作用下断裂为腈及相应的官能团化合物。
这个反应称为―异常贝克曼重排‖称非正常贝克曼重排;二级贝克曼重排;贝克曼断裂反应等。
5. Benzoin Condensation 安息香缩合反应,又称苯偶姻缩合,是一个有机反应,是氰离子催化下两分子芳香醛进行缩合生成一个偶姻分子的反应。
由于生成物是安息香(Ph-CO-CHOH-Ph)的衍生物,故名??. Birch Reduction钠和醇在液氨中将芳香环还原成14-环己二烯的有机还原反应。
Birch 还原的重要性在于:尽管剩下的双键(非芳香性)更为活泼,该反应却能停留在环己双烯上,而不继续还原。
反应中的钠也可以用锂或钾取代,使用的醇通常是甲醇或叔丁醇。

β-氨基酸的合成方法β-氨基酸是一类具有β-羧基和β-氨基的氨基酸,其合成方法有多种途径。
本文将就几种常见的β-氨基酸合成方法进行介绍。
一、Strecker合成法Strecker合成法是一种常用的合成β-氨基酸的方法。
该方法以α-氨基酸和醛类或酮类化合物为原料,在酸性条件下进行反应。
首先,醛类或酮类化合物与氨氰酸反应生成氨基酮,然后与α-氨基酸进行缩合反应,生成对应的β-氨基酸。
二、Enzymatic合成法Enzymatic合成法是利用酶催化反应合成β-氨基酸的方法。
其中一种常用的酶是氨基酸转氨酶。
该酶能够将α-氨基酸转化为β-氨基酸。
在反应中,氨基酸转氨酶与α-氨基酸和酮类底物反应,生成对应的β-氨基酸。
三、Decarboxylation合成法Decarboxylation合成法是一种通过羧基的脱羧反应合成β-氨基酸的方法。
在该合成方法中,β-氨基酸的合成可通过α-氨基酸经过一系列反应得到。
首先,α-氨基酸经过酸催化下的羧基脱羧反应形成亚胺酸,然后亚胺酸经过还原反应生成相应的β-氨基酸。
四、Michael加成反应Michael加成反应也是一种常用的合成β-氨基酸的方法。
该反应是以α,β-不饱和羧酸为底物,与胺类化合物进行加成反应,生成β-氨基酸。
在反应中,羧酸底物的α,β-不饱和键与胺类化合物发生加成反应,生成β-氨基酸。
以上是常见的几种合成β-氨基酸的方法,每种方法都有其适用的场景和优缺点。
在实际应用中,选择合适的方法取决于目标化合物的结构和合成要求。
通过不同的合成方法,可以合成多种不同的β-氨基酸,为药物研发和生物化学研究提供了重要的工具和基础。
同时,随着合成方法的不断发展和改进,对于合成β-氨基酸的效率和选择性也得到了显著提高。
β-氨基酸的合成方法有多种途径,包括Strecker合成法、Enzymatic合成法、Decarboxylation合成法和Michael加成反应等。
这些方法在合成β-氨基酸中发挥着重要的作用,为相关领域的研究提供了有效的手段。

Oppenaue氧化欧芬脑尔氧化法:在异丙醇铝或叔丁醇铝存在下,仲醇和丙酮反应,仲醇氧化成酮,丙酮转化成还原成醇。
Pinacol重排频哪醇重排,相当于碳正离子重排。
Williamson合成法威廉姆逊合成法卤代烃和醇钠作用生成醚的方法。
Friedel-Crafts反应傅克反应(烷基化,酰基化)但苯环上连有吸电子基团如硝基等时,不能发生反应。
Haloform reaction卤仿反应:乙醛、甲基酮、乙醇和α-碳上连有甲基的仲醇与次卤酸盐反应生成卤仿和少一个碳的羧酸。
Aldol condensation羟醛缩合:两分子含有α-氢的醛在酸或碱催化下,相互结合形成β-羟基醛的反应。
Claisen-Schmidt反应克莱森-许密特反应:由芳香醛和含有α-氢的脂肪醛或酮进行交叉羟醛缩合生成α,β-不饱和醛或酮的反应。
Mannich反应曼尼希反应:含有α-活泼氢的酮与甲醛及胺反应,可以在酮的α位引入一个胺甲基。
Clemmensen还原法克莱门森还原法:醛、酮与锌汞齐和浓盐酸回流反应,羰基被还原成亚甲基黄鸣龙还原法:醛、酮在肼、氢氧化钠(或氢氧化钾)的水溶液中,与二缩乙二醇回流反应,被还原成亚甲基。
Meerwein-Ponndorf还原麦尔外因-彭杜尔夫还原:在异丙醇铝-异丙醇的作用下,醛、酮可悲还原成醇,异丙醇转化成丙酮。
Cannizzaro反应:康尼查罗反应:无α-氢的醛在浓碱作用下发生分子间反应,一分子醛被还原成醇,另一分子醛被氧化成酸。
Benzoin缩合反应:安息香缩合反应:芳醛在氰基负离子催化下,生成α-羟基酮的反应。
Wittig反应魏悌希反应:醛、酮与磷叶立德反应生成烯烃的反应。
Gattermann-Koch反应:盖特曼-柯赫反应:在催化剂无水氯化铝和氯化亚铜存在下,芳烃与氯化氢和一氧化碳混合气体作用,生成芳醛的反应。
Michael加成:麦克尔加成:α,β-不饱和醛或酮和亲核的碳负离子进行的1,4-共轭加成反应。

第十六章 不饱和羧酸和取代羧酸§1. 不饱和酸酸1. α,β-不饱和羧酸的制法⑴ 卤代酸去卤化氢 α-卤代酸酯在碱性试剂存在下脱去卤化氢,生成α,β-不饱和羧酸酯。
例如:CH 3(CH 2)92CH 3CH 3Br160~170C H 3C(H 2C)9HC 2CH 3CH 3⑵ 芳香醛的缩合① Knoevenagel 反应: 芳醛在含少量的六氢吡啶的吡啶催化下,与丙二酸一起回流,直接得到α,β-不饱和羧酸。
C 6H 5CHO + CH 2(CO 2H)2pyridinepiperidine,110C,1hC 6H 5HC CHCO 2H + CO 2 + H 2O② Perkin 反应:C 6H 5CH=O +C O O H 3C C OCH 332-+C 6H 5HC CHCO 2H2. α,β-不饱和羧酸的反应① 1,4-加成H 2C CHCOHOO2CH 2CO 2H)2② 与共轭二烯烃反应+CO 2CH 2CH 3§2 卤代酸1. 卤代酸的制法① α-卤代酸用郝尔-沃耳霍德-泽林斯基反应制备,例如:CH 2O HBr,NBSCHCCl O CHCOR O② β-卤代酸由α,β-不饱和羧酸与卤代氢的加成得到:RHC O+ HXRCHCH 2COOH2. 卤代酸的反应α-卤代酸及其衍生物中路原子在羰基的影响下,活性增强,容易与各种亲核亲核试剂起S N 2反应,生成α-取代羧酸。
ClCH 2COR O+ Nu -NuCH 2COR O+ Cl -Nu - = HO - ,-CN , -NHR'§3. 醇 酸羧酸分子中饱和碳原子上有羟基的称谓醇酸。
一般根据其来源命名 如:CH 3CH(OH)COOHC 6H 5CH(OH)COOHHOOCH(OH)CH2COOHHOOCCH(OH)CH(OH)COOHHOOCCH 2COH(COOH)CH 2COOH乳酸扁桃酸苹果酸酒石酸柠檬酸1. 醇酸的性质和反应:醇酸分子中含有两个或两个以上的能参与氢键形成的官能团。
1.A rndt-Eister 反应酰氯与重氮甲烷反应,然后在氧化银催化下与水共热得到酸。
反应机理重氮甲烷与酰氯反应首先形成重氮酮(1),(1)在氧化银催化下与水共热,得到酰基卡宾(2),(2)发生重排得烯酮(3),(3)与水反应生成酸,若与醇或氨(胺)反应,则得酯或酰胺。
反应实例2.Baeyer——--Villiger 反应反应机理过酸先与羰基进行亲核加成,然后酮羰基上的一个烃基带着一对电子迁移到—O—O—基团中与羰基碳原子直接相连的氧原子上,同时发生O—O键异裂。
因此,这是一个重排反应具有光学活性的3-——苯基丁酮和过酸反应,重排产物手性碳原子的枸型保持不变,说明反应属于分子内重排:不对称的酮氧化时,在重排步骤中,两个基团均可迁移,但是还是有一定的选择性,按迁移能力其顺序为:醛氧化的机理与此相似,但迁移的是氢负离子,得到羧酸。
反应实例酮类化合物用过酸如过氧乙酸、过氧苯甲酸、间氯过氧苯甲酸或三氟过氧乙酸等氧化,可在羰基旁边插入一个氧原子生成相应的酯,其中三氟过氧乙酸是最好的氧化剂。
这类氧化剂的特点是反应速率快,反应温度一般在10~40℃之间,产率高。
3.Beckmann 重排肟在酸如硫酸、多聚磷酸以及能产生强酸的五氯化磷、三氯化磷、苯磺酰氯、亚硫酰氯等作用下发生重排,生成相应的取代酰胺,如环己酮肟在硫酸作用下重排生成己内酰胺:反应机理在酸作用下,肟首先发生质子化,然后脱去一分子水,同时与羟基处于反位的基团迁移到缺电子的氮原子上,所形成的碳正离子与水反应得到酰胺。
迁移基团如果是手性碳原子,则在迁移前后其构型不变,例如:反应实例4.Birch还原芳香化合物用碱金属(钠、钾或锂)在液氨与醇(乙醇、异丙醇或仲丁醇)的混合液中还原,苯环可被还原成非共轭的1,4-环己二烯化合物。
反应机理首先是钠和液氨作用生成溶剂化点子,然后苯得到一个电子生成自由基负离子(Ⅰ),这是苯环的л电子体系中有7个电子,加到苯环上那个电子处在苯环分子轨道的反键轨道上,自由基负离子仍是个环状共轭体系,(Ⅰ)表示的是部分共振式.(Ⅰ)不稳定而被质子化,随即从乙醇中夺取一个质子生成环己二烯自由基(Ⅱ).(Ⅱ)在取得一个溶剂化电子转变成环己二烯负离子(Ⅲ),(Ⅲ)是一个强碱,迅速再从乙醇中夺取一个电子生成1,4—环己二烯。
不饱和羧酸的卤内酯化反应机理
不饱和羧酸的卤内酯化反应机理是指通过卤素化试剂,将不饱和羧酸转化为相应的卤内酯的化学反应机理。
一种常用的卤素化试剂是氯化亚砜(SOCl2)。
下面是不饱和羧酸的卤内酯化反应机理的步骤:
1. 氯化亚砜(SOCl2)与不饱和羧酸发生酯化反应,生成酸氯化物中间体和氯化氢(HCl):
不饱和羧酸+ SOCl2 → 酸氯化物中间体 + HCl
2. 酸氯化物中间体与反应溶剂(如二甲基甲酰胺、DMF)反应,生成酰氯中间体:
酸氯化物中间体 + 反应溶剂→ 酰氯中间体
3. 酰氯中间体与反应溶剂中的卤素离子(如Cl-)发生亲电取代反应,生成卤内酯:
酰氯中间体 + 卤素离子→ 卤内酯
需要注意的是,反应过程中生成的氯化氢(HCl)可以进一步和反应溶剂中的碱(如DMF)反应,生成相应的盐,以维持反应的进行。
需要注意的是,不同的不饱和羧酸结构和反应条件可能会导致不同的机理细节。
此外,还有其他卤素化试剂(如三氯氧磷、氯化亚磷等)也可以用于不饱和羧酸的卤内酯化反应。
因此,在具体的实验条件下,可能会有一些细节上的变化和差异。
不饱和羧酸的作用原理
不饱和羧酸是指分子中含有至少一个碳-碳双键和一个羧基的化合物。
不饱和羧酸可以参与许多化学反应,其作用原理主要有以下几种:
1. 加成反应:不饱和羧酸可以与其他化合物发生加成反应,其中碳-碳双键上的π电子云会被其他反应物的电子云攻击形成新的化学键。
例如,不饱和羧酸与丙烯酸酯反应生成共轭酯。
2. 氧化反应:不饱和羧酸可以通过氧化反应发生化学变化,其中它们中的碳原子会损失电子从而形成氧化状态更高的产物。
例如,不饱和羧酸可以被过氧化氢氧化为相应的酮或醛。
3. 物理结构改变:不饱和羧酸分子中的碳-碳双键可以通过加热或光照等外部条件引发环化反应,从而改变分子的物理结构。
例如,不饱和羧酸可以发生迈克尔式加合反应,形成环状产物。
综上所述,不饱和羧酸的作用原理主要体现在其参与加成反应、氧化反应和可能的物理结构改变方面。
这些反应为不饱和羧酸提供了丰富的化学活性,使其在许多领域中具有广泛的应用价值。
瑞佛马斯基反应实例瑞佛马斯基反应,一个在有机化学中具有重要地位的反应,涉及到溴代乙酸酯与金属锌在惰性溶剂中的相互作用。
这一反应的产物,β-羟基酸酯,是一个关键的中间体,可进一步转化为更具价值的α,β-不饱和羧酸。
首先,让我们深入了解这一反应的过程。
当溴代乙酸酯与金属锌在适当的惰性溶剂中混合时,会产生一种有机锌试剂。
这种有机锌试剂具有高度的反应活性,能够与醛、酮等羰基化合物进行加成反应。
值得注意的是,这种反应并不会与酯的羰基发生,这为选择性合成提供了可能。
生成的β-羟基酸酯可以通过一系列转化得到我们所需的产物。
例如,通过水解或脱水反应,β-羟基酸酯可以被转化为α,β-不饱和羧酸。
这些羧酸在许多化学和生物过程中具有关键作用,因此瑞佛马斯基反应在合成这些化合物方面具有不可替代的地位。
为了实现这一反应的最佳效果,原料的选择和溶剂的种类是关键。
通常,α-溴代酸酯是最常用的原料,而乙醇、苯、甲苯等溶剂则提供了适宜的反应环境。
然而,这一过程中也存在一些副反应的风险,如α-溴代酸酯的自身缩合和羰基化合物的自身缩合等。
为了抑制这些副反应,科研人员发现使用α-溴代酸叔丁酯可以起到一定的效果。
此外,不同种类的酮在瑞佛马斯基反应中的表现也有所不同。
一些酮可以顺利地进行反应,而位阻较大的酮则可能导致生成的β-羟基酸酯脱水转化为α,β-不饱和酸酯。
这一现象为我们提供了更多的合成策略选择。
综上所述,瑞佛马斯基反应是一种选择性高、应用广泛的有机化学反应。
通过对反应机理的深入了解和实验条件的优化,科研人员能够更好地利用这一反应来合成具有重要价值的化合物。
这一领域的不断探索和进步将有助于推动有机化学的发展,并为未来的科学研究和技术创新提供更多可能性。
α,β-不饱和羧酸α,β-不饱和羧酸化合物是有机酸大家族的一大组成部分,其可作为反应中间体在有机合成中发挥至关重要的作用,或者作为反应的最终产物,是一类重要的精细化学品。
例如,它们已被用于制备生物相关的化合物,具有抗菌等医用价值。
此外,它们存在于一些天然产品中(例如,蜂王汁和咖啡酸等),是有机合成中的多功能构建模块。
另外,α,β-不饱和羧酸化合物在食品工业、聚合物工业、香水工业、医学和技术应用等领域都有着非常广泛且重要的应用,因此寻找方便经济高效的方法来合成α,β-不饱和羧酸化合物非常重要。
α,β-不饱和羧酸化合物的制备方法有很多种,knoevenagel-doebner反应是获得碳-碳双键的从而得到α,β-不饱和羧酸的一种应用广泛的方法,可以由二溴甲基芳烃和丙二酸反应得到;另一类是羧基化方法,主要是通过炔烃与二氧化碳的氢羧酸化反应生成α,β-不饱和羧酸,比如制备2-苯基丙烯酸;还有很重要的一类是利用co或者甲酸通过羰基化途径对炔烃进行氢羧酸化反应。
后两类方法是目前科研领域研究较为集中的。
利用co2的整体插入来实现炔烃的氢羧酸化需要催化量的还原试剂,常见的主要可以分为1)极其敏感的金属试剂,如二乙基锌;2)活泼的金属,如锌粉,锰粉;3)硅氢类还原剂,其原料易得且反应温和,是较为理想的还原剂。
但是需要注意的是通过co2分子全部插入来实现炔烃的氢羧酸转化的反应只限于中间炔烃,无法很好地实现端炔的氢羧酸化。
利用co插入的途径是另外一种主要的实现炔烃氢羧酸化的方法。
早期的研究者利用co通过钯催化的羰基化策略可以在甲酸或草酸的存在下实现末端炔烃的加氢羧化(.chem.1993,58,4739-4741)(organometallics1993,12,712-724)。
然而,有毒和易燃co的固有缺点阻碍了其更广泛的应用。
为了解决这个问题,zhou和fu使用甲酸作为co替代物并加入催化量的酸酐(angew.chem.int.ed.2015,54,6302–6305)(greenchem.,2016,18,2981–2984)(acscatal.2016,6,2501-2505),实现了钯或镍催化的内部或末端炔烃的加氢羧化。
knoevenagel-doebner反应机理
Knoevenagel-Doebner反应是一种重要的有机合成反应,它可
以将一个醛或酮与一个活性甲烷化合物(通常是醛缩酮)进行加成反应,生成不饱和羧酸或酮。
该反应的机理如下:
1. 先将醛或酮与活性甲烷化合物中的碱性氢原子发生酸碱反应,形成一个互变形式更稳定的负离子:
R1-C=O + R2-C(H)(OH)2 -> R1-C^-O + R2-C(H)(OH)O
2. 负离子与活性甲烷化合物中的α,β-不饱和部分发生亲核加成反应,生成一个共轭加合物:
R1-C^-O + R2-C(H)(OH)O -> R1-C=C-C(O)R2-C(H)(OH)O
3. 共轭加合物进一步发生脱水反应,形成不饱和羧酸或酮:
R1-C=C-C(O)R2-C(H)(OH)O -> R1-C=C-C(O)R2 + H2O
需要注意的是,Knoevenagel-Doebner反应中的活性甲烷化合
物通常是醛缩酮,即含有酮和醛功能团的化合物。
这是因为一个醛或酮只含有一个活性氢原子,无法提供足够的碱性氢原子参与反应,而醛缩酮含有两个或更多的活性氢原子,能够提供足够的反应位点。
此外,反应中常使用碱性催化剂,如胺或碱金属盐,来促进负离子的形成和亲核加成反应的进行。