称为酶的发酵生产
- 格式:ppt
- 大小:3.54 MB
- 文档页数:48

酶的生产工艺酶是一种生物催化剂,它在许多各行各业的应用中具有广泛的用途。
酶的生产工艺是指通过生物工程技术和发酵工艺来大规模生产酶的过程。
酶的生产工艺主要包括以下几个步骤:1. 酶基因的克隆和表达:首先需要从天然菌株或其他来源中获得酶的基因。
通过核酸技术,将酶基因从DNA中克隆并插入表达载体中。
然后将表达载体转化到宿主细胞中,使宿主细胞能够表达目标酶的基因。
2. 发酵培养:经过基因工程改造的细胞株能够在合适的培养条件下高效表达酶。
发酵培养是通过提供适宜的营养物质和环境条件来培养这些细胞的过程。
其中,培养基的选择、操作工艺的优化和控制等因素对酶的生产量和质量有重要影响。
3. 酶的提取和纯化:经过发酵培养后,酶可存在于细胞内、细胞外或培养液中。
提取和纯化酶的过程需要选择合适的方法,如加热处理、超声波溶解、离心、过滤、层析等。
目的是分离纯酶,并去除其他蛋白质、细胞碎片、有机物等杂质。
4. 酶的稳定化和保存:酶的稳定性对其储存和运输至关重要。
稳定化的方法包括添加保护剂、介质改良、冻干等。
此外,酶的保存过程中要注意严格的冷链管理,避免温度和湿度的变化。
5. 酶的应用:生产出的酶可用于各种行业,如食品加工、制药、酿酒、制革、纺织、洗涤剂等。
酶在这些行业中起到催化剂和增效剂的作用,提高生产效率,减少能源消耗,保护环境等。
总之,酶的生产工艺是通过基因工程技术和发酵工艺来实现大规模生产酶的过程,它涉及到酶基因的克隆和表达、发酵培养、酶的提取和纯化、稳定化和保存等多个步骤。
随着生物工程技术的不断发展,新的酶生产工艺也在不断涌现,为酶的生产提供了更多的选择和可能。


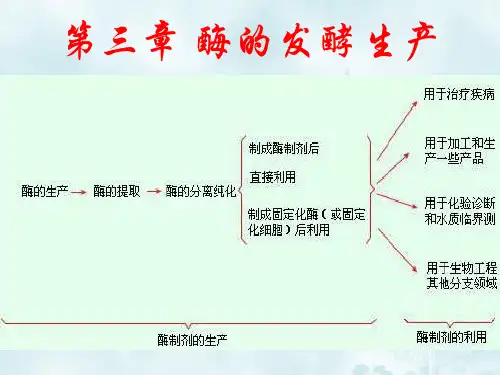
酶的⽣产⽅法介绍
酶的⽣产是指经过预先设计,并且通过⼈⼯控制⽽获得所需要酶的过程。
概括地说,酶的⽣产⽅法有提取法、发酵法和化学合成法三种。
(⼀)提取法
提取法是最早采⽤并且⼀直沿⽤⾄今的⼀种⽅法。
提取法采⽤各种技术,直接从动植物或微⽣物的细胞或组织中将酶提取出来。
提取法虽简单易⾏,但必须要有充⾜的原材料,这就使提取法的⼴泛应⽤受到了限制。
但是,在动植物或微⽣物资源丰富的地区,提取法仍然具有应⽤价值。
例如,在屠宰⼚,可从家畜胰脏中提取胰酶;在⽔果加⼯⼚,可从菠萝⽪中提取菠萝蛋⽩酶。
(⼆)发酵法
发酵法是20世纪50年代以来⽣产酶的主要⽅法。
发酵法主要通过微⽣物发酵来获得⼈们所需要的酶。
发酵法⼀般包括固体发酵、液体深层发酵、固定化细胞发酵和原⽣质体发酵等多种⽅式。
(三)化学合成法
化学合成法是20世纪60年代末出现的⼀种⽣产酶的技术。
1969年,美国科学家⾸次采⽤化学合成的⽅法获得了含有124个氨基酸的核糖核酸酶。
但是,化学合成法的成本⽐较⾼,并且只能合成那些已知化学结构的酶。
所以,化学合成法⽬前仍然停留在实验室内合成的阶段。



酶工程•第一章绪论•第二章酶的发酵生产•第三章酶的分离纯化•第四章酶分子修饰•第五章酶与细胞固定化•第六章酶反应动力学•第七章酶的应用第一章绪论•第一节酶的概述•第二节酶工程概述•第三节酶的生产方法•第四节酶的应用前景第一节酶的概述一. 酶(enzyme)的概念二. 酶的研究历史三. 酶的分类与命名四. 酶的活力测定一. 酶(enzyme)的概念1.酶是催化剂(catalyst)所谓催化剂是一类能改变反应速度,但不改变反应性质、反应方向和反应平衡点,而且本身在反应前后也不发生变化的外在因素。
酶在化学反应中就是充当这样的角色。
2.酶是一种特殊的催化剂3.酶是生物催化剂酶在催化反应时,具有与一般非酶催化剂不同的特点。
其具有催化的高效性、高度专一性及化学本质是蛋白质的特点。
(1)酶具有催化的高效性酶能在温和条件下(常温、常压和近中性PH),极大地提高反应速度,与非酶催化剂相比,酶的催化效率可高出107~1012倍。
如:2H2O2 2H2O + O2该反应的催化剂可以有Fe+、血红素和过氧化氢酶,其催化反应的速度分别是:5.6×10-4mol/mol Fe+.S、6.0×10-1mol/mol血红素.S、3.5×106mol/mol过氧化氢酶.S(2)酶具有催化的高度专一性(specificity)酶作用的的专一性是指酶在催化反应时,通常只作用一种或一类反应物发生相应的反应的特性。
酶作用的专一性主要表现在以下几个方面:a. 绝对专一性:酶只能催化一种反应物发生反应的特性如:谷氨酸脱氢酶只能催化L-谷氨酸脱氢,对其他氨基酸没有作用,其具有绝对专一性。
b. 相对专一性:酶在催化反应时,允许底物分子有一些变化,即可以催化一类反应物发生反应。
如:酯酶催化酸与醇缩合成酯,但对反应物分子的侧链基团专一性不强。
淀粉酶、蛋白水解酶也具有这种专一性。
c. 异构专一性:酶对反应物分子的立体异构体和顺反异构体具有高度的选择能力。

超临界萃取:又称为超临界流体萃取,是利用欲分离物质与杂质在超临界流体中的溶解度不同而达到分离的一种萃取技术。
大分子结合修饰:采用水溶性大分子与酶的侧链基团共价结合,使酶分子空间构象发生改变,从而改变酶的特性与功能的方法称大分子结合修饰。
定点突变:是20世纪80年代发展起来的一种基因操作技术。
是指在DNA序列中的某一特定位点上进行碱基的改变从而获得突变基因的操作技术。
反胶束萃取:是利用反胶束将酶或其他蛋白质从混合液中萃取出来的一种分离纯化技术。
反胶束又称反胶团,是表面活性剂分散于连续有机相中形成的纳米尺度的一种聚集体。
反胶束溶液是透明的,热力学稳定的系统。
反馈阻遏作用:酶生物合成的反馈阻遏作用又称产物阻遏作用,是指酶催化反应的产物或代谢途径的末端产物使该酶的生物合成受到阻遏的现象。
分解代谢阻遏作用:是指某些物质(主要是指葡萄糖和其他容易利用的碳源等)分解代谢和产物阻遏某些酶(主要是诱导酶)生物合成的现象。
固定化酶:固定在水不溶性载体上,并在一定的空间范围内进行催化反应的酶,称为固定化酶。
固定化细胞:固定在载体上,并在一定的空间范围内进行生命活动的细胞称为固定化细胞。
固定化原生质体:指固定在载体上,并在一定的空间范围内进行生命活动的原生质体。
抗体酶:又称为催化性抗体,是一类具有生物催化功能的抗体分子。
抗体酶同时具有抗体的高度特异性以及酶的高效催化能力,是通过人工设计、采用现代生物技术而获得的一类新的生物催化剂,有些是在自然界原本不存在的。
离子交换层析:是利用离子交换剂上的可解离基团(活性基团)对各种离子的亲和力不同而达到分离目的的一种层析分离方法。
酶的发酵生产:经过预先设计,通过人工操作,利用微生物的生命活动获得所需酶的技术过程,称为酶的发酵生产。
酶的诱导合成:加进某些物质,使酶的生物合成开始或加速进行的现象,称为酶生物合成的诱导作用,简称诱导作用。
酶反应器:用于酶进行催化反应的容器及其附属设备称为酶反应器。


一、判断题(每题1分,共10分)1. 酶是具有生物催化特性的特殊蛋白质。
(×)2. 酶活力是指在一定条件下酶所催化的反应速度,反应速度越大,意味着酶活力越高。
(√)3. 液体深层发酵是目前酶发酵生产的主要方式。
(√)4. 培养基中的碳源,其唯一作用是能够向细胞提供碳素化合物的营养物质。
(×)5. 在酶与底物、酶与竞争性抑制剂、酶与辅酶之间都是互配的分子对,在酶的亲和层析分离中,可把分子对中的任何一方作为固定相。
(√)6. 补料是指在发酵过程中补充添加一定量的营养物质,补料的时间一般以发酵前期为好。
(×)7. 酶固定化过程中,固定化的载体应是疏水的。
(×)8. 在酶的抽提过程,抽提液的pH应接近酶蛋白的等电点。
(×)9. 青霉素酰化酶不但能催化青霉素侧链的水解作用,而且也能催化逆反应。
(√)10.亲和试剂又称活性部位指示试剂,这类修饰剂的结构类似于底物结构。
(√)11.酶的分类与命名的基础是酶的专一性。
(√)12.膜分离过程中,膜的作用是选择性地让小于其孔径的物质颗粒成分或分子通过,而把大于其孔径的颗粒截留。
(√)13.角叉菜胶也是一种凝胶,在酶工程中常用于凝胶层析分离纯化酶。
(╳)14.α-淀粉酶在一定条件下可使淀粉液化,但不称为糊精化酶。
(╳)15.酶法产生饴糖使用α-淀粉酶和葡萄糖异构酶协同作用。
(╳)二、填空题(每空1分,共10分)1. 日本称为“酵素”的东西,中文称为____酶_,英文则为__enzyme_,是库尼(Kuhne)于1878年首先使用的。
2. 1926年,萨姆纳(Sumner)首先制得__脲酶_酶结晶,并指出_脲酶_是蛋白质。
他因这一杰出贡献,获1946年度诺贝尔化学奖。
3.1960年,雅各布(Jacob)和莫诺德(Monod)提出了操纵子学说,认为DNA分子中,与酶生物合成有关的基因有四种,即启动基因、操纵_基因和__结构__基因。

酶工程—名词解释1.酶:生物体内进行新陈代谢不可缺少的受多种因素调节控制的具有催化能力的生物催化剂。
2.酶工程:是酶学和工程学相互渗透结合形成的一门新的技术科学。
从应用目的出发研究酶,在一定的生物反应装置中利用酶的催化性质,将相应原料转化成有用的物质。
3.单体酶(monomeric enzyme):由一条多肽链组成,如溶菌酶;由多条肽链组成,肽链间二硫键相连构成一整体。
4.寡聚酶(oligomeric enzyme):由两个或两个以上的亚基组成的酶。
5.多酶复合体(multienzyme complex):由几种酶非共价键彼此嵌合而成。
6.催化转换数:每个酶分子每分钟催化底物转化的分子数。
7.酶活力(酶活性):指酶催化一定化学反应的能力。
8.酶活力的大小:一定条件下所催化的某一化学反应的反应速度,9.酶反应速度:单位时间内底物的减少量或产物的增加量。
10.酶的活力单位(U,activity unit):酶活力的大小及酶含量的多少。
11.酶单位:在一定条件下,一定时间内将一定量的底物转化为产物所需要的酶量。
这样酶的含量可以用每克酶制剂或每毫升酶制剂含有多少酶单位来表示(U/g或U/ml)。
12.Katal(Kat)单位:一个katal单位是指在最适反应条件下,1秒钟催化1moL底物转化为产物所需要的酶量。
13.酶的比活力(specific activity):代表酶的纯度,比活力用每mg蛋白质所含有的酶活力单位数表示。
对同一种酶比活力愈大,纯度愈高。
14.酶的转换数:以一定条件下每秒钟每个酶分子转换底物的分子数来表示酶的催化效率。
15.酶动力学:是研究酶促反应的速度以及影响此速度的各种因素的科学。
16.抑制剂:任何分子直接作用于酶使他的催化速度降低即称为~。
17.不可逆抑制作用:抑制剂与酶的必需基团以共价键结合而引起酶活性丧失,不能用透析,超滤或凝胶过滤等物理方法去除抑制剂而使酶复活。
18.可逆抑制作用:抑制剂与酶以非共价键结合而引起酶活性的降低或丧失,能用物理的方法除去抑制剂而使酶复活。